預臭氧化去除水中有機物效果及其生物穩定性
張紅專, 張永明, 高乃云, 張新華, 梁曉天
(1.上海師范大學 建筑工程學院,上海 201418; 2.上海師范大學 生命與環境科學學院,上海 200234; 3.同濟大學 環境科學與工程學院,上海 200092)
0 引 言
2009年中國環境狀況公報[1]顯示全國地表水污染依然較重.七大水系總體為輕度污染,204條河流409個國控斷面中,Ⅰ~Ⅲ類水質占57.3%,Ⅳ、Ⅴ類和劣Ⅴ類水質占42.7%.全國城市90%以上水域受到污染,最突出的是有機物污染問題.水源水中的氨氮、COD、BOD、TOC等濃度高,溶解氧少,甚至消耗殆盡,某些污染嚴重的水體經常出現黑臭的嚴重情況.這些有機污染嚴重的水源作為給水水源,由于大量有機耗氧物質的存在,經常規的工藝處理后,難以達到《生活飲用水衛生標準》(GB 5749-2006)(以下簡稱《標準》)的要求(新增的有機物綜合性指標——耗氧量指標是為了控制水中微量的有機物).
因此,探求經濟有效地降低和去除飲用水中微污染有機物的新飲用水處理方法,成為人們關注的焦點.臭氧具有很強的氧化能力,它可以通過破壞有機污染物的分子結構以達到改變污染物性質的目的,能去除水中的色、嗅、味、藻毒素等[2-6],并且不會像氯那樣產生有害鹵代化合物,因此目前飲用水預處理技術正逐漸推廣使用臭氧氧化的方法,世界上已有1000多座水廠應用臭氧技術處理[7].我國自20世紀80年代起,對臭氧的研究逐漸增多,但針對不同的原水水質,其工藝參數、處理效果,以及預臭氧化處理后水的生物穩定性還需細致地試驗研究.本試驗以黃浦江上游水源為原水,采用中試設備,通過在飲用水常規處理工藝前預加臭氧氧化和預加氯氧化對比試驗,研究預臭氧化工藝對水中有機物的去除效果,并對預臭氧化處理后水的生物穩定性進行分析.
1 研究內容與試驗方法
1.1 試驗裝置與工藝流程
試驗裝置與工藝流程見圖1.原水經取樣泵均分兩路,采用平行的兩工藝流程.在預臭氧化工藝(以下簡稱1#工藝)中,臭氧發生器以氧氣為氣源,采用無聲放電法制備臭氧;接觸柱為氣水逆流式,氣自下而上,水自上而下;曝氣器為微孔鈦板,孔徑20 μm;接觸柱有效水深為6 m,氣水接觸時間為11 min;臭氧投加量為1.23 mg·L-1左右.在預氯化工藝(以下簡稱2#工藝)中,于機械攪拌反應池入口端投加次氯酸鈉,有效氯投加量為3.0 mg·L-1.
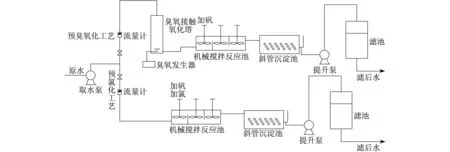
圖1 試驗裝置與工藝流程圖
1.2 試驗條件與工藝參數
預臭氧化工藝和預氯化工藝取用相同的原水,并采用以下相同的試驗條件和工藝參數:
(1) 運行水量為1 m3·h-1;
(2) 混凝劑為液態聚合硫酸鋁(PAS),投加量為42 mg·L-1;
(3) 機械攪拌反應池依水流方向均分3檔,各檔速度梯度G值依次為60 s-1、31 s-1、15 s-1,反應時間15 min;
(4) 斜管沉淀池為非標斜管沉淀池,斜管為正六邊形蜂窩狀,傾角為60°,池子的有效水深1.0 m,清水區實際上升流速為0.17 mm·s-1;
(5) 濾池用有機玻璃加工而成,直徑為40 cm;采用均質石英砂濾料,粒徑0.8~1.0 mm,濾層高度為126 cm;
(6) 濾速8~9 m·h-1,反沖洗周期為24 h,反沖洗強度為14~16 L·s-1·m-2,反沖洗時間5~6 min.
1.3 研究內容與檢測方法
待預臭氧化和預氯化兩工藝按上述試驗條件穩定運行2 d后,在原水箱、臭氧接觸氧化塔、1#工藝沉淀池、濾池、2#工藝沉淀池、濾池6個出口,按標準方法取樣,然后分別進行檢測分析,試驗中還對1#工藝濾后水進行加氯消毒,有效氯投加量為2.0 mg/L,并保證接觸30 min.
由于有機物種類繁多,檢測難度很大.本研究采用CODMn、UV254、TOC這3種替代參數表示有機物含量.
CODMn的測定:采用酸性高錳酸鉀滴定法;
UV254的測定:采用紫外分光光度法;
TOC的測定:采用TOC儀測定;
AOC的測定:外送某環境工程設計研究院測定.
2 試驗結果與討論
2.1 預臭氧化對CODMn的去除
CODMn是在一定條件下,以KMnO4為氧化劑,處理水樣時所消耗的量.它常被作為評價水體受還原性物質污染的一項指標.這些還原性物質包括某些有機物和亞硝酸鹽、亞鐵鹽、硫化物等無機物.由于在規定的條件下,水中有機物只能部分被氧化,所以CODMn不能作為反映水體中有機物總含量的指標,目前CODMn多用于污染不太嚴重的天然水和清水.
試驗結果見表1,由表1可見:由于原水CODMn較高,2#工藝濾后水平均值超出《標準》(CODMn<3 mg·L-1),1#工藝濾后水平均值已達標,預臭氧化工藝對CODMn的去除率為51.4%,比預氯化工藝提高2.5%.
2.2 預臭氧化對UV254的去除
UV254是非揮發性總有機碳和三鹵甲烷前驅物的良好替代參數.常見紫外光譜波長范圍為200~400 nm,即近紫外區.根據光譜分析的結果,一般的飽和有機物在近紫外區無吸收,含共軛雙鍵或苯環的有機物在紫外區有明顯的吸收或特征峰,含苯環的簡單芳香族化合物的主要吸收波長在250~260 nm,多環芳烴吸收波長向紫外區長波方向偏移.總之,UV254不但與水中有機物總量(TOC或DOC)有關,而且與三鹵甲烷的形成潛能(THMFP)有較好的相關性,此外還與色度等有關,因此UV254是了解水質特性的“窗口”.
試驗結果見圖2,由圖2可見,1#工藝對UV254去除率明顯高于2#工藝,1#工藝對UV254的平均去除率為84.5%,比2#工藝提高了6%.
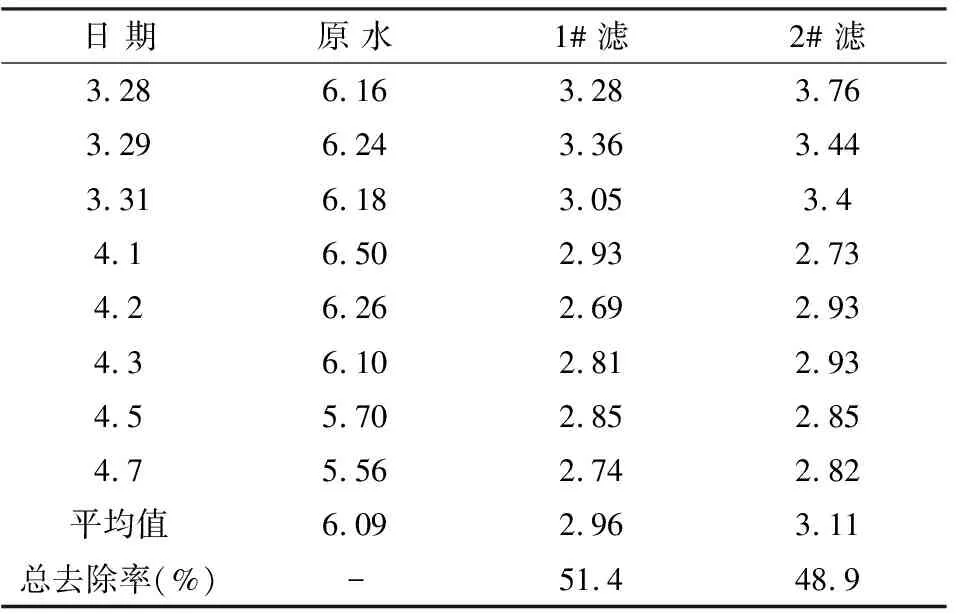
表1 原水及兩工藝濾后水CODMn測定結果及分析
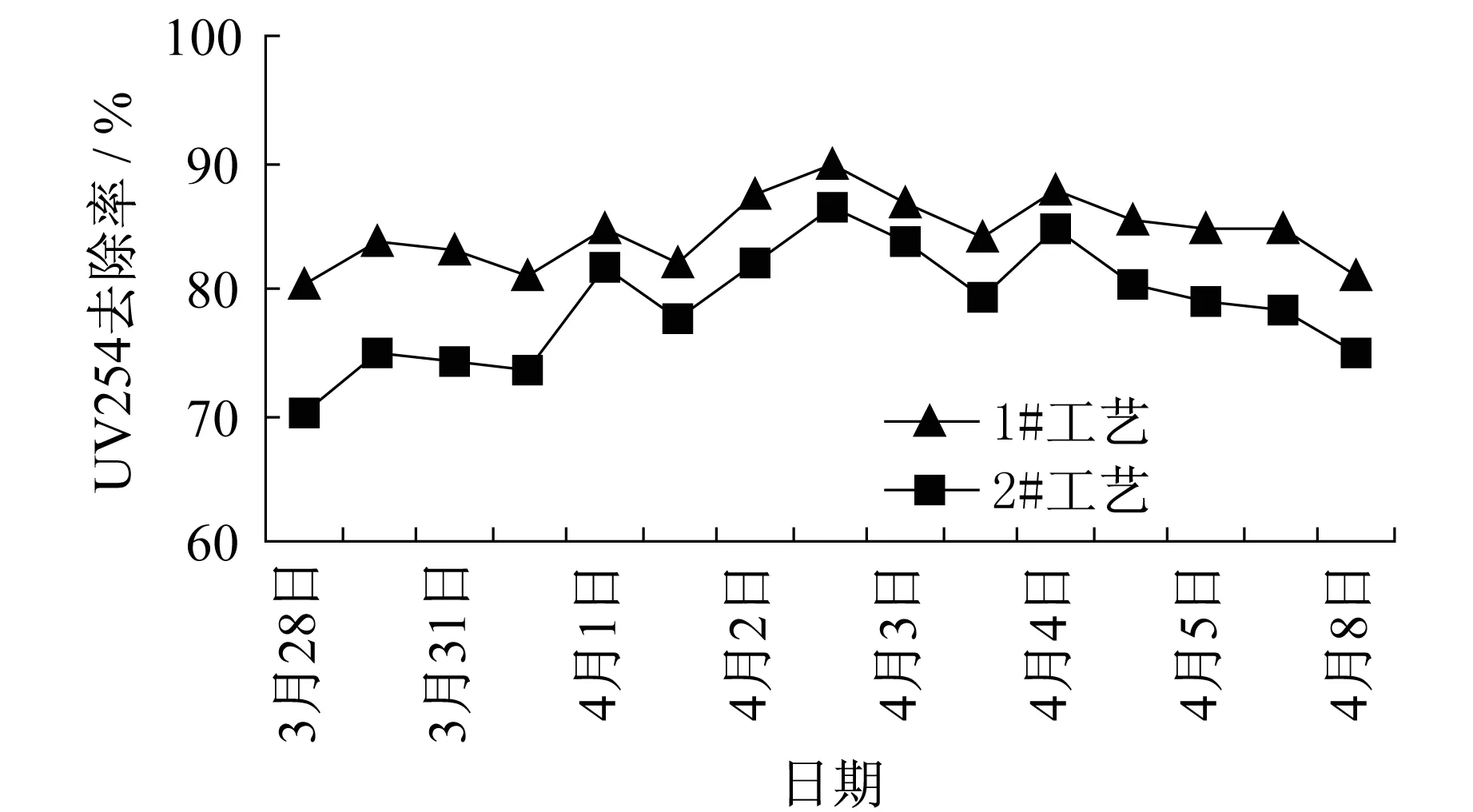
圖2 兩工藝對UV254的去除率對比圖
2.3 預臭氧化對TOC的去除
TOC(總有機碳)是以碳的含量表示水體中有機物質總量的綜合指標.由于TOC的測定采用燃燒法,能將有機物全部氧化,它比BOD、COD更能直接表示有機物的總量,因此TOC常被用來評價水體中有機物污染程度.
檢測與分析結果見表2,表中“1#濾消毒”為對1#工藝濾后水進行加氯消毒處理后的水樣,加氯量為3 mg/L.由表2可看出:(1) 兩工藝對TOC的總去除率都不高,這是因為常規混凝劑,尤其是鋁系混凝劑,不利于臭氧氧化去除TOC;(2) 兩工藝對TOC的去除,主要由沉淀池承擔,濾池對TOC的去除率極小;(3) 預臭氧化濾后水加氯消毒后,TOC濃度增加,說明加氯會引起新的有機物形成.
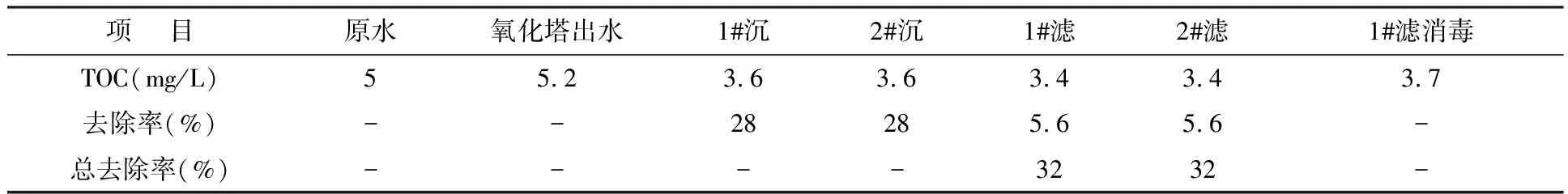
表2 兩工藝各取樣點TOC濃度及去除效果分析
2.4 預臭氧化水中生物穩定性評價指標AOC
生物可同化有機碳AOC(Assimilable Organic Carbon)表示飲用水中有機營養物的濃度,是飲用水生物穩定性的評價指標之一[8].AOC是微生物極易利用的基質,是有機物中最易被細菌吸收、直接同化成細菌體的部分,是生物可降解的溶解性有機碳的一部分.盡管AOC僅為飲用水中溶解性有機碳(DOC)的0.1%~9%,但它是細菌獲得酶活性進而對有機物進行共代謝最為重要的基質,因此AOC的濃度與細菌的繁殖有著密切的關系[9].如果飲用水中有機營養物含量高,即AOC高,水質的生物穩定性就差,細菌就容易在水中生長,致病菌出現的可能性就會增強.
AOC的測定方法最早是由荷蘭的Van der Kooij提出的[10],測定所用的菌種是20世紀70年代末期從自來水中分離出來的熒光假單胞菌P17(Fluorescent Pseudomonas)和螺旋菌NOX(Spirillum),以乙酸鈉作為標準基質,對生長到靜止期的細菌進行平板計數.測定時,將待測水樣分成2份,分別接種P17菌和NOX菌,培養計數并計算出AOC-P17和AOC-NOX,二者之和就是總AOC.因為1 μg·L-1的乙酸鈉可產生1×104個·mL-1菌落,所以此方法具有很好的檢出精度,最低檢出濃度1 μg·L-1,這在目前最先進的TOC測定儀上也是難以實現的.因此,AOC不但具有明確的生物學意義,也是一種很好的生物-化學檢測方法.
分析結果見圖3,檢測報告見表3.從圖3和表3可看出:(1)無論是接種P17菌還是NOX菌,培養計數結果均一致,1#工藝的沉淀池、濾池出水AOC均明顯大于2#工藝,這一方面說明預臭氧化工藝出水生物穩定性差,可能在管網中滋生細菌,另一方面又反映了臭氧改變了水中有機物的特性,將一些大分子有機物氧化成易被微生物降解的小分子,加強了水中有機物的可生物降解性;(2)1#工藝沉淀池出水AOC明顯高于原水AOC,而濾池出水AOC則大大減少,這說明在預臭氧化工藝流程中,沉淀階段主要是臭氧將大分子有機物氧化成小分子,增加了生物可同化有機碳AOC的總量,而過濾階段則能有效地去除AOC,濾池對沉淀池出水AOC的去除率達42.7%;(3)1#工藝濾后水加氯消毒處理后水樣AOC最高,這說明預臭氧化工藝出水生物穩定性較差,因此預臭氧化工藝后續不適宜用加氯消毒的方法.
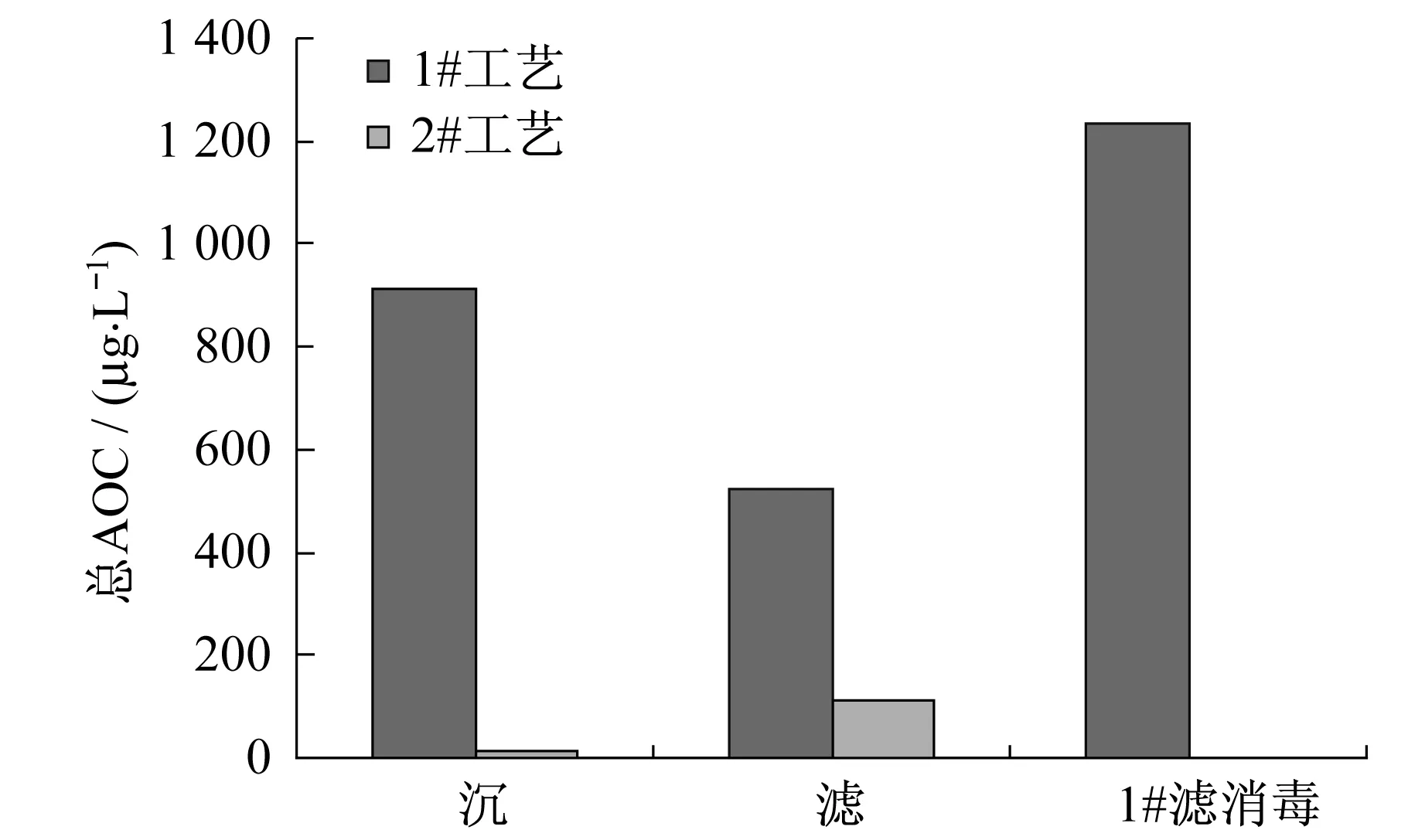
圖3 兩工藝出水AOC對比圖
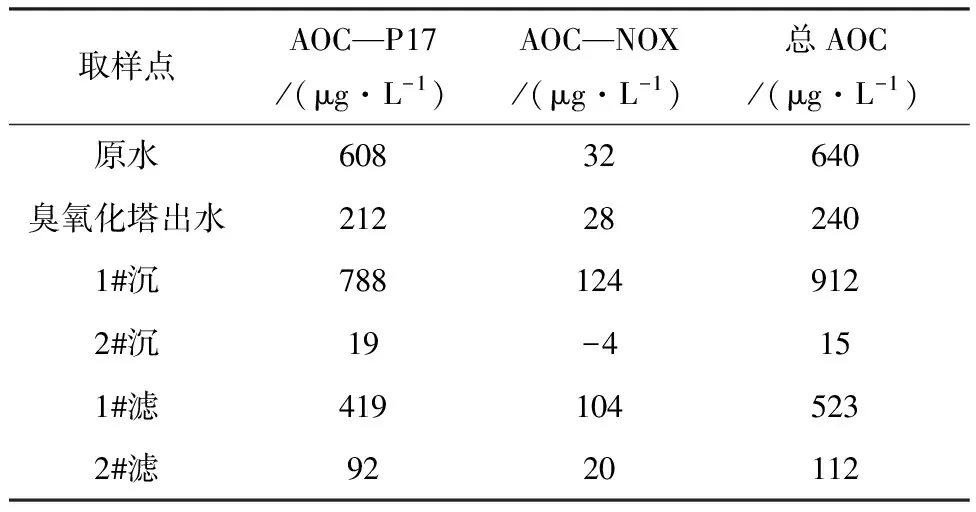
表3 各水樣AOC測試結果報告
3 結 論
(1) 在原水CODMn為5.56~6.50 mg·L-1情況下,預臭氧化工藝對CODMn的去除率為51.4%,比預氯化工藝提高2.5%.
(2) 預臭氧化工藝對UV254的去除率為84.5%,比預氯化工藝提高了6%.
(3) 預臭氧化工藝和預氯化工藝對TOC的去除率均不高,同為32%左右,且兩工藝對TOC的去除,主要都由沉淀池承擔,濾池對TOC的去除率較低,僅為沉淀池的1/5.
(4) 預臭氧化工藝出水生物穩定性差,AOC明顯大于預氯化工藝;沉淀階段增加了AOC的總量,而過濾階段則能有效地去除AOC,濾池對沉淀池出水AOC的去除率達42.7%;預臭氧化工藝后續不適宜用加氯消毒的方法.
參考文獻:
[1] 國家環保總局.2009 中國環境狀況公報[EB/OL].(2009-6-5)[2014-5-7]www.sepa.gov.cn.
[2] GONG J L,LIU Y D,SUN X B.O3and UV/O3oxidation of organic constituents of biotreated municipal wastewater[J].Water Research,2008,42(4):1238-1244.
[3] BERYL Z,SUSAN B W.Actinomycetes in relation to taste and odour in drinking water:Myths,tenets and truths[J].Water Res,2006,40(9):1741-1753.
[4] ANDREAS P,VON G U.Oxidation kinetics of selected taste and odor compounds during ozonation of drinking water[J].Environ Sci Technol,2007,41(2):626-631.
[5] RODRIGUEZ E,ONSTAD G D,KULL T P,et a1.Oxidative elimination of cyanotoxins:comparison of ozone,chlorine,chlorine dioxide and permanganate[J].Water Research,2007,41(15):3381-3393.
[6] 王龍,李思敏,李艷平.臭氧組合工藝處理微污染水源水的試驗研究[J].河北工程大學學報:自然科學版,2007,24(2):50-54.
[7] GUNTEN U V.Ozonation of drinking water :partⅠ,oxidation kinetcs and product formation[J].Water Res,2003,37(5):1443-1467.
[8] LIU W,WU H,WANG Z,et al.Investigation of assimilable organic carbon(AOC) and bacterial regrowth in drinking water distribution system[J].Water Res,2002,36(4):891-894.
[9] CHANG D,PHILIP C S.The impact of ozonation particle stability and the removal of TOC and THM precursors[J].AWWA,1991,83(3):71-73.
[10] VAN D K D,VISSER A,HIJNEN W.Determining the concentration of easily assimilable organic carbon in drinking water[J].Am Water Works Assoc,1982,74(10):540-545.

