細胞色素P450CYP3A65斑馬魚模型建立及對環境污染物的生物響應
李春杰,趙 建,張世勇,潘微彤,蒲韻竹,賈啟燕,查曉丹,尚艷楠,黃春倩,劉艷琴,鐘玉緒,李 前,丁日高,付愛玲,趙寶全
(1.西南大學藥學院,重慶 400715;2.軍事醫學科學院毒物藥物研究所毒理學與抗毒藥物研究國家重點實驗室,北京 100850;3.內蒙古通遼市科爾沁區第一人民醫院骨一科,內蒙古通遼 028000)
細胞色素P450CYP3A65斑馬魚模型建立及對環境污染物的生物響應
李春杰1,2,趙 建2,張世勇3,潘微彤2,蒲韻竹2,賈啟燕2,查曉丹2,尚艷楠2,黃春倩2,劉艷琴2,鐘玉緒2,李 前2,丁日高2,付愛玲1,趙寶全2
(1.西南大學藥學院,重慶 400715;2.軍事醫學科學院毒物藥物研究所毒理學與抗毒藥物研究國家重點實驗室,北京 100850;3.內蒙古通遼市科爾沁區第一人民醫院骨一科,內蒙古通遼 028000)
目的 建立細胞色素P450CYP3A65熒光標記轉基因斑馬魚用于快速、直觀檢測重金屬(銅、鎘、鋅)及類二噁英化合物五氯聯苯(PCB126)等環境污染物。方法 PCR方法釣取斑馬魚CYP3A65基因調控序列,構建于pT2AL200R150G轉座載體克隆位點,將pTol2-CYP3A65-EGFP質粒與pCS-TP轉座酶mRNA共同注射入斑馬魚胚胎單細胞,通過熒光篩選,遺傳選育和建立熒光標記轉基因斑馬魚品系Tg (CYP3A65-EGFP);利用該轉基因斑馬魚胚胎及幼魚檢測上述3種重金屬及PCB126的生物學響應。結果 成功建立了CYP3A65熒光標記轉基因斑馬魚品系,綠色熒光在肝和消化道表達;該轉基因斑馬魚對3種重金屬及PCB126產生生物學響應。染毒96 h后,銅0.1和0.2 μmol·L-1、鎘0.35和0.7 μmol·L-1組、鋅1.5和3 μmol·L-1組、PCB126所有濃度組熒光相對表達量顯著增強(P<0.01);銅0.9 μmol·L-1組、鎘2.7和5.4 μmol·L-1組及鋅24 μmol·L-1組熒光相對表達量顯著減弱(P<0.01);染毒168 h后,銅0.1和0.2 μmol·L-1組、鎘0.35和0.7 μmol·L-1組、鋅1.5和3 μmol·L-1組及PCB126 2~32 μmol·L-1濃度組熒光相對表達量顯著增強(P<0.01),銅0.9 μmol·L-1組、鎘2.7和5.4 μmol·L-1組、鋅12和24 μmol·L-1組熒光相對表達量減弱(P<0.05),隨著濃度增加熒光減弱,呈現出量效關系。結論 CYP3A65熒光標記轉基因斑馬魚模型可以用來檢測銅、鎘、鋅及PCB126等環境污染物。
細胞色素P450 CYP3A65;斑馬魚,轉基因;銅;鎘;鋅;多氯聯苯化合物
細胞色素P450(cytochmme P-450,CYP450)是生物體內含有多種超家族CYP450血紅蛋白或相同結構域的酶系,對許多外源及內源化合物在生物體內的生物轉化具有重要的作用。研究發現,污染物可誘導CYP450在mRNA、蛋白、酶活性水平上產生變化。細胞色素P450作為生物標志物,其活性、蛋白含量和基因的表達已逐漸用于環境毒性檢測,通常表現為被外源污染物誘導或抑制而使其活性或蛋白及mRNA含量顯著增加或降低[1-4]。目前,魚類細胞色素CYP1A已廣泛應用于環境毒理學的研究[5-8]。
CYP3A是動物肝中含量最豐富的CYP450酶,參與大多數藥物或環境因子的生物轉化[9]。斑馬魚CYP3A65是CYP3A的直系同源物,主要在肝和小腸表達[10]。 Machala 等[11]證明魚類CYP3A可以被一些有機氯化合物及類二噁英化合物五氯聯苯(3,3′4,4′,5-pentachlorobiphenyl,PCB126)誘導,可作為環境毒性檢測的另一候選CYP450酶生物標志物。利用斑馬魚胚胎和幼魚對有害物質非常敏感的優勢[12],本實驗利用pT2AL200R150G轉座子系統[13-14]建立斑馬魚CYP3A65基因調控的熒光標記斑馬魚,通過觀察和定量斑馬魚CYP3A65基因調控序列調控綠色熒光蛋白(green fluorescein protein,GFP)基因表達情況,用于快速、直觀檢測環境重金屬離子及PCB126,為其作為生態及環境毒性的生物檢測提供數據支撐。
1 材料與方法
1.1 儀器與藥品
斑馬魚循環水養殖系統(北京愛生科技公司);精密電子天平AEG-120(日本島津);PCR儀(Bio-Rad);熒光顯微鏡(日本奧林巴斯);顯微注射儀X221942H(日本尼康)。PCB126純度大于98.5% (DrEhrenstorfer GmbH,德國);CuSO4、CdCl2、ZnSO4、二甲亞砜(DMSO)均為國產分析純;DNA Marker、基因組提取、凝膠回收、質粒提取等常規分子生化試劑和試劑盒均購于北京天根生化科技有限公司;XhoⅠ和BamHⅠ酶均購于美國NEB公司;TOYOBO KOD FX酶購于北京康為世紀生物科技有限公司;mMESSGE mMACHINE(SP6)試劑盒購于美國Ambion公司;pT2AL200R150G質粒和pCS-TP質粒由中國科學院上海生科院神經研究所杜久林研究員惠贈;基因探針由賽百盛公司合成;基因測序由生工生物技術公司完成。
1.2 實驗生物
AB系成年斑馬魚由北京大學生命科學學院提供,本實驗室循環養殖系統飼養,循環養殖水按照Brand等[15]的方法配制:毎1000 L去離子水中含碳酸氫鈉75 g,海鹽18 g和硫酸鈣8.4 g,水溫28~29℃,pH值7.2左右,總硬度62 mg·L-1(以CaCO3計),電導率485 μS,光照/黑暗周期為14 h∶10 h。斑馬魚胚胎由E3培養液培養,E3培養液亦按照他們的方法配制:每1000 L去離子水中含氯化鈉292.5 g、氯化鉀12.67 g、氯化鈣36.63 g和硫酸鎂39.6 g,并用碳酸氫鈉溶液調節pH值至7.2左右,電導率600 μS,斑馬魚胚胎置于生化恒溫培養箱中,溫度控制在(28.5±0.5)℃,光照/黑暗周期為14 h∶10 h。
1.3 CYP3A65熒光標記斑馬魚的培育及表達分析
通過GenBank檢索斑馬魚CYP3A65基因調控序列(Gene ID 553969),用Primer Premier5.0軟件設計引物,為了插入pT2AL200R150G載體,引入XhoⅠ和BamHⅠ酶切位點。引物由北京賽百盛基因技術有限公司合成,上游引物:5′-CCGCTCGAGGCCTGAGTGTTTGAAGTCTCCCT -3′;下游引物:5′-CGCGGATCCTGAAGATGATGAAGCTCAGACGG-3′。PCR反應體系及條件依照TOYOBO KOD FX酶使用說明書進行。構建流程見圖1。PCR產物及pT2AL200R150G分別用XhoⅠ和BamHⅠ雙酶切,回收啟動子片段和載體片段,連接得到質粒pTol2-CYP3A65-增強綠色熒光蛋白(enhanced GFP,EGFP)。送華大基因公司測序,測序結果正確(測序圖略)。Tol2轉座酶mRNA由pCS-TP通過mMESSGE mMACHINE試劑盒體外轉錄而得[16]。將pTol2-CYP3A65-EGFP質粒與pCS-TP轉座酶mRNA共同注射入斑馬魚胚胎單細胞,觀察GFP表達,篩選出在肝和小腸中特異性表達熒光個體(F0代)。為了得到穩定的轉基因斑馬魚品系,將轉基因親代(F0)與野生型斑馬魚雜交,篩選出在肝和小腸有特異性熒光表達的F1代,通過連續外交建立Tg(-6.3CYP3A65∶EGFP)的穩定轉基因品系。因轉基因斑馬魚GFP表達與CYP3A65基因時空表達基本一致[17],故通過熒光的表達判斷基因的表達。
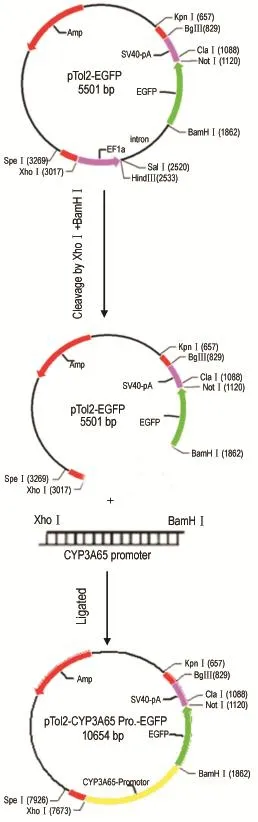
Fig.1 DiagramsofpToI2-CYP3A65-EGFPvector construction.
1.4 暴露實驗及熒光檢測
熒光顯微鏡下挑選分裂正常的CYP3A65轉基因斑馬魚受精卵(F2),在受精4 h(4 hpf)時進行染毒。采用水浴染毒的方式在六孔細胞培養板中進行,根據預實驗結果,用去離子水溶解成 CuSO40.1,0.2,0.6和0.9 μmol·L-1;CdCl20.35,0.7,1.4,2.7和5.4 μmol·L-1;ZnSO41.5,3,6,12和24 μmol·L-1,DMSO助溶PCB126濃度為2,4,8,16和32 μmol·L-1,濃度均為亞致死劑量,每個濃度組30枚胚胎。在染毒期間,每隔24 h更換50%染毒液,并及時挑出死亡個體。水溫保持在28.5℃,光照/黑暗周期控制在14 h/10 h。實驗暴露時間分別為96 h和168 h,熒光顯微鏡下觀察斑馬魚幼魚肝和腸道綠色熒光的變化,拍照和記錄。采用Imagepro-Plus6.0圖像分析軟件對各組進行灰度分析,計算每組幼魚熒光強度的積分吸光度值(integrated absorbance,IA)。
1.5 統計學處理
數據采用SPSS17.0進行單因素方差分析,采用最小顯著差數法(LSD)比較對照組與染毒組之間的差異。P<0.05表示差異具有顯著性統計學意義。
2 結果
2.1 CYP3A65熒光標記轉基因斑馬魚組織熒光的表現
受精后第 1天(1 dpf),轉基因斑馬魚系〔Tg(-6.3CYP3A65∶EGFP)〕在前腸區域有微弱熒光表達(圖2A);2dpf,Tg(-6.3CYP3A65∶EGFP)在肝胚芽和前腸區域有弱熒光表達(圖2B);3 dpf,Tg(-6.3CYP3A65∶EGFP)在肝處有較強的熒光表達(圖2C);4 dpf起,Tg(-6.3CYP3A65∶EGFP)在肝和前腸有強熒光表達(圖2D和E)。
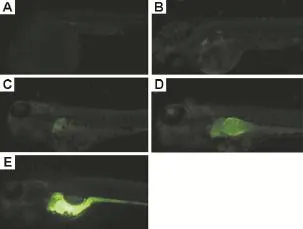
Fig.2 EGFP expression in Tg(-6.3CYP3A65∶EGFP) embryos/Iarvae at 1 dpf(A),2 dpf(B),3 dpf(C),4 dpf(D),5 dpf(E).dpf:day post fertilization.
2.2 銅、鎘、鋅暴露下Tg(-6.3CYP3A65∶EGFP)斑馬魚組織中CYP3A65基因表達量的變化
2.2.1 銅
Cu2+對斑馬魚幼魚CYP3A65基因表達的影響見圖3。銅染毒96 h后,0.1和0.2 μmol·L-1組熒光表達水平與對照組比有所增強,其中銅0.1 μmol·L-1組為對照組的約1.5倍,差異有顯著統計學意義(P<0.01);0.6 μmol·L-1組與對照組比沒有明顯變化;0.9 μmol·L-1組熒光表達水平與對照組比顯著減弱,為對照組的0.32倍,差異有顯著統計學意義(P<0.01),隨著染毒濃度的增加,呈現出明顯的量效關系(圖3A)。染毒168 h后,銅0.1和0.2 μmol·L-1組熒光表達水平與對照組比顯著增強,其中0.1 μmol·L-1組為對照組的1.79倍,差異顯著(P<0.01),相比于染毒96 h熒光表達誘導作用增強;0.6 μmol·L-1組與對照組比無明顯變化;0.9 μmol·L-1組熒光表達水平與對照組比顯著減弱(P<0.01),為對照組的0.94倍,相比于染毒96 h對熒光表達抑制作用減弱,隨著染毒濃度的增加,呈現出量效關系(圖3B)。

Fig.3 Effect of copper on enhanced green fIuorescein protein(EGFP)expression of Tg(-6.3CYP3A65∶EGFP) Iarvae at 96 h(A)and 168 h(B).1:normal control;2-5: exposed to copper 0.1,0.2,0.6 and 0.9 μmol·L-1groups,respectively.C was the semi-quantitative results of A and B.,n=10.?P<0.05,??P<0.01,compared with control group.
2.2.2 鎘
Cd2+對斑馬魚幼魚CYP3A65基因表達量的影響見圖4。與對照組比,鎘染毒96 h后,0.35和0.7 μmol·L-1組熒光表達水平顯著增強,其中0.35 μmol·L-1組為對照組的2.8倍,差異有顯著統計學意義(P<0.01),1.4 μmol·L-1組與對照組比差異無明顯變化,2.7組和5.4 μmol·L-1組熒光表達水平與對照組比顯著減弱,其中5.4 μmol·L-1為對照組的0.55倍,差異有顯著統計學意義(P<0.01),隨著染毒濃度的增加,呈現出量效關系(圖4A);染毒168 h后,0.35和0.7 μmol·L-1組熒光表達水平與對照組比顯著增強,其中0.35 μmol·L-1組為對照組的3.4倍,差異有顯著統計學意義(P<0.01),相比于染毒96 h對熒光表達誘導作用增強,1.4 μmol·L-1組與對照差異仍無明顯變化,2.7組和5.4 μmol·L-1組熒光表達水平與對照組比顯著減弱,其中5.4 μmol·L-1為對照組的 0.33倍,差異有顯著統計學意義(P<0.01),相比于染毒96 h對熒光表達抑制作用增強,隨著染毒濃度的增加,呈現量效關系(圖4B)。
2.2.3 鋅
Zn2+對斑馬魚幼魚CYP3A65基因表達量的影響見圖5。與對照組相比,鋅染毒96 h后,1.5和3 μmol·L-1組熒光表達水平顯著增強,其中1.5 μmol·L-1組為對照阻的2.0倍,差異有顯著統計學意義(P<0.01),6和12 μmol·L-1組與對照組比差異無明顯變化,24 μmol·L-1組熒光表達水平與對照組比顯著減弱,為對照組的0.65倍,差異有顯著統計學意義(P<0.01),隨著染毒濃度的增加,呈現出量效關系(圖5A);染毒168 h后,1.5和3 μmol·L-1組熒光表達水平與對照組比顯著增強,其中1.5 μmol·L-1組為對照阻的2.6倍,差異有顯著統計學意義(P<0.01),相比于染毒96 h對熒光表達誘導作用增強,6 μmol·L-1組與對照組比差異無明顯變化,12和24 μmol·L-1組熒光表達水平與對照組比顯著減弱,其中24 μmol·L-1組為對照組的0.58倍,差異有顯著統計學意義(P<0.01),相比于染毒96 h對熒光表達抑制作用增強,隨著染毒濃度的增加,呈現量效關系(圖5B)。
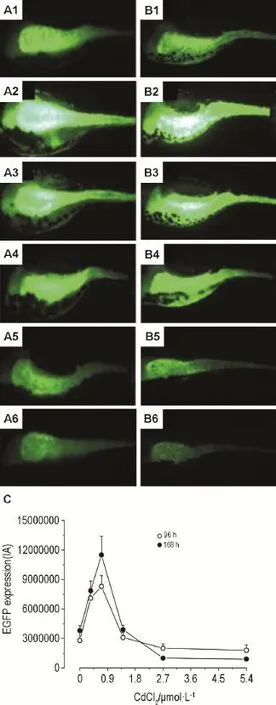
Fig.4 Effect of cadmium on EGFP expression of Tg(-6.3CYP3A65∶EGFP)Iarvae at 96 h(A)and 168 h (B).1:normal control;2-6:exposed to cadmium 0.35,0.7,1.4,2.7 and 5.4 μmol·L-1groups,respectively.C was the semiquantitative results of A and B.n=10.?P<0.05,??P<0.01,compared with control group.
2.3 PCB126暴露下Tg(-6.3CYP3A65∶EGFP)斑馬魚組織CYP3A65基因表達量變化

Fig.5 Effectofzinc on EGFP expression of Tg(-6.3CYP3A65∶EGFP)Iarvae at 96 h(A)and 168 h (B).1:normal control;2-6:exposed to zinc 1.5,3,6,12 and 24 μmol·L-1groups,respectively.C was the semi-quantitative results of A and B.n=10.?P<0.05,??P<0.01,compared with control group.
PCB126對 Tg(-6.3CYP3A65∶EGFP) CYP3A65基因表達的影響見圖6。PCB126染毒96 h后,與對照組比,所有染毒組熒光表達水平顯著增強,其中16 μmol·L-1組為對照組的3.7倍,差異顯著(P<0.01),隨著染毒濃度的增加,呈現出顯著的量效關系(圖6A);染毒168 h后,所有染毒組熒光表達水平與對照組比顯著增強,其中16 μmol·L-1組為對照組的3.8倍,差異顯著(P<0.01),相比于染毒(96 h)熒光表達誘導作用有所增強,隨著染毒濃度的增加,呈現出顯著的量效關系(圖6B)。

Fig.6 Effect of PCB126 on EGFP expression of Tg(-6.3CYP3A65∶EGFP)Iarvae at 96 h(A)and 168 h (B).1:normal control;2-6:exposed to PCB126 2,4,8,16 and 32 μg·L-1groups,respectively.C was the semi-quantitative results of A and B.n=10.?P<0.05,??P<0.01,compared with control group.
3 討論
本實驗斑馬魚暴露染毒,通過觀察熒光變化,判定對毒物的生物學響應。本轉基因斑馬魚在第4天有較強熒光表達,受精后4d胚胎孵化已經完成,胚胎均已出殼,適合整體觀察,隨著發育,色素沉積逐漸增多,7 d后大量色素沉積,影響熒光觀察,所以本研究選擇4 d和7 d兩個時間點觀察。實驗發現,染毒96 h后,銅、鎘、鋅對斑馬魚幼魚熒光表達的總體趨勢呈現低濃度誘導而高濃度抑制的作用,染毒168 h后,低濃度組的誘導作用和高濃度組的抑制作用表現得更加明顯。誘導CYP450的作用機制主要是基因轉錄水平的提高[18],抑制的作用機制尚不清楚,可能與細胞內轉錄因子的生成及活性有關。Korashy等[19]研究發現,重金屬對CYP450含量的影響與NF-κB和激活蛋白活性密切相關。Hesham 等[20]證實重金屬 Cu2+,汞(Hg2+),鉛(Pb2+)可以直接通過與芳香烴受體(aryl hydrocarbon receptor,AHR)結合后誘導CYP1A基因的表達,毒性與其和AHR的親和力程度有關,何楨等[21]研究發現Hg2+染毒7 d后CYP1A基因相對轉錄量呈現出低濃度升高,中、高濃度降低的變化規律,與本實驗結果熒光相對表達量的變化規律基本一致。肖衎等[22]研究發現Cu2+,Cd2+染毒48 h和96 h后,CYP3A mRNA表達有顯著的誘導作用,呈現低濃度暴露誘導作用增強,高濃度暴露誘導作用減弱的變化規律,未發現抑制變化可能與給藥濃度的大小有關。斑馬魚CYP3A65基因表達的調控機制主要受AHR和孕烷 X受體(pregnane X receptor,PXR)介導[10],也可通過AHR獨立介導[17]。本實驗結果表明,這3種重金屬可通過與AHR和PXR受體結合誘導以CYP3A65上游調控序列指導的GFP基因表達,為CYP3A65基因mRNA表達量作為重金屬類污染物的生物指示物提供了一定依據,其他重金屬暴露能否出現同樣規律需進一步研究。
本研究發現,亞致死劑量PCB126均對熒光表達表現顯著的誘導作用,且低濃度暴露誘導作用增強,高濃度暴露誘導作用減弱,呈現顯著的劑量與效應關系;染毒168 h后,誘導作用越明顯。結果與PCB126對斑馬魚胚胎CYP1A mRNA表達影響的變化規律一致[23],因其能激活AHR而誘導CYP1A基因的表達[1,24]。最新研究發現,二噁英化合物TCDD或其他AHR激動劑可通過AHR2途徑強烈誘導斑馬魚CYP3A65基因的表達[11,17]。雖然此類化合物對CYP3A65蛋白及其活性水平變化與CYP3A65轉錄水平是否一致還不清楚,但其劑量與響應關系顯著說明了CYP3A65 mRNA水平上的變化可以用于其毒性的檢測。本轉基因斑馬魚模型用于這3種重金屬和類二噁英化合物等環境污染物檢測,可以將環境污染物進行一定梯度的倍比稀釋,觀察各濃度組的熒光表達變化,通過與對照組的比較確定是低濃度誘導還是高濃度抑制,從而推算出環境污染物的濃度范圍。
CYP酶是代謝酶,對毒物可產生解毒或活化效應,本身的表達改變(誘導或抑制)與毒性的關系,根據毒物的性質(或種類)的不同而存在差異。本實驗建立的Tg(-6.3CYP3A65∶EGFP)模型對這3種重金屬的反應,從量效關系分析,銅0.1 μmol·L-1、鎘0.35 μmol·L-1和鋅1.5 μmol·L-1均能使熒光表達高度上調;從濃度劑量上觀察銅的誘導作用大于鎘,鎘的誘導能力大于鋅;但如從毒性大小分析,銅的毒性大于鎘,鎘毒性大于鋅。PCB126的熒光表達隨濃度增高而增加,16 μmol·L-1時達到最大值,在相同劑量下熒光誘導強度比這3種重金屬偏弱,表明毒性比它們的毒性低。其他生物學效應需進一步研究。
本實驗發現重金屬(銅、鎘、鋅)和類二噁英化合物(PCB126)對CYP3A65熒光標記斑馬魚幼魚熒光強度有一定的影響,具有一定的量效關系,表明斑馬魚CYP3A65基因調控序列(-6.3 kb)調控GFP建立的熒光標記斑馬魚Tg(-6.3CYP3A65∶EGFP)模型,在一定的濃度范圍內能夠檢測銅、鎘、鋅及二噁英等環境污染物。
[1] Siroka Z,Drastichova J.Biochemical markers of aquatic environment contamination-cytochrome P450 in fish[J].Acta Vet,2004,(1):123-132.
[2] Sturve J, Hasselberg L, F?lth H, Celander M,F?rlin L.Effects of North Sea oil and alkylphenols on biomarker responses in juvenile Atlantic cod (Gadus morhua)[J].Aquat Toxicol,2006,78 (Suppl 1):S73-S78.
[3] Nahrgang J,Camus L,Carls MG,Gonzalez P,J?nsson M,Taban IC,et al.Biomarker responses in polar cod(Boreogadus saida)exposed to the water soluble fraction of crude oil[J].Aquat Toxicol,2010,97(3):234-242.
[4] Nahrgang J,Camus L,Gonzalez P,J?nsson M,Christiansen JS,Hop H.Biomarker responses in polar cod(Boreogadus saida) exposed to dietary crude oil[J].Aquat Toxicol,2010,96(1): 77-83.
[5] Pesonen M,Goks?yr A,Andersson T.Expression of P4501A1 in a primary culture of rainbow trouthepatocytes exposed to beta-naphthoflavone or 2,3,7,8-tetrachlorodibenzo-p-dioxin[J].Arch Biochem Biophys,1992,292(1):228-233.
[6] Goks?yr A,Hus?y AM.The cytochrome P450 1A1 response in fish:application of immunodetection in environmental monitoring and toxicological testing[J].Mar Environ Res,1992,34(1):147-150.
[7] Agradi E,Baga R,Cillo F,Ceradini S,Heltai D. Environmental contaminants and biochemical response in eel exposed to Po river water[J]. Chemosphere,2000,41(10):1555-1562.
[8] Rotchell JM,?Steventon GB, Bird DJ.Catalytic properties of CYP1A isoforms in the liver of an agnathan(Lampetra fluviatilis)and two species of teleost(Pleuronectes flesus,Anguilla anguilla)[J]. Comp Biochem PhysiolC ToxicolPharmacol,2000,125(2):203-214.
[9] Goodwin B,Redinbo MR,Kliewer SA.Regulation of cyp3a gene transcription by the pregnane X receptor[J].Annu Rev Pharmacol Toxicol,2002,42:1-23.
[10] Tseng HP,Hseu TH,Buhler DR,Wang WD,Hu CH.Constitutive and xenobiotics-induced expression of a novel CYP3A gene from zebrafish larva [J].Toxicol Appl Pharmacol,2005,205(3):247-258.
[11] Machala M,Nezveda K,Petˇrivalsky M,Jaro?ová A,Piaˇcka V,Svobodová Z.Monooxygenase activities in carp as biochemical markers of pollution by polycyclic and polyhalogenated aromatic hydrocarbons:choice of substrates and effects of temperature,gender and capture stress[J].Aquat Toxicol,1997,37(2):113-123.
[12] Parng C.In vivo zebrafish assays for toxicity testing[J].Curr Opin Drug Discov Dev,2005,8(1): 100-106.
[13] Kawakami K.Tol2:a versatile gene transfer vector in vertebrates[J].Genome Biol,2007,8(Suppl 1):S7.
[14] Urasaki A, Asakawa K, Kawakami K.Efficient transposition of the Tol2 transposable element from a single-copy donor in zebrafish[J].Proc Natl Acad Sci USA,2008,105(50):19827-19832.
[15] Brand M,Granato M,Nüsslein-Volhard C.Keeping and Raising Zebrafish[M].Oxford: Oxford University Press,2002:7-37.
[16] Kawakami K,Takeda H,Kawakami N,Kobayashi M,Matsuda N,Mishina M.A transposon-mediated gene trap approach identifies developmentally regulated genes in zebrafish[J].Dev Cell,2004,7(1):133-144.
[17] Chang CT,Chung HY,Su HT,Tseng HP,Tzou WS,Hu CH.Regulation of zebrafish CYP3A65 transcription by AHR2[J].Toxicol Appl Pharmacol,2013,270(2):174-184.
[18] Lin JH.CYP induction-mediated drug interactions: in vitro assessment and clinical implications[J]. Pharm Res,2006,23(6):1089-1116.
[19] Korashy HM,El-Kadi AO.The role of redox-sensitive transcription factors NF-kappaB and AP-1 in the modulation of the Cyp1a1 gene by mercury,lead,and copper[J].Free Radic Biol Med,2008,44(5):795-806.
[20] Korashy HM,El-Kadi AO.Regulatory mechanisms modulating the expression of cytochrome P450 1A1 gene by heavy metals[J].Toxicol Sci,2005,88(1):39-51.
[21] He Z,Mu W,Zhou QQ,Yang X,Zhang C,Hu QQ,et al.Toxic effects of HgCl2on SOD and AChE ofactivities and gene transcription of zebrafish[J].Asian J Ecotoxicol(生態毒理學報),2011,6(6):649-654.
[22] Xiao K,Jing J,Wu N,Yang XF,Ma XF.Effect of single and combined copper,cadmium on CYP3A gene expression in liver tissue of Tanichthys albonubes[J].Hubei Agr Sci(湖北農業科學),2013,52(10):2439-2442.
[23] Liu H.Study on developmental toxicology of dioxinlike PCB126 in zebrafish(類二噁英多氯聯苯PCB126對斑馬魚胚胎的發育毒性機理)[D]. Guangdong:Guangdong Ocean University(廣東海洋大學),2012.
[24] Billiard SM,Hahn ME,Franks DG,Peterson RE,Bols NC,Hodson PV.Binding of polycyclic aromatic hydrocarbons(PAHs)to teleost aryl hydrocarbon receptors(AHRs)[J].Comp Biochem Physiol B Biochem Mol Biol,2002,133(1):55-68.
Generation of cytochrome P-450 CYP3A65 IabeIed fIuorescence transgenic zebrafish and its bioIogicaI response to environmentaI poIIutants
LI Chun-jie1,2,ZHAO Jian2,ZHANG Shi-yong3,PAN Wei-tong2,PU Yun-zhu2,JIA Qi-yan2,ZHA Xiao-dan2,SHANG Yan-nan2,HUANG Chun-qian2,LIU Yan-qin2,ZHONG Yu-xu2,LI Qian2,DING Ri-gao2,FU Ai-ling1,ZHAO Bao-quan2
(1.School of Pharmaceutical Science,Southwest University,Chongqing 400715,China;2.State Key Laboratory of Toxicology and Medical Counter,Institute of Pharmacology and Toxicology,Academy of Military Medical Sciences,Beijing 100850,China;3.Department of Osteology,the First People′s Hospital of Kerchin District,Tongliao 028000,China)
OBJECTIVE To establish Tg(-6.3CYP3A65∶EGFP)transgenic zebrafish for quick,intuitive detection of heavy metals(copper,cadmium and zinc),dioxin-like PCBs(PCB126)and other environmental pollutants.METHODS Tol2 transposon system was used to generate transgenic zebrafish lines Tg(-6.3CYP3A65∶EGFP)in which CYP3A65 promoter regualated labeled fluorescence. The effect of heavy mentals(copper,cadmium and zinc)and PCB126 on the relative amounts of CYP3A65 gene expression was determined by observing the change in fluorescence intensity.RESULTS The relative gene expression of CYP3A65 was significantly increased after 96 h exposure to copper 0.1 and 0.2 μmol·L-1,cadmium 0.35 and 0.7 μmol·L-1,zinc 1.5 and 3 μmol·L-1,and PCB126 2-32 μmol·L-1,respectively(P<0.01),but decreased after 96 h exposure to copper 0.9 μmol·L-1,cadmium 2.7 and 5.4 μmol·L-1,and zinc 24 μmol·L-1,respectively(P<0.01).CYP3A65 gene expression was significantly increased after 168 h exposure to copper 0.1 and 0.2 μmol·L-1,cadmium 0.35 and 0.7 μmol·L-1,zinc 1.5 and 3 μmol·L-1,and PCB126 2-32 μmol·L-1,respectively(P<0.01),but decreased after 168 h exposure to copper 0.9 μmol·L-1,cadmium 2.7 and 5.4 μmol·L-1,and zinc 12 and 24 μmol·L-1(P<0.05),in a concentration-dependent manner.CONCLUSION The results suggest that zebrafish CYP3A65 gene expression and the CYP3A65 labeled fluorescence lines can be another candidate biomarker for detecting environmental pollutants.
cytochrome P-450 CYP3A65;zebrafish,transgenic;copper;cadmium;zinc;polychlorinated biphenyls
ZHAO Bao-quan,E-mail:baoquan9838@sina.com,Tel:(010)66874609
R965
:A
:1000-3002(2014)06-0870-08
10.3867/j.issn.1000-3002.2014.06.009
Foundation item:The project supported by Major Projects of the PLA Medical Science and Technology″Twelfth Five-Year plan″(BWS11R021);and National Science and Technology Major Project of China(2013ZX09402103)
2014-02-28 接受日期:2014-09-30)
(本文編輯:喬 虹)
全軍醫學科技“十二五”科研項目重點課題(BWS11R021);國家科技重大專項(2013ZX09402103)
李春杰,男,碩士研究生,主要從事分子毒理學研究,E-mail:jeyclee@126.com;趙寶全,男,博士,副研究員,主要從事生化與分子藥理學研究。
趙寶全,E-mail:baoquan9838@sina.com,Tel:(010)66874609

