枯草芽孢桿菌K-6-9發(fā)酵條件優(yōu)化及放大
,, , ,
(上海海洋大學(xué)上海水產(chǎn)品加工及貯藏工程技術(shù)研究中心,上海 201306)
微生態(tài)添加劑以其天然、綠色、無毒副作用、無殘留的優(yōu)點近年內(nèi)引起世界各國的關(guān)注,并逐步成為替代抗生素添加劑的主力[1]。甘露寡糖以低熱、安全、無毒,而且能改善動物體內(nèi)微生物環(huán)境、提高動物免疫力等特有的功效引起人們極大的興趣。在健康養(yǎng)殖的趨勢下,甘露寡糖替代抗生素的使用已成為研究熱點,是最有研究前景的抗生素替代品之一[2-3]。甘露聚糖酶(mannanase)是一種半纖維素水解酶,是制備甘露寡糖的關(guān)鍵酶之一,其以內(nèi)切方式降解甘露聚糖糖苷鍵,降解產(chǎn)物的非還原末端為甘露糖、甘露寡糖。甘露聚糖酶來源廣泛,而微生物是甘露聚糖酶的主要來源,其中利用分泌甘露聚糖酶微生物菌種制備直投式發(fā)酵劑,可以大大降低工廠制備甘露寡糖的過程,并具有降低環(huán)境污染等優(yōu)勢。
現(xiàn)在市面上主要是以魔芋作為甘露聚糖的主要來源,而目前市場上為數(shù)不多的寡糖類產(chǎn)品寡糖純度只在35%~55%,而且因含單糖和淀粉類物質(zhì)而難于保存[4]。我國是啤酒酵母生產(chǎn)大國,廢棄的啤酒酵母細(xì)胞壁中同樣含有豐富的甘露聚糖,甘露聚糖占酵母細(xì)胞壁干重的40%左右[5],甘露聚糖存在于酵母細(xì)胞壁外層[6],以共價鍵形式與蛋白質(zhì)連在一起,因此又稱之為甘露聚糖蛋白[7]。因此利用啤酒酵母中甘露聚糖,制備高純度的甘露寡糖,已經(jīng)成為近幾年的研究熱點。
本實驗室前期分離改良的枯草芽孢桿菌K-6-9在生長過程中能產(chǎn)生大量的異甘露聚糖酶酶活力高達(dá)601.6U/mL[21],能將啤酒酵母細(xì)胞壁中的甘露聚糖分解成甘露寡糖。本實驗以芽孢量為指標(biāo),將枯草芽孢桿菌(Bacillussubtilis)K-6-9首先進(jìn)行搖瓶發(fā)酵,通過培養(yǎng)基及其發(fā)酵條件的優(yōu)化研究,然后進(jìn)行擴大培養(yǎng),為該菌株后期制成直投式發(fā)酵劑提供技術(shù)支撐。
1 材料與方法
1.1 材料與儀器
枯草芽孢桿菌(Bacillussubtilis)K-6-9由本實驗室分離保藏;種子培養(yǎng)基和基礎(chǔ)發(fā)酵培養(yǎng)基 葡萄糖5g/L、牛肉膏5g/L、蛋白胨10g/L、NaCl 5g/L、pH7.0[8];菌種、芽孢計數(shù)和保藏培養(yǎng)基 葡萄糖5g/L、牛肉膏5g/L、蛋白胨10g/L、NaCl 5g/L、瓊脂2g/L、pH7.0。
PL-202-L型電子天平 梅特勒-托多利儀器(上海)有限公司;WFZ UV-200型紫外可見分光光度計 尤尼科(上海)儀器有限公司;DHG-9053A型電熱鼓風(fēng)干燥箱 上海一恒科學(xué)儀器有限公司;SJH-4S型數(shù)控精密恒溫水浴鍋 寧波天恒儀器廠;pH S-3C酸度計 雷磁儀器廠;DKY-Ⅱ型 恒溫調(diào)速回轉(zhuǎn)式搖床 上海杜科自動化設(shè)備有限公司;FMG(I)型臺式發(fā)酵罐 上海國強生化工程裝備有限公司。
1.2 實驗方法
1.2.1 活菌數(shù)和芽孢數(shù)的測定 活菌數(shù):將發(fā)酵液稀釋至10-3~10-7,然后取10μL涂布于固體培養(yǎng)基平板上,每個濃度3個重復(fù),18h后計算活菌數(shù)。芽孢數(shù):將發(fā)酵液置于80℃水浴10min按照活菌的測定方法進(jìn)行測定[9-11]。
1.2.2 發(fā)酵液pH的測定 取發(fā)酵液直接用精密pH計測定。
1.2.3 菌種活化及種子液的配制 從冰箱中取出枯草芽孢桿菌斜面菌種,室溫靜置40min;用接種環(huán)從斜面取厚實二環(huán)菌種接種于三角瓶液體培養(yǎng)基上,37℃、160r/min搖床活化培養(yǎng)18h,此時活菌數(shù)約為108CFU/mL,芽孢量約為105CFU/mL作為種子菌液備用[12]。
1.2.4 培養(yǎng)時間的確定 50mL/250mL(以下同)的三角瓶液體培養(yǎng)基中接入2.0%枯草芽孢桿菌K-6-9原菌液,置于37℃,160r/min搖床活化培養(yǎng)24h,其間每隔3h取樣測定菌液活菌數(shù)和芽孢量確定最佳培養(yǎng)時間。
1.2.5 枯草芽孢桿菌K-6-9培養(yǎng)基成分的優(yōu)化 最佳碳源篩選:分別以含量為1%(W/V)的蔗糖、乳糖、麥芽糖、乳糖、棉籽糖、果葡糖漿等6種碳源去替換初始發(fā)酵培養(yǎng)基中的葡萄糖,其他成分變,以葡萄糖為對照。按2%的接種量接種種子液,于160r/min、37℃條件下?lián)u瓶培養(yǎng)18h,每個處理做個3重復(fù),通過芽孢產(chǎn)量進(jìn)行對比選擇(以下同)。
最佳氮源篩選:分別以含量為1%(W/V)的牛肉膏、酵母粉、胰蛋白胨、尿素、NH4NO3、NH4Cl、等6種氮源去替換初始發(fā)酵培養(yǎng)基中的魚粉蛋白胨,以魚粉蛋白胨對照。其它發(fā)酵條件同上,通過芽孢產(chǎn)量進(jìn)行對比選擇。
最佳無機鹽篩選:根據(jù)先相關(guān)文獻(xiàn)[13-16],分別以含量為 0.3%(W/V)的MnSO4、MgSO4、KH2PO4、NaCl,CaCl2等5種無機鹽去替換初始發(fā)酵培養(yǎng)基0.5%(W/V)NaCl,以0.5%(W/V)NaCl和不添加為對照。其它發(fā)酵條件同上,通過芽孢產(chǎn)量進(jìn)行對比選擇。
1.2.6 正交實驗優(yōu)化培養(yǎng)基成分 對篩選得到的最佳碳源蔗糖(A)和最佳氮源胰蛋白胨(B)以及發(fā)酵培養(yǎng)基中促生長無機鹽CaCl2(C),MgSO4(D),KH2PO4(E),進(jìn)行5因素4水平的正交實驗,考慮到碳源與氮源之間的互作,采用 L16(45)正交表確定各組分的最佳配比,共16個處理組合,每個處理做4個重復(fù)。正交實驗各因素及水平見表1。
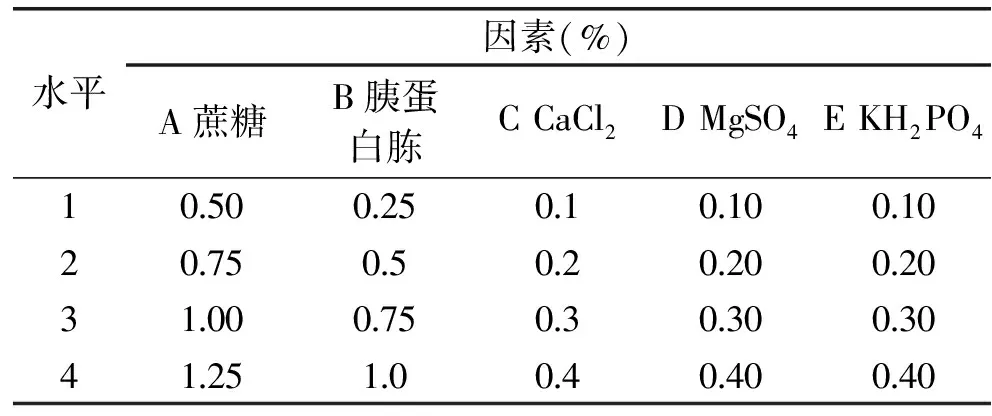
表1 正交實驗因素水平Table 1 Factors and levels in orthogonal experiment
1.2.7 草芽孢桿菌K-6-9培養(yǎng)條件的優(yōu)化
1.2.7.1 最適接種量的測定 按照1%、2%、3%、4%、5%、6%的接種量將種子液分別接到50mL/250mL優(yōu)化后的發(fā)酵液中(以下同),培養(yǎng)18h,通過芽孢產(chǎn)量進(jìn)行對比選擇。
1.2.7.2 最適生長pH的測定 發(fā)酵培養(yǎng)基初始pH設(shè)置為5.5、6.0、6.5、7.0、7.2、7.5、8.0,按照最佳接種量接入優(yōu)化后發(fā)酵液中,在37℃培養(yǎng)18h,通過芽孢產(chǎn)量進(jìn)行對比選擇。
1.2.7.3 最適生長溫度的測定 溫度設(shè)置為28、32、35、37、39、42℃,按照最佳接種量接入優(yōu)化后發(fā)酵液中,在不同溫度下培養(yǎng)18h,通過芽孢產(chǎn)量進(jìn)行對比選擇。
1.2.7.4 最適轉(zhuǎn)速的測定 將枯草芽孢桿菌以合適接種量接到優(yōu)化后發(fā)酵培養(yǎng)基中,搖床轉(zhuǎn)速分別調(diào)節(jié)為 120,140、160、180、200、220r/min;按照最佳接種量接入優(yōu)化后發(fā)酵液中,在最適生長溫度下培養(yǎng)18h,通過芽孢產(chǎn)量進(jìn)行對比選擇。
1.2.8 擴大培養(yǎng) 采用5L發(fā)酵罐,接種量和發(fā)酵量均和搖瓶發(fā)酵條件相同,通氣量維持在3vvm[17]。發(fā)酵條件:優(yōu)化后的最優(yōu)發(fā)酵條件相同。每2h測定細(xì)菌數(shù)和芽孢量。
1.3 數(shù)據(jù)處理方法
實驗中圖表繪制采用 Microsoft Excel處理;正交實驗設(shè)計與方差分析應(yīng)用軟件為正交設(shè)計助手v3.1[18]。
2 結(jié)果與分析
2.1 培養(yǎng)時間的確定
從圖1可以看出:隨著培養(yǎng)時間的延長,在0~3h內(nèi)活菌數(shù)生長較慢,處于停滯期;而后迅速生長,3~18h細(xì)菌數(shù)內(nèi)生長很快,到 18h活菌數(shù)接近頂峰,即這一階段是對數(shù)生長期,菌體數(shù)量急劇增多,活菌數(shù)迅速提高;18h以后活菌數(shù)有微降趨勢,但變化不大,即K-6-9已進(jìn)入生長的穩(wěn)定期。芽孢量在前9h變化不大,幾乎沒有增長,9~18h增長迅速,18~24h芽孢產(chǎn)量趨于穩(wěn)定即進(jìn)入平臺期。故本實驗選擇的最適合的發(fā)酵時間是18h。因此,實驗采用接種種齡為18h,此時枯草芽孢桿菌進(jìn)入對數(shù)生長末期,既可保持高的細(xì)胞活力,又可獲得盡可能多的芽孢量。
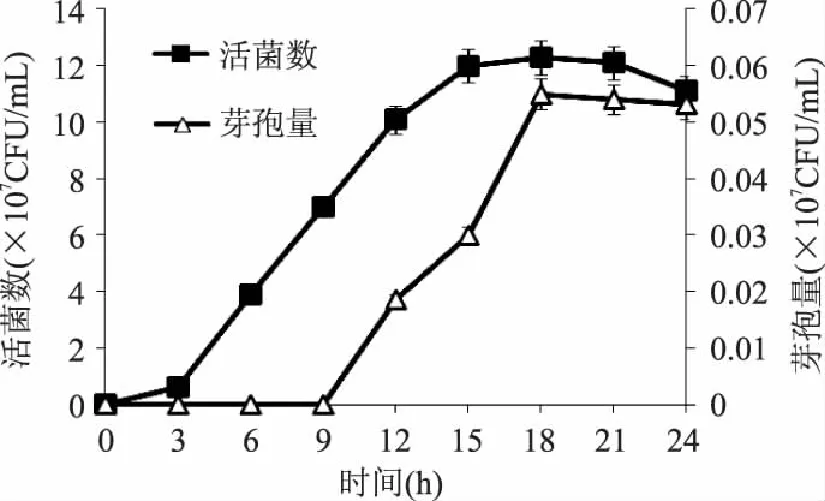
圖1 枯草芽孢桿菌K-6-9生長曲線 Fig.1 Growth curve of Bacillus subtilis
2.2 枯草芽孢桿菌K-6-9培養(yǎng)基成分的優(yōu)化
2.2.1 碳源的篩選 碳源的單因素篩選結(jié)果如圖2所示,當(dāng)蔗糖作為碳源時,發(fā)酵后菌量最大,芽孢量達(dá)到1.50×106CFU/mL,其后芽孢量的大小依次為果糖>乳糖>棉籽糖>葡萄糖>麥芽糖>果葡糖漿。所以根據(jù)芽孢量數(shù)據(jù),蔗糖應(yīng)為最佳碳源。
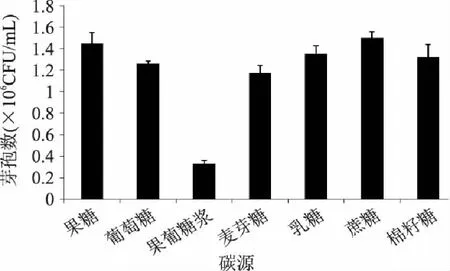
圖2 不同碳源對 K-6-9發(fā)酵液的影響 Fig.2 Effects of different carbon source on the fermentation of K-6-9
2.2.2 氮源的篩選 對氮源進(jìn)行單因素篩選,當(dāng)胰蛋白胨作為氮源時,發(fā)酵后芽孢量最大,芽孢量達(dá)到1.94×106CFU/mL,其余根據(jù)芽孢量的大小依次為魚粉蛋白胨>牛肉膏>酵母粉>NH4NO3>NH4Cl>尿素(圖3)。根據(jù)芽孢量,胰蛋白胨應(yīng)為最佳氮源。
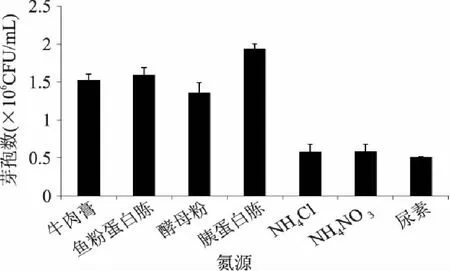
圖3 不同氮源對K-6-9發(fā)酵液的影響 Fig.3 Effects of different nitrogen sources on the fermentation of K-6-9
2.2.3 無機鹽的篩選 對枯草芽孢桿菌K-6-9進(jìn)行無機鹽單因素篩選,當(dāng)KH2PO4作為無機鹽添加時,發(fā)酵后芽孢量最大,達(dá)到5.16×107CFU/mL,其余芽孢量大小依次為MgSO4>CaCl2>0.5%(W/V)NaCl>NaCl>不添加無機鹽>MnSO4(圖4)。

圖4 不同無機鹽對K-6-9發(fā)酵液的影響 Fig.4 Effects of different inorganic salts on the fermentation of K-6-9
綜合上述數(shù)據(jù)可以看出,KH2PO4和MgSO4、CaCl2在促進(jìn)K-6-9發(fā)酵時,對芽孢量的生長有促進(jìn)作用,NaCl對于芽孢量影響較小,后文不再考慮。根據(jù)芽孢量,CaCl2相比較KH2PO4和MgSO4影響較小,故選取KH2PO4和MgSO4作為無機鹽。
2.3 正交實驗優(yōu)化比培養(yǎng)基成分
通過上述碳源、氮源以及無機鹽單因素實驗的研究,確定了液體發(fā)酵培養(yǎng)基的最佳碳源、氮源和無機鹽的種類和濃度范圍。按1.2.6設(shè)計的正交實驗優(yōu)化培養(yǎng)基成分,確定最合適的培養(yǎng)基成分。
從表2可以看出,對枯草芽孢桿菌K-6-9生長影響因素的順序為胰蛋白胨>蔗糖>KH2PO4>MgSO4>CaCl2。實驗結(jié)果表明胰蛋白胨、蔗糖、MgSO4、KH2PO4對發(fā)酵效果影響較為顯著。實驗數(shù)據(jù)分析枯草芽孢桿菌K-6-9的最佳工藝組合為A3B1C1D2E3,即最佳培養(yǎng)基成分為蔗糖1.0%、胰蛋白胨0.25%、MgSO40.2%、KH2PO40.3%、CaCl20.1%、牛肉膏0.5%,芽孢產(chǎn)量為1.294×109CFU/mL。
由表3方差分析可以看出,胰蛋白胨、蔗糖、MgSO4、KH2PO4用量對芽孢產(chǎn)量的影響顯著,CaCl2影響不顯著,此結(jié)果與正交實驗結(jié)果的極差分析結(jié)論一致。
2.4 最佳培養(yǎng)條件的篩選
2.4.1 最佳接種量的確定 測定了1%、2%、3%、4%、5%、6%,6個接種量對芽孢量的影響。實驗結(jié)果表明接種量在一定范圍內(nèi)增大芽孢量有所增加,但過量的接種量可能導(dǎo)致培養(yǎng)基養(yǎng)分提前消耗完,降低芽孢的數(shù)量[19]。實驗結(jié)果表明2%的接種量為最適接種量。
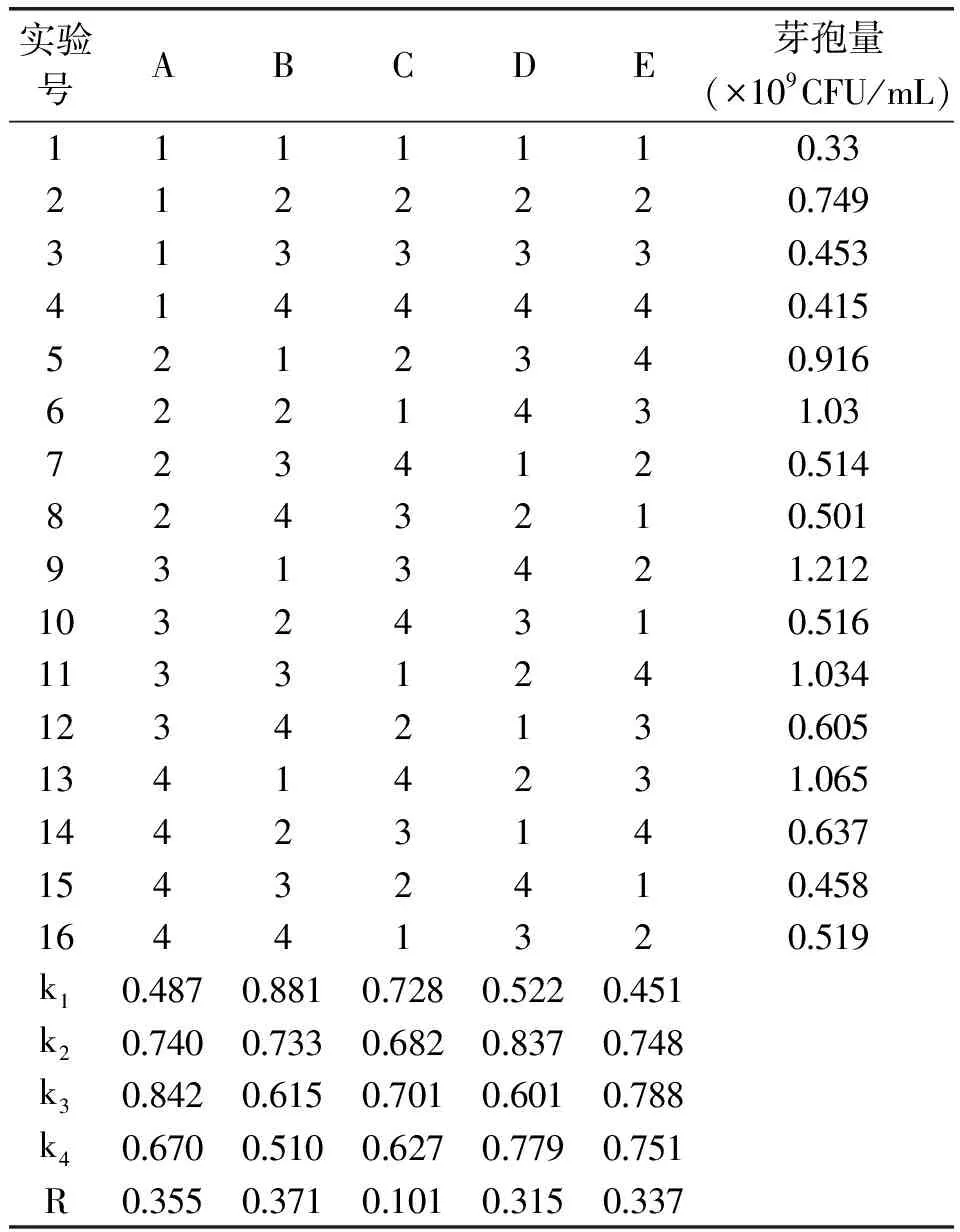
表2 枯草芽孢桿菌K-6-9 最適培養(yǎng)基成分L16(45)正交實驗結(jié)果Table 2 L16(45)orthogonal design and results for liquid medium optimization
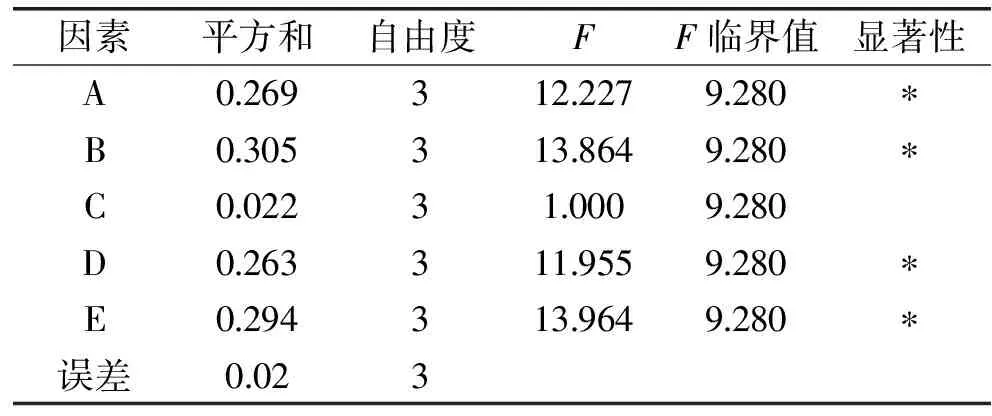
表3 正交結(jié)果方差分析Table 3 Variance analysis of the results

圖5 接種量對芽孢產(chǎn)量的影響 Fig.5 Effect of seed volume on spore yield
2.4.2 最佳初始pH的確定 測定了5.5、6.0、6.5、7.0、7.2、7.5、8.0,7個pH對芽孢量的影響。發(fā)酵培養(yǎng)基初始pH為 5.5~7.0時,與芽孢量增殖呈正相關(guān):7.0~8.0 時呈負(fù)相關(guān)(圖7)。當(dāng)pH為7.0時最適于芽孢量增殖。
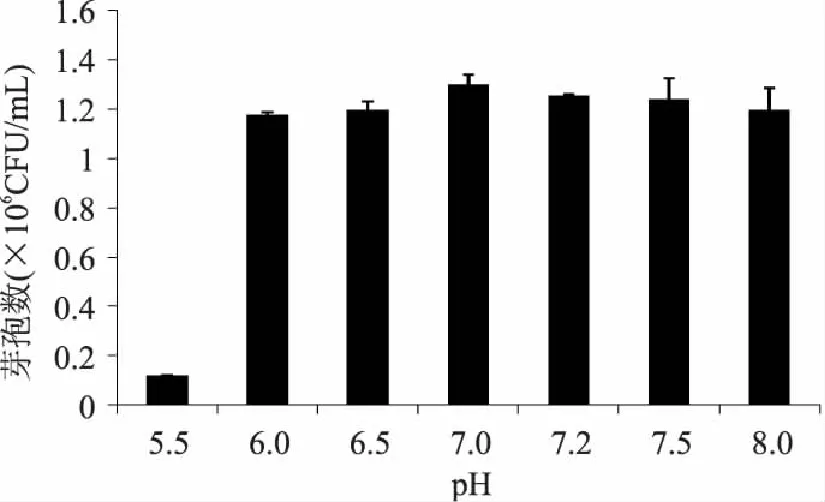
圖6 初始 pH 對芽孢產(chǎn)量的影響 Fig.6 Effect of initial pH value of media on spore yield
2.4.3 最佳發(fā)酵溫度的確定 分別在不同溫度下進(jìn)行發(fā)酵培養(yǎng),結(jié)果表明發(fā)酵溫度為37℃最有利于芽孢量的增殖,綜上所述選擇37℃為本實驗最佳發(fā)酵溫度。
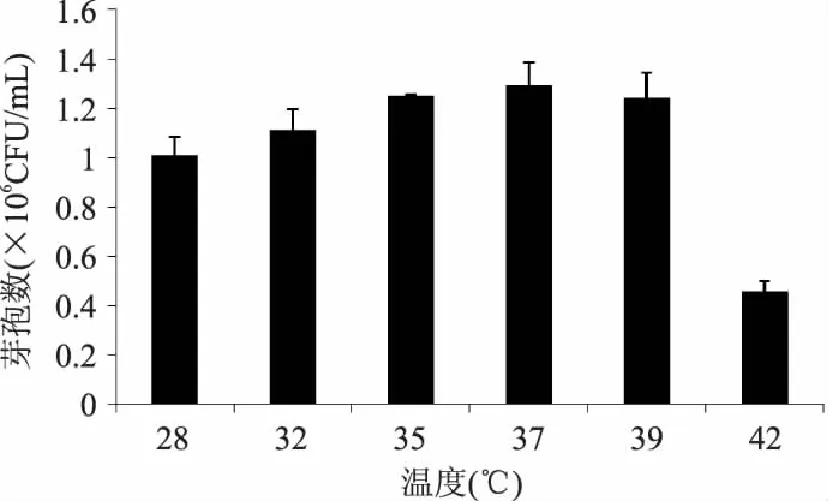
圖7 發(fā)酵溫度對芽孢產(chǎn)量的影響 Fig.7 Effect of temperature on spore yield
2.4.4 最佳轉(zhuǎn)速的確定 在所設(shè)的6個不同處理中,當(dāng)搖床轉(zhuǎn)速為180r/min時,菌體產(chǎn)量明顯高于其他處理(圖9)。因此選擇180r/min作為本實驗的最佳轉(zhuǎn)速。

圖8 轉(zhuǎn)速對芽孢產(chǎn)量的影響 Fig.8 Effect of shaking speed on spore yield
2.5 擴大培養(yǎng)驗證實驗
在搖瓶的基礎(chǔ)上進(jìn)行了5L的擴大培養(yǎng),實驗結(jié)果如圖9。
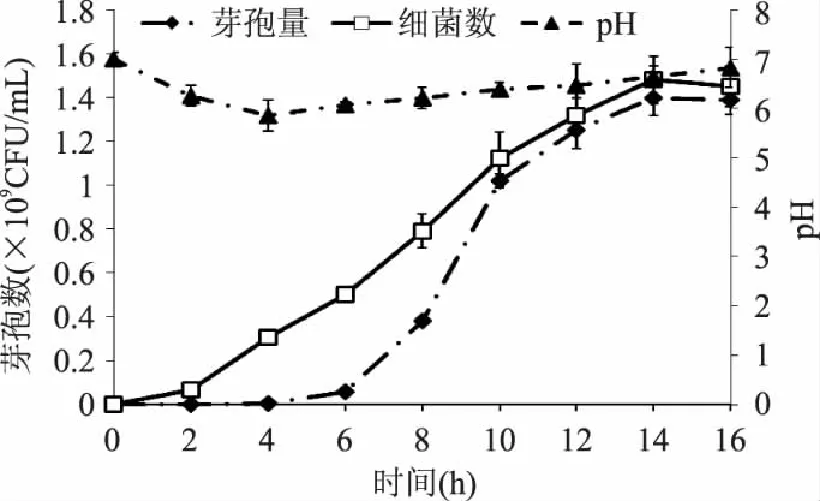
圖9 枯草芽孢桿菌K-6-9擴大培養(yǎng) 在不同時間段活菌數(shù)、芽孢量和pH的變化 Fig.9 Amplification of Bacillus subtilis K-6-9 effect of fermentation time on living cell、spore yield and pH
通圖9可以看出,枯草芽孢桿菌擴大培養(yǎng)生長周期和搖瓶的時間周期有變化,可能由于通氣后加速了枯草芽孢桿菌K-6-9的生長,其在14h獲得了最大細(xì)菌數(shù)和芽孢量。發(fā)酵液的pH先由7.00 降低到5.83,后來逐漸上升到6.71。改良后發(fā)酵液的芽孢量為1.40×109CFU/mL相對于初始發(fā)酵培養(yǎng)基的芽孢量5.5×105CFU/mL,提高了2.55×103倍。
綜合上述實驗,得到優(yōu)化后的發(fā)酵培養(yǎng)基配方為:蔗糖1.0%,胰蛋白胨0.25%,牛肉膏0.5%,MgSO40.2%,KH2PO40.3%,CaCl20.1%。確定了搖瓶的最佳培養(yǎng)條件:初始 pH 7.0,裝液量為 50mL/250mL,接種量為 2%,發(fā)酵溫度為 37℃,轉(zhuǎn)速為180r/min,發(fā)酵時間為 18h。搖瓶發(fā)酵芽孢量為1.32×109CFU/mL,發(fā)酵罐通氣量為3vvm,芽孢量為1.40×109CFU/mL。
3 討論
異甘露聚糖酶生產(chǎn)菌株K-6-9在批量生產(chǎn)制備成直投式發(fā)酵劑過程中最為重要的是以芽孢量為主要質(zhì)量指標(biāo)。因此,本研究以芽孢量作為該菌株發(fā)酵條件的評判指標(biāo)。目前異甘露聚糖酶生產(chǎn)菌株發(fā)酵劑的應(yīng)用國內(nèi)外未見多報道,多為酶活力和制備甘露寡糖的研究。如王永[20]對于產(chǎn)異甘露聚糖酶菌株的復(fù)合誘變,張聞[6]等甘露聚糖酶產(chǎn)生菌F1-5的鑒定及發(fā)酵條件研究。王紹云[21]等采用由北京博仕奧生物技術(shù)有限公司提供,酶活≥ 20萬 U/g的內(nèi)切型中性β-甘露聚糖酶對棕櫚粕進(jìn)行酶解,得到以聚合度二、三、四、五為主的MOS等,對于發(fā)酵劑的研究較少。本實驗室分離的菌株K-6-9產(chǎn)異甘露聚糖酶的酶活性較強,固態(tài)培養(yǎng)基酶活力最高達(dá)601.6U/mL[23]。本實驗首次初步探討了異甘露聚糖酶K-6-9的高密度發(fā)酵,為后期制備直投式發(fā)酵劑提供了實驗基礎(chǔ)。
相對于其它枯草芽孢桿菌等高密度發(fā)酵,本實驗的芽孢量相對較少。這可能由于菌株的特殊性。 搖瓶發(fā)酵實驗表明K-6-9生長需要較好的溶氧條件,在其他發(fā)酵條件一定的情況下,培養(yǎng)基中的溶氧水平越高越有利于芽孢的產(chǎn)生。在后期的實驗中,將進(jìn)行補料實驗以便進(jìn)一步優(yōu)化和提高芽孢量。
[1]徐鵬,董曉芳,佟建明,等. 微生物飼料添加劑的主要功能及其研究進(jìn)展[J]. 動物營養(yǎng)學(xué)報,2012,24(8):1397-1403.
[2]Naanishindo Y,Nakayama K,Tanaka A,etal. Structure of the N-linked oligosaccharides that show the complete loss of alpha-1,6-polymannose outer chain of Saccharomyces cerevisiae[J]. J Biological Chemistry,1993,268:26338-26345.
[3]Ponton J,Omaetxebarria MJ,Elguezabal N,etal. Immunoreactivity of the fungal cell wall[J]. Medical Mycology,2001,39:101-110.
[4]周映華,張石蕊. 甘露寡糖對肉雞生產(chǎn)性能和腸道微生物以及免疫機能的影響[J].湖南農(nóng)業(yè)大學(xué)學(xué)報,2003,29(3):250-253.
[5]Lipke PN,Ocalle R. Cell wall architecture in yeast new structure and new challenges[J]. J Bacterial,1998,180(15):3735-3740.
[6]張聞,汪立平,汪之和,等.甘露糖產(chǎn)生菌F1-5的鑒定及發(fā)酵條件的研究[J].食品科學(xué),2009,37(4):1469-1470,1478.
[7]楊鴻坤,陳權(quán)軍,羅永發(fā),等. β-甘露聚糖特性抗?fàn)I養(yǎng)作用及應(yīng)用[J].飼料添加劑,2007(12):18-20.
[8]盧耀俊,周世水,朱明軍. 1株水產(chǎn)用益生枯草芽孢桿菌液體發(fā)酵初步研究[J].齊魯漁業(yè). 2008,35(1):20-22.
[9]方中達(dá). 植病研究方法[M]. 第3版. 北京:中國農(nóng)業(yè)出版社,1999:189-192.
[10]Hoben HJ,Somasegaran P. Comparison of the pour,spread,and drop plate methods for enumeration of Rhizobium spp. in inoculants made from Presterilized peat[J]. Applied and Environmental Microbiology,1982,44(5):1246-1247.
[11]金樁,彭健,胡新文. 枯草芽孢桿菌-MBS的培養(yǎng)條件優(yōu)化研究[J]. 黑龍江畜牧獸醫(yī),2010(03):111-113.
[12]張文芝,王云鵬,劉紅霞. 蠟質(zhì)芽孢桿菌AR156發(fā)酵培養(yǎng)基及發(fā)酵條件的優(yōu)化[J]. 微生物學(xué)通報,2010,37(06):803-810.
[13]陳志誼,陸凡,劉春祥. 冰稻紋枯病拮抗細(xì)菌B-916培養(yǎng)條件與發(fā)酵配方的研究[J]. 西南農(nóng)業(yè)學(xué)報1998,12(1):76-81.
[14]崔京春,吳俊罡,劉吉華,等. 枯草芽孢桿菌發(fā)酵過程的優(yōu)化[J]. 發(fā)酵工程,2004,25(7):52-55.
[15]張根偉. 枯草芽孢桿菌 BS-6液體發(fā)酵條件的研究[J]. 河北省科學(xué)院學(xué)報,2005,22(1):54-57.
[16]黃國勇,吳振強. 枯草芽孢桿菌產(chǎn)木聚糖酶發(fā)酵條件的研究[J].河南工業(yè)大學(xué)學(xué)報:自然科學(xué)版,2006,27(1):32-35.
[17]Fang-Chen Wu,Shou-Zu Chou,Ing-Lung Shih. Factors affecting the production and molecular weight of levan of Bacillus subtilis natto in batch and fed-batch culture in fermenter[J]. Journal of the Taiwan Institute of Chemical Engineers,2013,03:1-9.
[18]王金玲,張洪超. 膠質(zhì)芽孢桿菌液體發(fā)酵產(chǎn)孢條件的優(yōu)化[J]. 食品工業(yè)科技,2013,05(34):151-159.
[19]張麗霞,李榮禧,土琦. 枯草芽孢桿菌發(fā)酵培養(yǎng)基的優(yōu)化[J]. 中國生物防治,2006,25(增刊):82-83.
[20]王 永,田春華,竹磊. 產(chǎn)異甘露聚糖酶菌株的復(fù)合誘變[J]. 江西農(nóng)業(yè)學(xué)報,2011,23(6):113-115.
[21]王紹云,石波,李靜梅. 酶解棕櫚粕制備甘露寡糖及其組分的結(jié)構(gòu)確定[J]. 食品工業(yè)科技,2009,30(10):84-86.
[22]穆昭艷,汪立平,張大兵,等. 異甘露聚糖酶生產(chǎn)菌的誘變育種及固態(tài)發(fā)酵條件的優(yōu)化[J]. 食品科學(xué),2012,33(5):220-225.

