大鼠孤束核內谷氨酸受體亞型對心臟傷害性感受信息的調控作用
劉曉華,韓 曼,杜劍青
(1.陜西中醫學院生理學教研室,陜西 咸陽 712046;2.西安交通大學醫學院生理學與病理生理學系,陜西 西安 710061)
位于延髓的孤束核(nucleus tractus solitarius,NTS)在心血管、呼吸以及胃腸道的初級感覺信息的整合和傳遞中扮演重要的角色[1]。心臟傷害性感受信息主要由伴隨心交感神經和心迷走神經的傳入纖維傳遞,經不同的傳入通路上傳到中樞引起相應的反應[2]。解剖學研究[3-4]表明:NTS既是心迷走神經傳入的中樞投射部位,同時也是心交感神經的中轉部位。NTS在傷害性信息的傳遞中扮演不同的角色,既有抑制作用也有易化作用,但NTS對心臟傷害性感覺信息的作用到目前為止尚不清楚。谷氨酸是NTS內主要的興奮性神經遞質,谷氨酸受體分為2大類:一類為離子型受體,包括N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid,NMDA)型、α-氨基-3-羥基-5-甲基-4-惡唑-丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole propionic acid,AMPA)型和海人藻酸(kainic acid,KA)型,后2種也統稱為非NMDA受體,其與離子通道偶聯,形成受體-通道復合物,介導快信號或快突觸傳遞;另一類為促代謝型谷氨酸受體(metabotropic glutamate receptors,mGluRs),其與膜內的G-蛋白偶聯,被激活后通過G-蛋白效應器酶、胞內第二信使等組成的信號轉導系統起作用,產生包括慢突觸傳遞等較緩慢的生理反應。NMDA受體和mGluRs參與痛覺過敏[5-6],但NTS內谷氨酸及其受體亞型在心臟傷害感受中的作用尚不清楚。辣椒素是傷害性感受神經元的選擇性激活物質,可以選擇性地作用于有傷害性感受作用的C和Aδ神經纖維末梢[7]。研究[8-9]表明:心臟表面給予辣椒素可以激活伴隨迷走和交感神經的傳入纖維,心包內注射辣椒素可以誘發心臟-軀體運動反射(cardiosomatic motor reflex,CMR),背斜方肌肌電(electromyogram,EMG)活動明顯增強。本研究利用心包內注射辣椒素誘發的CMR為心臟傷害性感受指標,于NTS內分別微量注射谷氨酸及各受體亞型拮抗劑觀察其對CMR的影響,確定NTS內參與心臟傷害性感受的谷氨酸受體亞型,旨在為NTS內參與心臟傷害性感受信息調控的神經遞質和受體提供新的證據。
1 材料與方法
1.1 主要試劑和儀器 辣椒素溶于吐溫80和無水乙醇(按1∶1比例混合)溶液中,配制成1×10g·mL-1的貯存液,實驗時用生理鹽水稀釋到所需濃度1mg·L-1。鵝膏蕈氨酸(ibotenic acid,IBO)、谷氨酸、NMDA受體拮抗劑[(+)-MK-801 hydrogen maleate,MK-801]、非NMDA受體拮抗劑6,7-二硝基喹喔啉-2,3二酮(6,7-dinitroquinoxaline-2,3-dione,DNQX)均用生理鹽水溶解。mGluRs拮抗劑α-甲基,4-羧基苯丙氨酸[(RS)-a-methyl-4-carboxyphenylglycine,MCPG]先用NaOH(1mol·L-1)溶解后,再用生理鹽水稀釋,所有藥物最終的pH值調整為7.2~7.6,所用藥物均購自美國Sigma公司。BL-420生物信號采集與分析系統(成都泰盟生物科技有限公司),壓力換能器(成都泰盟生物科技有限公司),蠕動泵(BT100-2J,保定蘭格恒流泵有限責任公司),小動物呼吸機(DW3000-B型,淮北正華生物儀器設備有限公司),大鼠腦立體定位儀(日本Narishige公司),Olympus生物顯微鏡(BX51,日本Olympus公司),0.5μL微量注射器(Hamilton,Reno,Nevada,USA)。
1.2 實驗動物、動物分組及處理方法 健康雄性SD大鼠60只,體質量260~330g,將其隨機分為IBO組、谷氨酸組、MK-801組、MCPG組、MCPG聯合MK-801組和DNQX組;各組大鼠孤束核內分別微量注射130mmol·L-1IBO 100nL,10.0、20.0、50.0mmol·L-1谷氨酸100nL,NMDA受體拮抗劑40和60mmol·L-1MK-801100nL,代謝型谷氨酸受體拮抗劑25和50mmol·L-1MCPG 100nL,25mmol·L-1MCPG 50nL聯合40mmol·L-1MK-80150nL,非NMDA受體拮抗劑20和50mmol·L-1DNQX 100nL。
1.3 大鼠心包插管術和NTS內微量注射手術 大鼠稱質量后以初始劑量的戊巴比妥鈉(45~55mg·kg-1)靜脈滴注麻醉。取俯臥位,暴露左側背斜方肌,以記錄背斜方肌EMG。再取仰臥位,行氣管插管術,右側頸動脈插管監測動脈血壓,左側頸靜脈插管以便在整個實驗過程中維持戊巴比妥鈉的麻醉(10~15mg·kg-1·h-1)。以動脈血壓和瞳孔直徑監測實驗動物麻醉深度。①心包插管術:左側上胸部第1到第3肋軟骨處行開胸術,暴露胸腺。中線處分離胸腺,暴露心包膜。玻璃分針尖端(直徑0.5mm)在心包膜上扎開1個小孔,將一長12~14cm遠端有數個小洞的硅膠管(內徑0.020mm、外徑0.037mm)經此孔插入心包約2cm,縫合胸腺和各層胸壁組織,以固定心包插管。②NTS內微量注射:將大鼠固定于腦立體定位儀上,剪開枕骨處頭皮,鈍性分離附著于枕骨處的肌肉,暴露枕骨。微型電鉆鉆透枕骨后,用咬骨鉗剝離部分顱骨,在閂部水平去除硬腦膜和軟腦膜。實驗中藥物注射位點以寫翮(第4腦室尾側最后點)為零坐標(相當于前囟后14.3mm水平),左側旁開0.5~0.8mm,吻側0~0.5mm,腦表面下0.5~0.8mm。微量注射使用尖端與玻璃微電極相連的0.5μL微量注射器,微電極尖端直徑為50~100μm。NTS內微量注射量為0.1μL,速度為0.1μL·s-1。根據以往研究以及預實驗選擇藥物的劑量。
1.4 CMR記錄過程 同芯電極以30°的角度插入左側背斜方肌,記錄其EMG信號,根據肌肉大小調節電極插入深度,插入深度一般為1.5~1.7mm。手術完畢2~3h,待動物狀態穩定后記錄EMG基線活動60s,NTS內微量注射生理鹽水100nL,15min后心包腔內注射辣椒素(0.655nmol/0.2mL)1min后回抽并沖洗心包4~6次,同時記錄EMG 60~65s。50min后NTS內注射谷氨酸或者谷氨酸受體不同的拮抗劑100nL,15min后心包腔內注射辣椒素1min后回抽并沖洗心包,同時記錄EMG 60~65s,觀察藥物對EMG活動的影響。間隔1h后心包腔內注射辣椒素0.2mL,觀察EMG恢復情況。EMG以反應中的放電單位總數計算,以NTS內注射生理鹽水后的EMG反應為對照,將其定義為100%。計算注射藥物后的EMG與生理鹽水比較的百分比。EMG以反應中的放電單位總數計算,以NTS內注射生理鹽水后的EMG反應為對照,將其定義為100%;計算注射藥物后EMG變化的百分比。實驗結束后,NTS微量注射位點原位微注射2%膀胺天藍100nL,以標記藥物注射位點及擴散范圍。10min后靜脈內注入過量戊巴比妥鈉(100mg·kg-1)深麻大鼠,經左心室插管至升主動脈,先用50mL生理鹽水快速灌注沖洗血液,再用約200mL 10%甲醛溶液灌流固定。灌流結束后取腦組織,放置于10%的甲醛固定液中室溫固定4h,再轉移到20%的蔗糖溶液中4℃沉糖48h。待組織沉糖完全后進行冰凍切片,片厚30μm,行尼氏染色,顯微鏡下根據大鼠腦圖譜進一步確定注射位點(圖1)。
1.5 統計學分析 采用SPSS 10.0統計軟件對數據進行分析處理。EMG變化的百分比以表示,多組間樣本均數比較采用單因素重復測量方差分析。
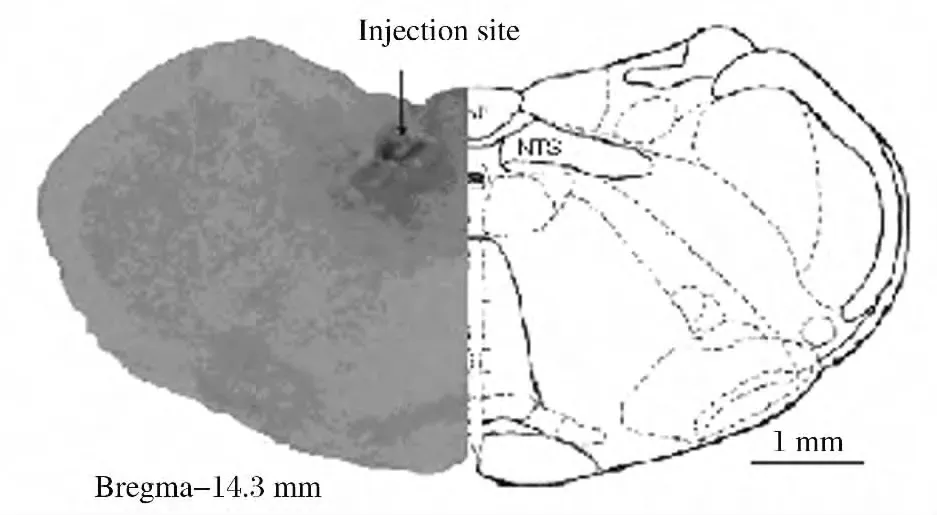
圖1 NTS內微量注射位點圖Fig.1 Microinjection sites in NTS
2 結 果
2.1 NTS內微量注射IBO后CMR的變化 NTS聯合部微量注射130mmol·L-1IBO 100nL,1和2h后EMG放電總數分別為(56.4±6.9)%和(40.5±5.4)%,與對照組比較明顯下降(P<0.01)。見圖2。

圖2 NTS內注射IBO后CMR的肌電圖Fig.2 EMG activities of CMR after intra-NTS injection of IBO
2.2 NTS內微量注射谷氨酸后CMR的變化NTS內分別微量注射100、200和500mmol·L-1谷氨酸后,EMG活動分別為(116.9±4.9)%、(143.9±10.2)%和(214.2±15.8)%,與生理鹽水對照組比較CMR均增加(P<0.05)。見圖3。
2.3 NTS內微量注射谷氨酸受體亞型拮抗劑后CMR的變化 NTS內微量注射40和60mmol·L-1MK-801100nL后,EMG活動分別為(45.2±10.6)%和(36.8±14.3)%,與生理鹽水對照組比較明顯下降(P<0.05)。NTS內微量注射25和50mmol·L-1MCPG后,EMG活動分別為(65.2±16.3)%和(57.0±4.2)%,與生理鹽水對照組比較明顯下降(P<0.05)。NTS內聯合微量注射25mmol·L-1MCPG和80mmol·L-1MK-801后,EMG活動為(22.5±13.2)%,與單獨注射MCPG或者MK-801后比較EMG活動明顯下降(P<0.05)。NTS內微量注射20和50mmol·L-1DNQX后,EMG反應為(99.6±18.6)%和(104±12.4)%,與生理鹽水對照組比較差異無統計學意義(P>0.05)。見圖3。
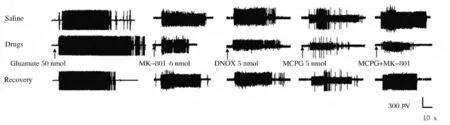
圖3 NTS內注射谷氨酸和谷氨酸受體拮抗劑后CMR的肌電圖Fig.3 EMG activities of CMR after intra-NTS injection of glutamate and glutamate receptor antagonists
3 討 論
以往研究[2,10]表明:心臟感覺傳入神經纖維至少通過2條通路上傳到中樞神經系統,即伴隨心交感神經的傳入纖維和伴隨心迷走神經的傳入纖維。大部分迷走傳入神經纖維直接投射到位于延髓的NTS。束路追蹤研究[3]表明:心臟交感傳入神經纖維通過星狀神經節和交感神經鏈投射到上胸段脊髓背角,而來自脊髓頸部和胸部背角的投射纖維中樞部同樣也會終止于NTS[4]。Albutaihi等[11]研究表明:心包內注射化學致痛劑可以誘發c-Fos在NTS內的表達。這些結果提示NTS是心臟傷害性感覺信息傳遞的重要驛站。在本實驗中NTS聯合部微量注射選擇性的神經元胞體損毀劑IBO,抑制了心包腔內注射辣椒素誘發的EMG反應;NTS聯合部內微量注射興奮性神經遞質谷氨酸以選擇性地激活神經元胞體,結果顯示谷氨酸對心包內注射辣椒素誘發的CMR有明顯的易化作用,且呈劑量依賴性的增加關系。這2項結果提示:NTS在心臟傷害性感覺信息的中樞調控過程中起易化作用,且這種易化作用是以谷氨酸作為其興奮性神經遞質的。該結果與以往的研究結果一致,解剖學以及電生理學實驗研究[12-13]證明:谷氨酸是NTS內重要的興奮性神經遞質,激活NTS內神經元可以對傷害性感受產生易化調控作用。由于NTS同時是心臟傷害性感受的初級傳入中樞,對于這種易化作用的產生有2種可能:一種是谷氨酸激活了NTS參與的傷害性信息的內源性下行易化調控通路;另外可能是因谷氨酸是心臟傷害性感受初級傳入纖維在NTS內的神經遞質,注射谷氨酸增加了初級傳入信息從而產生易化效應。對于這2種可能性還需進一步的研究證實。
免疫細胞研究以及分子生物學研究證實:NMDA受體、非NMDA受體以及代謝型谷氨酸受體亞型在NTS內均有表達[14-15]。不同的谷氨酸受體亞型在傷害性感受的作用有所不同。研究[5-6]表明:NTS內的NMDA受體介導胃內注射鹽酸誘發的胃痛覺感受;mGluRs對炎癥誘發的脊髓超興奮的產生是必須的,并且mGluR參與痛覺過敏的行為學反應的形成。但是,NTS內谷氨酸各受體亞型在心臟傷害性感覺信息的調控中的作用尚未見報道。
為了進一步明確不同的谷氨酸受體亞型在心臟傷害性感受中的作用,本研究觀察不同受體亞型拮抗劑對心包內注射辣椒素誘發的CMR的影響,結果顯示:微量注射NMDA受體拮抗劑MK-801對CMR有明顯的抑制作用,提示NTS內的NMDA受體參與心臟傷害性感受的易化調控作用。該結果與以往研究[5]結果一致。以往研究[5]已經明確表明:腦干NMDA受體在痛覺的下行易化調節通路中有重要的作用。NMDA受體拮抗劑AP-V直接注射到延髓頭端腹內側部(RVM)阻止了結腸炎癥和芥子油誘發的內臟痛覺過敏。但是,本研究中非NMDA受體拮抗劑DNQX對CMR無明顯的影響,說明NTS內非NMDA受體未參與NTS對心臟傷害性信息的易化調控作用。mGluRs是與G蛋白偶聯的受體家族。研究[6]顯示:脊髓mGluRs對炎癥誘發的脊髓超興奮的產生有重要的意義;同時mGluRs的激活參與痛覺過敏的行為學反應的產生[16],提示mGluRs在痛覺的下行易化調節中有重要的作用。本研究中NTS內微量注射mGluRs拮抗劑MCPG使心包腔內注射辣椒素誘發的肌肉痛覺過敏降低,提示NTS內的mGluR參與心臟傷害性感受的易化調控。但是,不同的mGluRs亞型在心臟傷害性感受調控中的作用還需進一步的研究證實。
[1]Grill HJ,Hayes MR.The nucleus tractus solitarius:a portal for visceral afferent signal processing,energy status assessment and integration of their combined effects on food intake[J].Int J Obes(Lond),2009,33(Suppl 1):S11-15.
[2]Rosen SD.From heart to brain:the genesis and processing of cardiac pain[J].Can J Cardiol,2012,28(2Suppl):S7-19.
[3]Wang WZ,Gao L,Pan YX,et al.Differential effects of cardiac sympathetic afferent stimulation on neurons in the nucleus tractus solitarius[J].Neurosci Lett,2006,409(2):146-150.
[4]Meng Z,Lu G.Projection linkage from spinal neurons to both lateral cervical nucleus and solitary tract nucleus in the cat[J].Biol Signals Recept,2000,9(1):38-44.
[5]Swanson CJ,Bures M,Johnson MP,et al.Metabotropic glutamate receptors as novel targets for anxiety and stress disorders[J].Nat Rev Drug Discov,2005,4(2):131-144.
[6]Neugebauer V.Metabotropic glutamate receptors-important modulators of nociception and pain behavior[J].Pain,2002,98(1/2):1-8.
[7]Robbins N,Koch SE,Rubinstein J.Targeting TRPV1and TRPV2for potential therapeutic interventions in cardiovascular disease[J].Transl Res,2013,161(6):469-476.
[8]Schultz HD,Ustinova EE.Capsaicin receptors mediate free radical-induced activation of cardiac afferent endings[J].Cardiovasc Res,1998,38(2):348-355.
[9]Liu XH,Qin C,Du JQ,et al.Diabetic rats show reduced cardiac-somatic reflex evoked by intrapericardial capsaicin[J].Eur J Pharmacol,2011,651(1-3):83-88.
[10]Corbett EK,Sinfield JK,Mc William PN,et al.Differential expression of vesicular glutamate transporters by vagal afferent terminals in rat nucleus of the solitary tract:Projections from the heart preferentially express vesicular glutamate transporter 1[J].Neuroscience,2005,135(1):133-145.
[11]Albutaihi IA,DeJongste MJ,Ter Horst GJ.An integrated study of heart pain and behavior in freely moving rats(using Fos as a marker for neuronal activation)[J].Neurosignals,2004,13(5):207-226.
[12]Berthoud HR,Heuhuber WL.Functional and chemical anatomy of the afferent vagal system[J].Auton Neurosci,2000,85(1-3):1-17.
[13]Chianca DA Jr,Lin LH,Dragon DN,et al.NMDA receptors in nucleus tractus solitarii are linked to soluble guanylate cyclase[J].Am J Physiol Heart Circ Physiol,2004,286(4):H1521-1527.
[14]Hoang CJ,Hay M.Expression of metabotropic glutamate receptors in nodose ganglia and the nucleus of the solitary tract[J].Am J Physiol Heart Circ Physiol,2001,281(1):H457-462.
[15]Saha S,Spary EJ,Maqbool A,et al.Increased expression of AMPA receptor subunits in the nucleus of the solitary tract in the spontaneously hypertensive rat.[J].Brain Res Mol Brain Res,2004,121(1):37-49.
[16]Wei G,Shiping Z,Yun G,et al.Tyrosine phosphorylation of the NR2B subunit of the NMDA receptor in the spinal cord during the development and maintenance of inflammatory hyperalgesia[J].J Neurosci,2002,22(14):6208-6217.

