rhKD/APPvar畢赤酵母分泌表達質粒的構建及其重組蛋白的表達和純化
王心童,王虹蛟,王 強,孟威宏,顏煒群,任立群
(1.吉林大學中日聯誼醫院神經內科,吉林 長春 130033;2.解放軍第461醫院內科,吉林 長春 130021;3.沈陽軍區總醫院心血管內科,遼寧 沈陽 110015;4.吉林大學再生醫學科學研究所再生醫學系,吉林 長春 130021)
牛胰蛋白酶抑制劑(bovine pancreatic trypsin inhibitor,BPTI)是Kunitz家族的絲氨酸蛋白酶抑制劑,已用于急、慢性肝損傷的研究[1-6]。但BPTI是1種從牛肺中提純的堿性蛋白酶抑制劑,為異體蛋白,具有抗原性,長期反復應用能夠產生特異性抗體,引起機體免疫反應。KD/APP是人Kunitz型蛋白酶抑制劑(Kunitz protease inhibitor,KPI),具有抑制絲氨酸蛋白酶的活性,是較為理想的BPTI替代品。雖然KD/APP與BPTI在結構、生物活性等方面有很多相似之處,但由于KD/APP活性中心的氨基酸殘基是Arg15-Ala16-Met17(RAM),BPTI是Lys15-Ala16-Arg17(KAR),兩者在酶的專一性、親和常數和抑制酶譜等方面存在較大的差異。本研究利用KD/APP為基本骨架,用BPTI活性中心氨基酸殘基KAR替代KD/APP活性中心的RAM,構建新的重組KD/APP變異體(rhKD/APPvar),并構建rhKD/APPvar真核表達質粒,實現其在畢赤酵母中的分泌表達,建立大規模發酵、純化rhKD/APPvar的工藝,為篩選具有與BPTI在生物活性(抑制酶譜)和藥效學類似的新的抑制劑提供物質基礎。目前國內外尚未見相關報道。
1 材料與方法
1.1 菌株和主要試劑 表達質粒pPICZα和酵母菌株X-33購自美國Invitrogen公司;感受態菌XL1-Blue購自北京鼎國生物公司;LA Taq酶、T質粒、限制性內切酶和T4DNA連接酶購自日本Takara公司;感受態菌XL1-Blue和DNA快速純化/回收試劑盒購自北京鼎國生物公司;質粒提取試劑盒購自美國Promega公司;SP Sepharose XL陽離子交換樹脂購自瑞典Pharmacia公司;rhKD/APP-pPICZα重組質粒由吉林大學再生醫學科學研究所提供。
1.2 構建rhKD/APPvar-pPICZα表達質粒 利用已構建好的rhKD/APP-pPICZα表達質粒,在KD/APP活性中心兩側設計2個酶切位點(ApaⅠ和SacⅡ),將KD/APP的活性中心RAM替換成BPTI的活性中心KAR。①在KD/APP活性中心5′端引入ApaⅠ位點:根據在KD/APP序列,設計引物擴增5′端引入ApaⅠ限制性內切酶位點。上游引物:5′-GGTCTGCAGTGAACAAGC-CGAGACTGGGCCCTG-3′(下劃線部分為酶切位點);下游引物:5′-GAAGTCTAGATTAAATGGCGCTGCCACACA-3′。以KD/APP-pPICZα重組質粒為模板,行PCR反應,PCR反應程序:94℃變性4min;94℃變性30s,55℃退火30s,72℃延伸1min,共30個循環;72℃再延伸5min。回收PCR產物約200bp片段,經PstⅠ和XbalⅠ雙酶切后,連接經PstⅠ和XbalⅠ雙酶切的pPICZ質粒。②在KD/APP活性中心3′端引入SacⅡ位點:上游引物,5′-ATGGGGCCCTG-TAGAGCAATGATCCCGCGGTGG-3′(下劃線部分為酶切位點);下游引物,5′-GAAGTCTAGATTAAATGGCGCTGCCACACA-3′。以①中獲得的重組質粒為模板,PCR反應程序:94℃變性4min;94℃變性30s,55℃退火30s,72℃延伸1min,30個循環;72℃再延伸5min。回收PCR產物200bp片段,經PstⅠ和XbalⅠ雙酶切后,連接同樣經PstⅠ和XbalⅠ雙酶切的pPICZ質粒,構建重組質粒Kas。用SacⅠ和SacⅡ雙酶切鑒定,經酶切鑒定正確的重組質粒Kas經ApaⅠ和SacⅡ雙酶切,去除KD/APP活性中心的RAM。③活性中心的替換:合成編碼BPTI活性中心KAR的短鏈DNA,序列為5′-CTGTAAAGCTAGAATCTCGC-3′和5′-GAGATTCTAGCTTTACAGGGCC-3′。引物退火后獲得的黏性末端與ApaⅠ和SacⅡ雙酶切后的黏性末端連接。利用此特性將重組質粒Kas中的活性中心RAM與BPTI活性中心KAR的DNA進行替換,獲得rhKD/APPvar-pPICZα重組表達質粒。經酶切鑒定正確的重組質粒轉化大腸桿菌感受態XL1-Blue,大量擴增,并用質粒快速提取試劑盒提取質粒用于酶切鑒定及核酸序列分析。
1.3 rhKD/APPvar-pPICZαz轉化畢氏酵母 將20μg rhKD/APPvar-pPICZα質粒用SacⅠ酶切,酚氯仿抽提,用10μL無菌水溶解。與80μL新鮮制備的X33感受態混勻,加入0.2cm電轉杯,冰浴5min,以Bio-Rad Gene Pulser電轉儀于1500V、25μF、200Ω條件下轉化,同時加入1.0mL山梨醇,將菌液涂布于YPD(含100mg·L-1的Zeocin)的選擇培養板上,30℃培養2~3d,篩選具有Zeocin抗性的生長良好的表達菌株。
1.4 酵母工程菌的誘導表達 取上述鑒定結果陽性的克隆接種于10mL BMGY(pH 6.0)培養基中,30℃震蕩培養24h,至吸光度(A600)值達2.0~6.0收集細胞。等體積(10mL)BMMY(pH 6.0)重懸細胞沉淀,30℃震蕩培養,誘導表達。在誘導過程中,每24h補充一次甲醇至終濃度為0.5%,同時補充滅菌超純水,使發酵液總體積保持不變。在培養0、24、48、72、96和120h等時間點各取0.5mL發酵液,離心取上清用于聚丙烯酰胺凝膠電泳(SDS-PAGE)分析。
1.5 畢赤酵母表達rhKD/APPvar最佳pH值的確定 將生長培養基的菌體等量接入pH值分別為3.0、3.5、4.0、4.5、5.0、5.5和6.0的誘導培養基內進行培養。在培養0、24、48、72、96和120h等時間點各取0.5mL發酵液,離心取上清用于SDS-PAGE分析。
1.6 rhKD/APP的純化 將rhKD/APPvar發酵液離心,取上清,用3倍體積水稀釋并加入1/10體積的200mmol·L-1醋酸鹽緩沖液(pH 4.0),用HCl調節其pH值為3.5。用10倍柱體積20mmol·L-1醋酸鹽緩沖液(pH3.5)平衡SP Sepharose FF陽離子樹脂。加樣品rhKD/APPvar于平衡好的SP Sepharose FF陽離子樹脂柱,用波長280nm監測。待穿透液有目的蛋白出現時,停止加樣,用20mmol·L-1醋酸鹽緩沖液沖洗樹脂至A280值降至基線。用含1mol·L-1NaCl的20mmol·L-1醋酸鹽緩沖液洗脫,并分步收集蛋白峰。用超濾純化裝置濃縮純化后的rhKD/APPvar,并用水倍比稀釋3~5次以除鹽。應用SDS-PAGE分析確定純化后蛋白的純度和濃度,Bradford法精確定量。
2 結 果
2.1 重組質粒Kas的鑒定 利用已構建好的rhKD/APP-pPICZα表達質粒,在KD/APP活性中心兩側通過PCR引入2個酶切位點(ApaⅠ和SacⅡ),連接pPICZ質粒后,小提質粒進行酶切鑒定。用SacⅠ和SacⅡ雙酶切重組質粒結果:重組質粒成功切下1000bp的片段,而對照組質粒未見此片段,證明2個酶切位點(ApaⅠ和SacⅡ)成功引入KD/APP活性中心兩側,且PCR獲得的目的片段成功插入pPICZ質粒,構建了重組質粒Kas。見圖1。
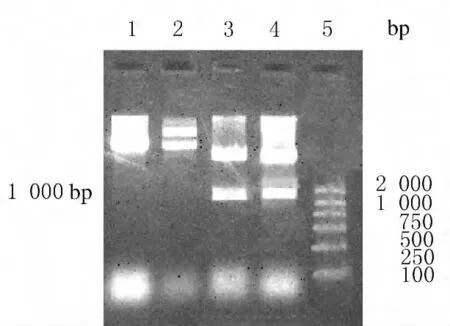
圖1 SacⅠ和SacⅡ雙酶切質粒產物瓊脂糖凝膠電泳圖Fig.1 Agarose gel electrophoregram of plasmid digested by SacⅠ和SacⅡ
2.2 活性中心替換的鑒定 合成編碼BPTI活性中心KAR的短鏈DNA,退火后獲得的黏性末端可與ApaⅠ和SacⅡ雙酶切后的黏性末端連接。利用此特性將重組質粒Kas與BPTI活性中心KAR的DNA序列連接,獲得rhKD/APPvar-pPICZα表達質粒。連接BPTI活性中心KAR后,SacⅡ位點消失,可以作為鑒定依據。經SacⅠ和SacⅡ雙酶切,活性中心替換成功的KD/APPvar-pPICZα重組表達質粒無1000bp片段(圖2)。
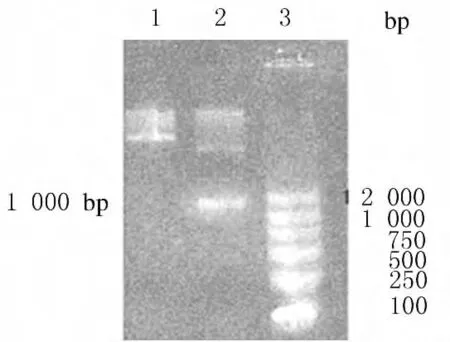
圖2 活性中心替換鑒定的瓊脂糖凝膠電泳圖譜Fig.2 Agarose gel electrophoregram of substitute identification of active site
2.3 rhKD/APPvar-pPICZαz重組質粒測序rhKD/APPvar-pPICZαz重組質粒測序結果顯示DNA序列與預期相符。見圖3。
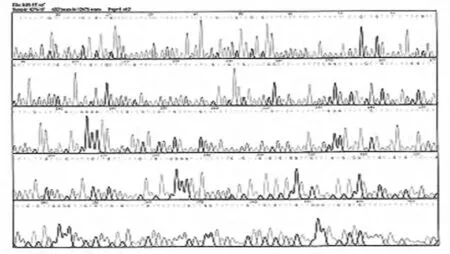
圖3 替換后質粒DNA測序圖譜Fig.3 Sequencing diagram of vector DNA after substituting
2.4 rhKD/APPvar蛋白表達 最適表達時間的優化:SDS-PAGE結果:甲醇誘導表達后在相對分子質量約6700處出現蛋白條帶,誘導表達24h有蛋白分泌,隨著誘導時間的延長其表達水平升高,120h即達到高峰。發酵液上清rhKD/APPvar表達水平可達285mg·L-1。見圖4。畢赤酵母表達rhKD/APPvar的最佳pH值:畢赤酵母在pH 2.5~6.0培養基均能很好地生長,本實驗在pH 6.0時發酵外源蛋白表達水平最高。見圖5。

圖4 rhKD/APPvar經時變化的SDS-PAGE圖譜(考馬斯亮藍染色)Fig.4 SDS-PAGE graph of ongoing changes of rhKD/APPvar(Coomassie blue staining)
2.5 rhKD/APPvar的純化 rhKD/APPvar發酵液離心取上清,經Sepharose SP FF陽離子交換層析,得到1個活性洗脫主峰,除鹽濃縮后rhKD/APPvar在15%SDS-PAGE中顯示1條考馬斯亮藍區帶。純化后純度可達95%以上。見圖6。
3 討 論
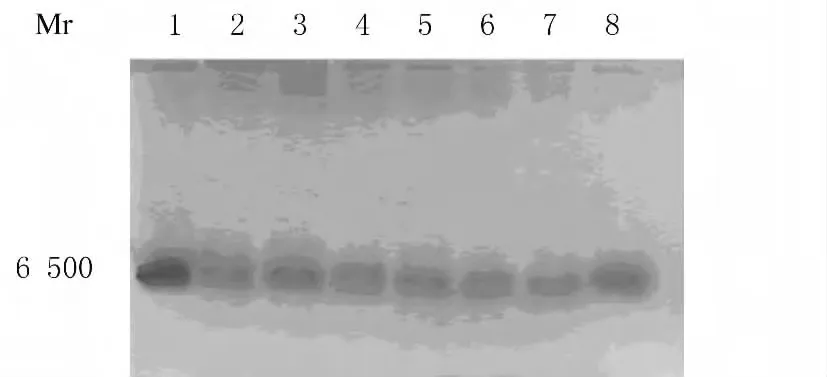
圖5 rhKD/APPvar SDS-PAGE圖譜(考馬斯亮藍染色)Fig.5 SDS-PAGE graph of rhKD/APPvar(Coomassie blue staining)
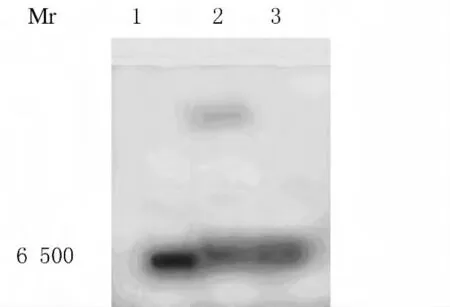
圖6 大規模純化rhHKD/APPvar的SDS-PAGE圖譜(考馬斯亮藍染色)Fig.6 SDS-PAGE graph of rhKD/APPvar with large-scale purification(Coomassie blue staining)
蛋白酶抑制劑在機體中參與凝血、纖溶、細胞遷移、細胞分化、凋亡和炎癥反應等,在臨床上主要應用于細胞凋亡、凝血、骨質疏松和腫瘤等疾病治療[7]。目前絲氨酸蛋白酶抑制劑是研究最多、最為清楚的一類抑制劑,其中Kunitz家族的牛胰蛋白酶抑制劑(BPTI)的結構、功能及藥理學方面的研究比較深入,已廣泛應用于臨床。BPTI是一種廣譜的絲氨酸蛋白酶抑制劑,其相對分子質量為6500,是由58個氨基酸殘基組成的堿性蛋白,分別在Cys14-Cys38、Cys5-Cys55和Cys30-Cys51連接半胱氨酸形成3對二硫鍵。其中1對二硫鍵(Cys14-Cys38)位于分子表面,其使2段肽鏈(32~42,9~21)連接在一起,這1對二硫鍵被還原和重新氧化后不影響抑制劑活力。另外2對二硫鍵(Cys5-Cys55,Cys30-Cys51)位于分子內部,還原后抑制劑失活。Kunitz家族蛋白酶抑制劑分子空間構相高度保守,有許多共同特征,BPTI整個分子呈梨型,由2條反平行的β-折疊、2段α-螺旋、β-轉角和一些環組成,其最主要的結構特征是含有2片180度扭曲的反平行β-折疊,這個折疊分別和β轉角與1對二硫鍵(Cys14-Cys38)相連。這個分子的主要片段1~14和38~58殘基沿著β-折疊來回彎曲折疊,以使末端殘基1和殘基58能夠在β轉角處相互靠近,二硫鍵的共價連接也使這兩端靠攏并和β轉角(30~51殘基組成)靠近。N端的殘基形成了一個短的螺旋段,C端形成了1個更長的、有規律的α螺旋(48~56殘基)。分子的自然折疊和半胱氨酸以獨特的方式共價連接使整個分子變得緊湊、穩定[8]。自Kunitz[9]發現BPTI可以抑制激肽酶和胰蛋白酶以來,許多科研工作者就致力于BPTI的研究。1993年12月美國食品藥品監督管理局(FDA)批準將BPTI應用于臨床心肺胸外科手術中[10],用于減少出血和滲血以及有凝血障礙可能出現大出血情況的患者治療中。目前國產的BPTI制品主要是從牛肺中提取,BPTI作為異源蛋白具有免疫原性,大量使用可出現過敏反應等不良臨床反應。每千克的牛肺組織中僅可提取1mg的BPTI,且提取工藝復雜[11]、產量低、產品的純度不高。
本實驗選用了甲基營養型酵母——畢赤巴斯德酵母(Pichia.pastoris)。畢赤酵母系統的廣泛應用,除該系統具有一般酵母所具有的特點外,還具有以下幾個優點[12-14]:①具有醇氧化酶AOX1基因啟動子,該啟動因子是目前調控機制最嚴格的啟動子之一;②表達質粒能在基因組的特定位點以單拷貝或多拷貝的形式穩定整合;③菌株易于進行高密度發酵,外源蛋白表達量高;④畢赤酵母中存在過氧化物酶體,表達的蛋白貯存其中,可免受蛋白酶的降解,而且減少對細胞的毒害作用。經近十年發展畢赤巴斯德酵母基因表達系統已成為較完善的外源基因表達系統,具有易于高密度發酵、表達基因穩定整合在宿主基因組中、能使產物有效分泌并適當糖基化和培養方便經濟等特點。畢赤巴斯德酵母表達系統在生物工程領域將發揮越來越重要的作用,促進更多外源基因在該系統的高效表達,提供更為廣泛的基因工程產品[15]。
本實驗采用pPICZα質粒構建KD/APPvar的分泌型表達質粒,電轉化畢赤酵母X-33菌種,構建了高效分泌表達rhKD/APPvar的工程菌,并對畢赤酵母大規模表達rhKD/APPvar的發酵條件進行了優化。純化過程中,采用pH 3.5條件下進行陽離子交換層析可很好地避免核酸和內毒素的污染,且得到純度較高的rhKD/APPvar,除鹽濃縮后,可直接用于生物活性的鑒定和藥效學實驗,該純化方法簡單、成本低,適合于大規模純化。
[1]Posadas SJ,Caz V,Caballero I,et al.Effects of mannoprotein E1in liquid diet on inflammatory response and TLR5expression in the gut of rats infected by Salmonella typhimurium[J].BMC Gastroenterol,2010,10(1):58-65.
[2]Greif F,Ben-ari Z,Taya R,et al.Dual effect of erythropoietin on liver protection and regeneration after subtotal hepatectomy in rats[J].Liver Transpl,2010,16(5):631-638.
[3]Ellett JD,Atkinson C,Evans ZP,et al.Murine Kupffer cells are protective in total hepatic ischemia/reperfusion injury with bowel congestion through IL-10[J].J Immunol,2010,184(10):5849-5858.
[4]王虹蛟,王心童,王 強,等.抑肽酶對實驗性慢性肝損傷大鼠肝細胞增殖能力的影響[J].吉林大學學報:醫學版,2011,37(1):18-20.
[5]王 強,王心童,王虹蛟,等.抑肽酶對實驗性急性肝損傷模型小鼠肝組織的保護作用[J].吉林大學學報:醫學版,2010,36(6):1039-1042.
[6]王虹蛟,孟威宏,王 強,等.抑肽酶對實驗性慢性肝損傷的保護作用[J].中國實驗診斷學,2008,12(1):4-7.
[7]Hocman G.Chemoprevention of cancer:protease inhibitor[J].Int J Biochem,1992,24(3):1365-1375.
[8]Haghara Y,Shirali K,Nakamura T,et al.SCreening for stable mutants with amino acid pairs substituted for the disulfide bond between residues 14and 38of bovine pancreatic trypsin inhibitor(BPTI)[J].J Biol Chem,2002,277(52):51043-51048.
[9]Kunitz M.Isolation of crystalline protein compound of trypsin and of soybean tryps ininhibitor[J].J Gen Physiol,1947,30(4):311-320.
[10]Chesshyre JA,Kraunsoe JA,Lowe G.Production of bovine-pancreatic-trypsin-inhibitor homologues in Escherichia coli and their characterization[J].Biotechnol Appl Biochem,1995,22(3):269-280.
[11]張振龍,李 津.發酵工藝放大的優化[J].國外醫學:預防、診斷、治療生物制品分冊,2003,26(2):61-63.
[12]李 晶,趙曉祥,沙長青,等.甲醇酵母基因表達系統的研究進展[J].生物工程進展,1999,19(2):17-20.
[13]Gurramkonda C,Zahid M,Nemani SK,et al.Purification of hepatitis B surface antigen virus-like particles from recombinant Pichia pastoris and in vivo analysis of their immunogenic properties[J].J Chromatogr B Analyt Technol Biomed Life Sci,2013,940(1):104-111.
[14]Schmidt C,Ploier B,Koch B,et al.Analysis of yeast lipid droplet proteome and lipidome[J].MethodsCell Biol,2013,116(1):15-37.
[15]彭 毅,楊希才,康良儀.影響甲醇酵母中外源蛋白表達的因素[J].生物技術通報,2000,30(4):33-36.

