腺苷三磷酸對冠狀動脈平滑肌細胞大電導鈣離子激活鉀通道的作用
王湘蕓,錢玲玲(綜述),王如興,李肖蓉(審校)
(南京醫科大學附屬無錫市人民醫院心內科,江蘇 無錫 214023)
大電導鈣離子激活鉀通道即BK通道,也稱Slo或MaxiK通道,廣泛存在于血管平滑肌細胞膜上,對血管張力調節起重要作用[1]。冠狀動脈粥樣硬化性心臟病、高血壓和糖尿病等許多病理狀態下BK通道功能受損,進而影響血管舒縮功能[2]。研究表明,BK通道受許多化學物質的影響[3-5]。該文就腺苷三磷酸(adenosine triphosphate,ATP)對冠狀動脈平滑肌細胞BK通道的作用予以綜述。
1 BK通道的結構和特點
1981年,Malty[6]在牛嗜鉻細胞上首先發現BK通道,其單通道電導為100~300 pS,且激活受細胞外鈣離子濃度的影響,故稱為大電導鈣離子激活鉀通道。
BK通道由α和β兩種亞基構成,呈四聚體,α亞基包括與細胞膜外N端相連的7個跨膜片段(S0~S6)以及位于細胞膜內與C端相連的4個疏水性片段(S7~S10),其中S1~S4構成電壓敏感區域,S5、S6及P環構成通道結構[7]。S7、S10區域包含兩個與鈣有高親和力的結合區域“鉀電導調節元件結構域”和“鈣碗”,它們分別位于S7和S10結構域,是決定BK通道鈣離子敏感性的關鍵結構(圖1)。
α亞基主要構成BK通道結構,β亞基則對BK通道具有調節作用,β亞基有四種亞型,分別是β1、β2、β3和β4,β亞基包含兩個具有胞外環的跨膜區域TM1和TM2,TM1與細胞內N端相連,靠近α亞基的S1和S2,TM2與細胞內C端相連,靠近α亞基的S0,它們在對α亞基的調節中起非常重要的作用,可提高BK通道的電壓依賴性和鈣敏感性[8]。β亞基中不同亞型在各組織器官的表達水平各不相同,在血管平滑肌細胞中主要是β1亞型,β2和β4亞型表達水平較低,甚至難以測出[2]。
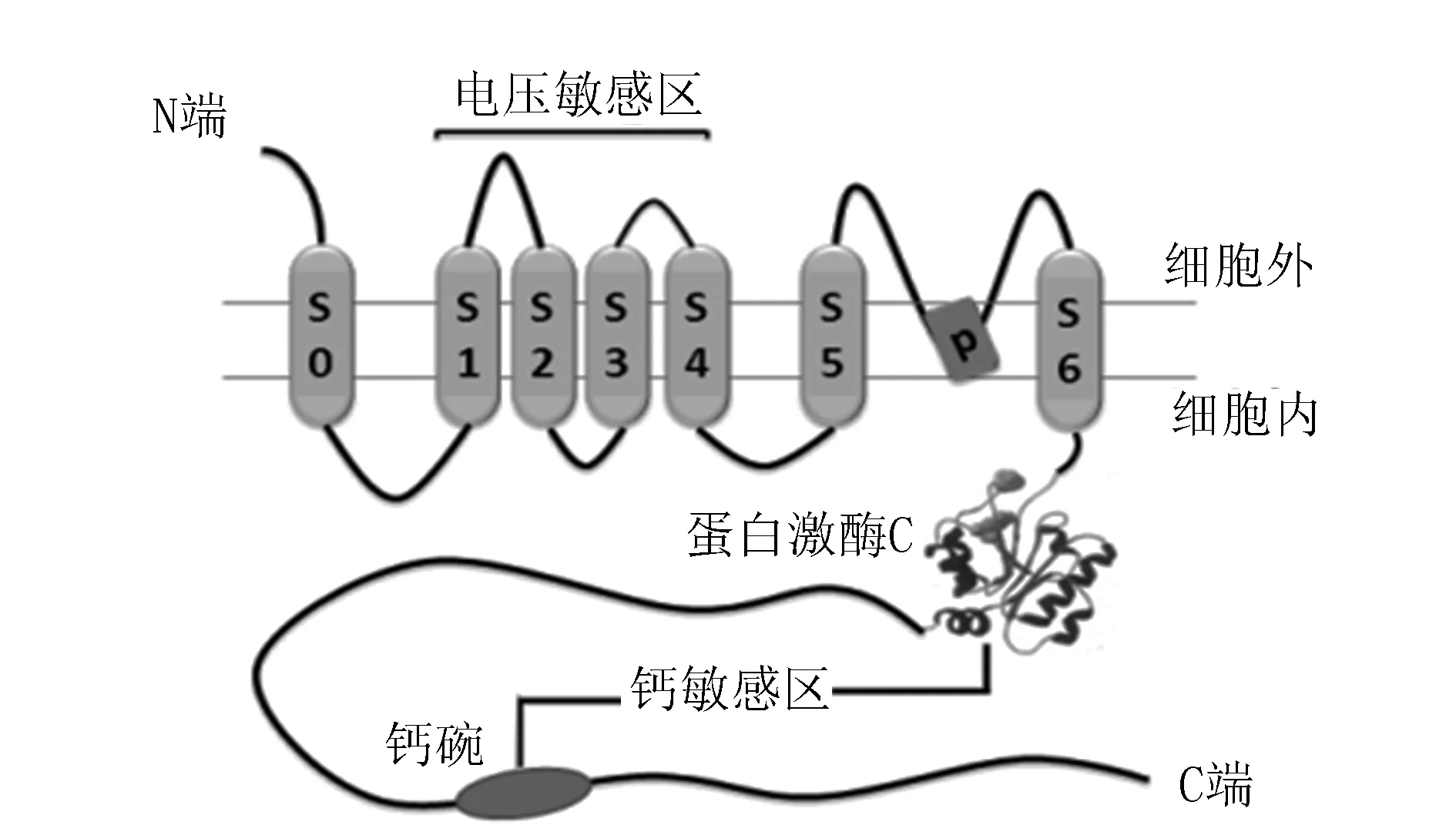
圖1 大電導鈣離子激活鉀通道結構模式圖
BK通道具有電壓依賴性和鈣敏感性的特點,電壓依賴性是指當細胞跨膜電位增加時,BK通道開放概率增加;鈣敏感性是指細胞內鈣離子濃度升高后,BK通道激活增加,細胞內鈣離子濃度增加可由細胞內鈣庫釋放引起,也可通過電壓門控性L-型鈣通道開放,鈣內流所致,激活BK通道所需細胞內鈣濃度至少為10 μmol/L[9]。BK通道開放后鉀離子外流,細胞膜超極化,導致電壓依賴性鈣通道關閉,鈣內流減少,血管舒張。反之,BK通道關閉或開放減少可導致細胞膜去極化,從而使電壓依賴性鈣通道開放,鈣離子內流增加,血管收縮。研究發現,BK通道與多種介導細胞外鈣內流和細胞內鈣庫釋放的離子通道有關,如可通過細胞膜瞬時受體電位C1通道和內質網上ryanodine受體等介導細胞外鈣離子內流和內質網鈣釋放,從而激活平滑肌細胞BK通道[10-11]。因此,細胞內鈣離子濃度的變化可以直接影響BK通道的開放,而研究顯示ATP可通過相應受體調節細胞內鈣離子濃度[12]。
2 ATP及其受體
ATP作為人體最直接的供能物質廣為人知,但是對ATP的認識經歷了一個較長的過程。自1929年發現ATP至今已將近一個世紀,20世紀50年代,Pamela等首次證實感覺神經末梢能釋放ATP[13];70年代,Burnstock等提出“嘌呤神經”的概念[14],自此ATP作為一種神經遞質逐漸為人所知。但ATP的作用機制一直是研究的熱點,20世紀90年代早期,人們發現ATP可使神經元去極化,膜片鉗實驗顯示ATP能激活離子通道,還可以在周圍和中樞神經系統之間介導突觸傳遞[15-16]。進一步研究表明,ATP主要通過嘌呤受體介導發揮作用,并把ATP受體分為兩大家族,促代謝型P2Y受體和離子型P2X受體,這兩種受體廣泛存在于機體的組織和細胞[17]。
2.1P2X受體 P2X受體是一種非選擇性陽離子通道,對鈣離子有較高的通透性,在哺乳動物P2X受體有7種亞型,每種亞型由一個細胞外功能區、細胞內N端和C端及兩個疏水性跨膜結構組成[18]。N端長度較短,由25個氨基酸構成,而C端根據P2X亞型不同,氨基酸為30~215個,并包含蛋白激酶A和蛋白激酶C磷酸化位點,同時也是P2X受體重要的調節區域[19]。細胞外功能區由大約280個氨基酸構成[20]。其中包括由10個保守半胱氨酸殘基組成的一系列二硫鍵,其作用是對離子通道與ATP結合位點的耦合形成結構上的限制[21]。跨膜區域包括TM1和TM2兩部分,兩者共同組成P2X的通道結構[22](圖2),其中TM2的功能尤為突出[13]。
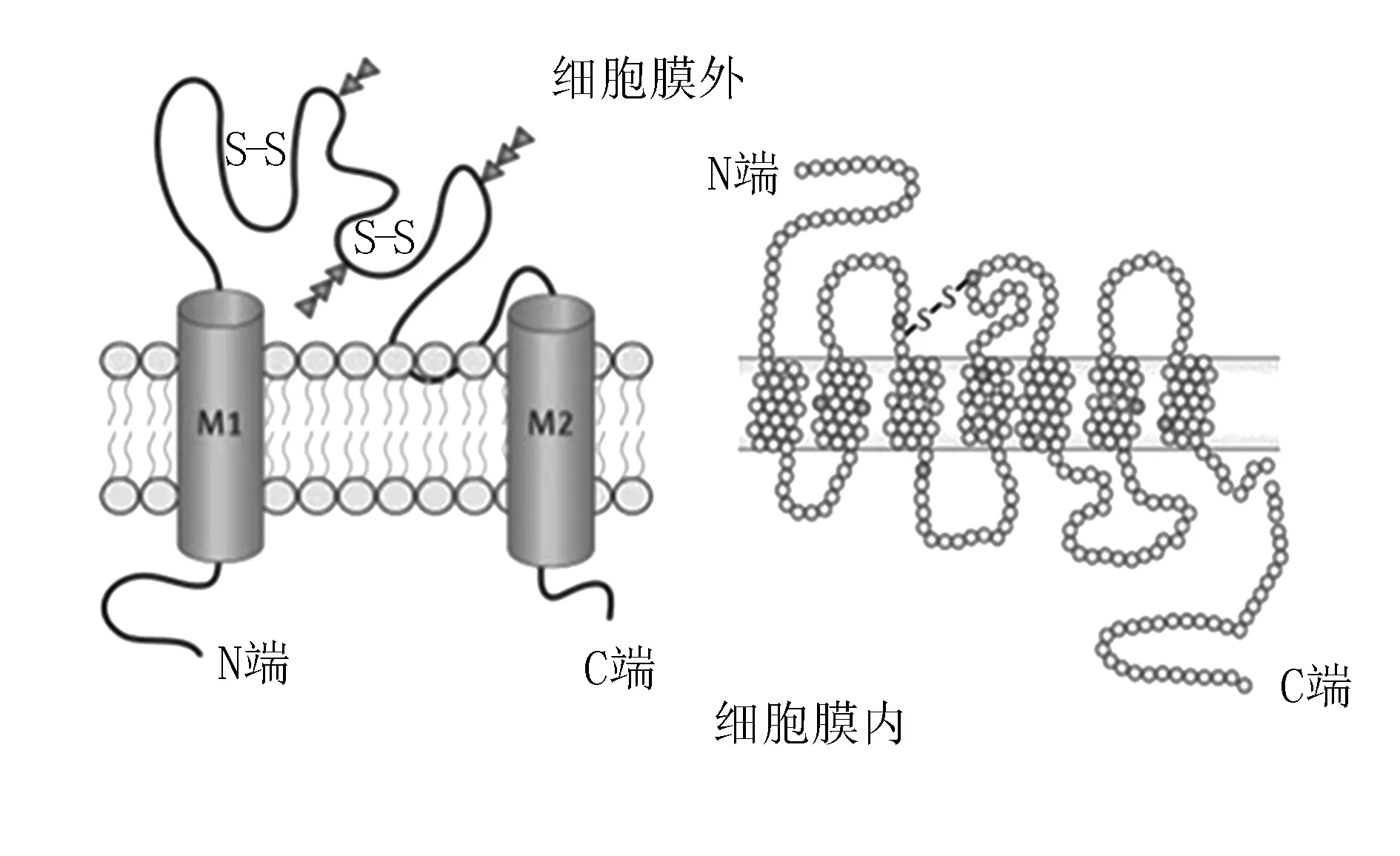
圖2 P2X(左)和P2Y(右)受體結構模式圖
2.2P2Y受體 P2Y受體是一種G蛋白偶聯受體,在哺乳動物已克隆出P2Y(1、2、4、6、11-14)8種亞型。P2Y受體由308~379個氨基酸構成,含有7個跨膜結構域,其中N端在細胞外,C端在細胞內[21]。與P2Y受體結合的G蛋白,以α、β、γ三聚體的形式存在于細胞膜內側,其中α亞基具有與受體結合并受其活化調節及與下游效應分子相互影響的作用。異源三聚體G蛋白是直接接收G蛋白偶聯受體信號的分子,可影響許多下游效應分子和調節細胞功能。P2Y受體的細胞內C端含有一些蛋白激酶結合位點或磷酸化作用位點的共有序列,7個跨膜結構域中TM3、TM6、TM7的一些堿性殘基參與配體的結合和調節,可能是興奮性受體激活的關鍵[19,21]。
與P2X受體相同,P2Y受體的8種亞型也廣泛分布于機體的組織和細胞。在結腸末端平滑肌細胞P2Y1和P2Y6含量較多,神經膠質細胞主要有P2Y4和P2Y6,在腸神經元主要有P2Y2和P2Y12,而在免疫活性細胞中檢測到大量的P2Y4受體[22]。之后人們發現,在主動脈平滑肌細胞和腸系膜動脈平滑肌細胞都有大量的P2Y受體(1、2、4、6)[23]。近年來免疫組織化學研究顯示,P2Y1在冠狀動脈內皮和平滑肌上均有表達[24]。磷酸吡哆醛-6-偶氮苯-2′,4′-二磺酸對P2Y1有很強的拮抗作用,但對其他P2Y受體的作用很小甚至沒有[19,25]。
3 ATP對冠狀動脈平滑肌細胞BK通道的影響及機制
早在1996年,Str?baek等[26]在人類冠狀動脈平滑肌細胞發現ATP可以通過嘌呤受體(P2X和P2Y)刺激細胞內鈣庫釋放鈣,從而使BK通道開放,并通過膜片鉗實驗予以證實。近年來,進一步研究表明,ATP主要通過與P2X受體和P2Y受體結合而發揮作用。
TM1和TM2之間的胞外結構有3個ATP的結合位點,每2~3個ATP可以激活一個P2X受體[18]。ATP與之結合,激活P2X受體,使TM構成的通道結構打開,從而引起鈣離子內流,使細胞內鈣濃度升高,這一機制并不依賴于第二信使的產生和擴散,因此速度較快,通常在10 ms內[21]。當鈣濃度升高超過10 μmol/L時即可激活BK通道[9]。鈣離子在細胞內的積聚還可以導致蛋白激酶C、絲裂原活化蛋白激酶和鈣調蛋白依賴性蛋白激酶Ⅱ等一些細胞內激酶激活,故P2X受體激活可能遠比單純的離子內流復雜[19]。
P2X受體有7種亞型,在機體中廣泛分布。免疫熒光實驗結果顯示,P2X1主要分布于動脈平滑肌層,其表達量依賴動脈血管床的多少,但在冠狀動脈難以檢測;P2X4分布在所有動脈中,尤其是在冠狀動脈和腦動脈中表達量最高;P2X7主要分布在動脈外膜,而P2X(2、3、5和6)在動脈中表達極少[27]。因此,可以推斷在冠狀動脈平滑肌細胞ATP主要通過與P2X4的結合發揮作用。
P2X4受體作為P2X受體的一種亞型,受許多核苷酸類似物的激活,各種類似物對P2X4受體的激活反應如下:ATP>苯甲酰苯甲酸>2-亞甲基硫ATP>胞苷三磷酸>α,β亞甲基ATP,且這種作用效果在人體有類似表現[20]。另一方面,許多物質可抑制P2X4受體,其抑制反應如下:5-(3-溴苯基)-1,3-二氫-2H-苯并呋喃并[3,2-C]-1,4-二氮雜-2-酮>帕羅西汀>三氮ATP>磷酸吡哆醛-6-偶氮苯-2′,4′-二磺酸,其中5-(3-溴苯基)-1,3-二氫-2H-苯并呋喃并[3,2-C]-1,4-二氮雜-2-酮是P2X4受體的特效抑制劑[28-29]。
P2Y受體主要通過第二信使發揮作用,P2Y受體亞型不同,其機制也各有差異。根據G蛋白亞型的不同,發現P2Y(1、2、4、6和11)受體屬于Gq蛋白偶聯亞群,P2Y(12~14)受體屬于Gi蛋白偶聯亞群[19]。前者(P2Y11除外)主要通過Gq與磷脂酶C偶聯,產生肌醇1,4,5-三磷酸(inositol 1,4,5-triphosphate,IP3)發揮作用,后者主要通過Gi與腺苷酸環化酶耦合發揮作用,而P2Y11受體則兩種機制兼有[23]。
P2Y1受體作為Gq亞群中的一員,主要分布在冠狀動脈平滑肌細胞上,通過與磷脂酶C偶聯,產生IP3發揮作用。研究顯示,激活IP3受體不僅可以使細胞內鈣離子濃度升高,還可以增加BK通道對鈣離子的敏感性,使BK通道易于激活[30]。ATP為P2Y非選擇性激動劑,可激活P2Y1受體,從而激活BK通道[31]。
ATP引起細胞內鈣離子濃度升高是通過激活P2Y受體使細胞內IP3敏感鈣庫釋放鈣離子增加,還是通過激活P2X受體引起細胞外鈣內流增加,或兩者兼有,目前仍有爭議。細胞內鈣庫包括ryanodine 敏感性鈣庫和IP3 敏感性鈣庫,在對鼠黃體顆粒細胞內鈣調節研究顯示,ATP誘導的細胞內鈣動員受ryanodine受體的調節[32]。對鼠嗅上皮足細胞研究同樣顯示,ryanodine受體和IP3受體都參與G蛋白偶聯受體(包括P2Y受體)引起的細胞內鈣升高[33]。對細胞內鈣離子轉導機制研究則排除了ATP通過ryanodine受體的作用,ATP對細胞內鈣濃度的影響無ryanodine受體參與[34]。
ATP激活P2X和P2Y后,兩者可單獨發揮作用,也可相互協調。對腎動脈平滑肌細胞的研究表明,激活P2X受體可引發IP3受體介導的細胞內鈣釋放[35]。但在冠狀動脈平滑肌細胞是否有相同現象尚不完全清楚,還有待進一步探索。
4 結 語
ATP可以通過激活P2X受體和P2Y受體改變細胞內鈣離子濃度,其中前者主要通過改變細胞膜對鈣離子的通透性實現,后者主要通過磷脂酶C-IP3通路實現。細胞內鈣離子濃度升高又可以促進BK通道的開放,從而使冠狀動脈平滑肌細胞舒張,起到擴張血管的作用。在冠狀動脈硬化性心臟病、高血壓和糖尿病等病理條件下,BK通道功能受損,ATP對BK 通道的激活作用可能會發生變化,因此,深入研究ATP對病理條件下冠狀動脈平滑肌細胞BK通道的作用機制,可為ATP在臨床應用提供一定的理論依據,臨床意義重大。
[1] Wang RX,Chai Q,Lu T,etal.Activation of vascular BK channels by docosahexaenoic acid is dependent on cytochrome P450 epoxygenase activity [J].Cardiovasc Res,201l,90(2):344-352.
[2] Hu XQ,Zhang L.Function and regulation of large conductance Ca2+-activated K+channel in vascular smooth muscle cells[J].Drug Discov Today,2012,17(17/18):974-987.
[3] Hoshi T,Tian Y,Xu R,etal.Mechanism of the modulation of BK potassium channel complexes with different auxiliary subunit compositions by the omega-3 fatty acid DHA[J].Proc Natl Acad Sci U S A,2013,110(12):4822-4827.
[4] Wolin MS.Reactive oxygen species and the control of vascular function [J].Am J Physiol Heart Circ Physiol,2009,296(3):H539-H549.
[5] Li M,Chang S,Yang L,etal.Conopeptide Vt3.1 preferentially inhibits BK potassium channels containing beta4 subunits via electrostatic interactions[J].J Biol Chem,2014,289(8):4735-4742.
[6] Malty A.Ca-dependent K channels with large unitary conductance in chromaffin cell membranes[J].Nature,1981,29l(5815):497-500.
[7] Ma Z,Lou XJ,Horrigan FT.Role of charged residues in the S1-S4 voltage sensor of BK channels[J].J Gen Physiol,2006,127(3):309-328.
[8] Liu G,Zakharov SI,Yang L,etal.Locations of the beta1 transmembrane helices in the BK potassium channel[J].Proc Natl Acad Sci U S A,2008,105(31):10727-10732.
[9] Fakler B,Adelman JP.Control of K(Ca) channels by calcium nano/microdomains[J].Neuron,2008,59(6):873-881.
[10] Kwan HY,Shen B,Ma X,etal.TRPC1 associates with BK(Ca) channel to form a signal complex in vascular smooth muscle cells[J].Circ Res,2009,104(5):670-678.
[11] Jackson-Weaver O,Osmond JM,Riddle MA,etal.Hydrogen sulfide dilates rat mesenteric arteries by activating endothelial large-conductance Ca2+-activated K+channels and smooth muscle Ca2+sparks[J].Am J Physiol Heart Circ Physiol,2013,304(11):H1446-H1454.
[12] Grol MW,Pereverzev A,Sims SM,etal.P2 receptor networks regulate signaling duration over a wide dynamic range of ATP concentrations[J].J Cell Sci,2013,126(Pt 16):3615-3626.
[13] Khakh BS,North RA.Neuromodulation by extracellular ATP and P2X receptors in the CNS[J].Neuron,2012,76(1):51-69.
[14] Khakh BS,Burnstock G.The double life of ATP[J].Sci Am,2009,301(6):84-90,92.
[15] Jahr CE,Jessell TM.ATP excites a subpopulation of rat dorsal horn neurones[J]Nature,1983,304(5928):730-733.
[16] Benham CD,Tsien RW.A novel receptor-operated Ca2+-permeable channel activated by ATP in smooth muscle[J].Nature,1987,328(6127):275-278.
[17] Edwards FA,Gibb AJ,Colquhoun D.ATP receptor-mediated synaptic currents in the central nervous system[J].Nature,1992,359(6391):144-147.
[18] Rokic MB,Stojilkovic SS,Vavra V,etal.Multiple roles of the extracellular vestibule amino acid residues in the function of the rat P2X4 receptor[J].PLoS One,2013,8(3):e59411.
[19] K?les L,Gerevich Z,Oliveira JF,etal.Interaction of P2 purinergic receptors with cellular macromolecules[J].Naunyn Schmiedebergs Arch Pharmacol,2008,377(1):1-33.
[20] Coddou C,Yan Z,Obsil T,etal.Activation and regulation of purinergic P2X receptor channels[J].Pharmacol Rev,2011,63(3):641-683.
[21] Volonté C,D′Ambrosi N.Membrane compartments and purinergic signalling:the purinome,a complex interplay among ligands,degrading enzymes,receptors and transporters[J].FEBS J,2009,276(2):318-329.
[22] Burnstock G.Physiology and pathophysiology of purinergic neurotransmission[J].Physiol Rev,2007,87(2):659-797.
[23] Volonté C,Amadio S,D′Ambrosi N,etal.P2 receptor web:complexity and fine-tuning[J].Pharmacol Ther,2006,112(1):264-280.
[24] Bender SB,Berwick ZC,Laughlin MH,etal.Functional contribution of P2Y1 receptors to the control of coronary blood flow[J].J Appl Physiol, 2011,111(6):1744-1750.
[25] von Kugelgen I.Pharmacological profiles of cloned mammalian P2Y-receptor subtypes[J].Pharmacol Ther,2006,110(3):415-432.
[26] Str?baek D,Christophersen P,Dissing S,etal.ATP activates K and Cl channels via purinoceptor-mediated release of Ca2+in human coronary artery smooth muscle[J].Am J Physiol,1996,271(5Pt1):C1463-C1471.
[27] Lewis CJ,Evans RJ.P2X receptor immunoreactivity in different arteries from the femoral,pulmonary,cerebral,coronary and renal circulations[J].J Vasc Res,2001,38(4):332-340.
[28] Donnelly-Roberts D,McGaraughty S,Shieh CC,etal.Painful purinergic receptors[J].J Pharmacol Exp Ther,2008,324(2):409-415.
[29] Nagata K,Imai T,Yamashita T,etal.Antidepressants inhibit P2X4 receptor function:a possible involvement in neuropathic pain relief[J].Mol Pain,2009,5:20.
[30] Zhao G,Neeb ZP,Leo MD,etal.Type 1 IP3 receptors activate BKCa channels via local molecular coupling in arterial smooth muscle cells[J]. J Gen Physiol,2010,136(3):283-291.
[31] 柴松嶺,高璐,張福胤.P2Y及P2Y2受體的研究進展[J].中外醫療,2009,28(14):169-171.
[32] Morales-Tlalpan V,Arellano RO,Dιaz-Munoz M.Interplay between ryanodine and IP3 receptors in ATP-stimulated mouse luteinized-granulosa cells[J].Cell Calcium,2005,37(3):203-213.
[33] Hegg CC,Irwin M,Lucero MT.Calcium store-mediated signaling in sustentacular cells of the mouse olfactory epithelium[J].Glia,2009,57(6):634-644.
[34] 劉益龍,楊晨,趙莉莉,等.三磷酸腺苷引起大鼠三叉神經節胞內鈣離子信號轉導機制的研究[J].安徽醫科大學學報,2012,47(2):112-114.
[35] Povstyan OV,Harhun MI,Gordienko DV.Ca2+entry following P2X receptor activation induces IP3 receptor-mediated Ca2+release in myocytes from small renal arteries[J].Br J Pharmacol,2011,162(7):1618-1638.

