兒童足舟骨缺血性壞死的概述
易新成(綜述),陳博昌(審校)
(上海交通大學附屬第六人民醫院小兒骨科,上海 200233)
兒童足舟骨缺血性壞死又稱高樂病,1908年由K?hler[1]首次報道。與兒童Perthes病一樣,病因不明,是一種良性、自限性疾病,主要表現為中足區疼痛、觸痛和腫脹,患兒可有跛行[2-4]。X線片表現為舟狀骨變扁及密度增高[5]。高樂病預后良好,通常病變足舟骨可恢復至完全正常[6-8]。
1 高樂病的臨床及放射學特征
高樂病男孩比女孩多發,比例約為4∶1,與Perthes病的特點一致,男孩發病晚于女孩,男孩的平均發病年齡在5歲1個月,女孩平均在3歲10個月,但是也有少部分男孩發病年齡<3歲,尚無法解釋原因[9]。發病年齡不影響疾病的臨床表現及嚴重程度,癥狀平均持續時間為18個月[9]。單側發病的患兒,并無特定的好發足。各種體型患兒均可發病;患足亦無特殊體積或形狀,可以出現于正常足、平足及高弓足[7]。一般無家族史,無近期感染史,甲狀腺功能、血糖、紅細胞沉降率均正常,患兒開始走路時間也正常[10]。
高樂病最常見的癥狀是疼痛,可以出現跛行,最常見的體征是中足部位的觸痛,偶爾伴有腫脹及發熱。踝關節及距下關節活動度均正常[11]。
放射學最常見的表現是足舟骨密度增高及扁平(圖1、圖2),不同患兒出現扁平、壞死的程度各異[10]。Waugh[9]通過研究發現,高樂病患兒足舟骨主要存在兩種影像學異常,第一種異常最常出現,表現為早期變扁平,像被擠壓過,伴有零散的高密度灶及正常骨小梁的缺失,經過約2年的演變,足舟骨變得稍有扁平但密度正常;第二種異常,起初足舟骨的形狀正常,但是與其他跗骨比起來,密度均勻一致的增高,4個月后部分被吸收,再過10個月就僅剩一個模糊又狹窄的影子,發病20個月后,足舟骨開始以數個骨化中心重建,最終恢復至完全正常。
2 高樂病的發病及轉歸
至今為止高樂病的病因仍不十分明確[12]。由于發病率較低,致使進行基礎和臨床研究的資料不足,尚未見有明確的理論和結論來揭示該病的自然病程,但既然是缺血性壞死,該文則著重從足舟骨的骨化和血液供應這兩個最基本的方面予以分析和總結,以饗讀者。
2.1足舟骨的骨化規律 目前已知,足舟骨是所有跗骨中骨化發生最晚的骨[13-15]。Karp[16]在1937年隨訪了50例正常兒童足部X線片后,得出結論:①足部諸骨,骨化核出現時間女孩平均在1.5~2歲,男孩平均在2~2.5歲;②不規則骨化并不少見,有時扁平,有時會裂成碎片或呈高密度表現。Waugh[9]在1958年對52例正常兒童足部X線片進行了每隔6個月的隨訪,得出了與Karp[16]較一致的結論:①骨化核的出現男孩比女孩晚;②異常骨化在男孩比女孩常見;③異常骨化經常出現在骨化延遲的足舟骨。
這些研究基本解釋了足舟骨骨化模式的多樣性。在足部諸骨的骨化過程中,骨化異常的情況其實很常見,一部分表現為體積和形狀的細微不規則,一部分改變則較大,但是所有這些改變,都不同于高樂病的足舟骨扁平和密度增大的表現。
2.2足舟骨的血液供應 1958年Waugh[9]描述了足舟骨的血液循環模式,研究結果來自對21例年齡分別在0~19歲的嬰幼兒、兒童及青少年尸體的髂外動脈或股動脈下端的染料灌注。并指出,在足舟骨非關節面的軟骨周圍含有豐富的血管網,并有大量血管向足舟骨里面滲透,骨化核通常首先在一根動脈末端開始出現,這個過程持續時間較短,隨后其他動脈長入并逐漸成為骨化核的一部分,到5歲時(高樂病最好發時期)發展為5~6根;少數情況下,骨化核的全部血液供應僅來自一根動脈,直到4~6歲為止,然后呈放射狀排列的動脈長入骨化核;極少數的標本中可以看到多根動脈分別形成多個骨化中心。
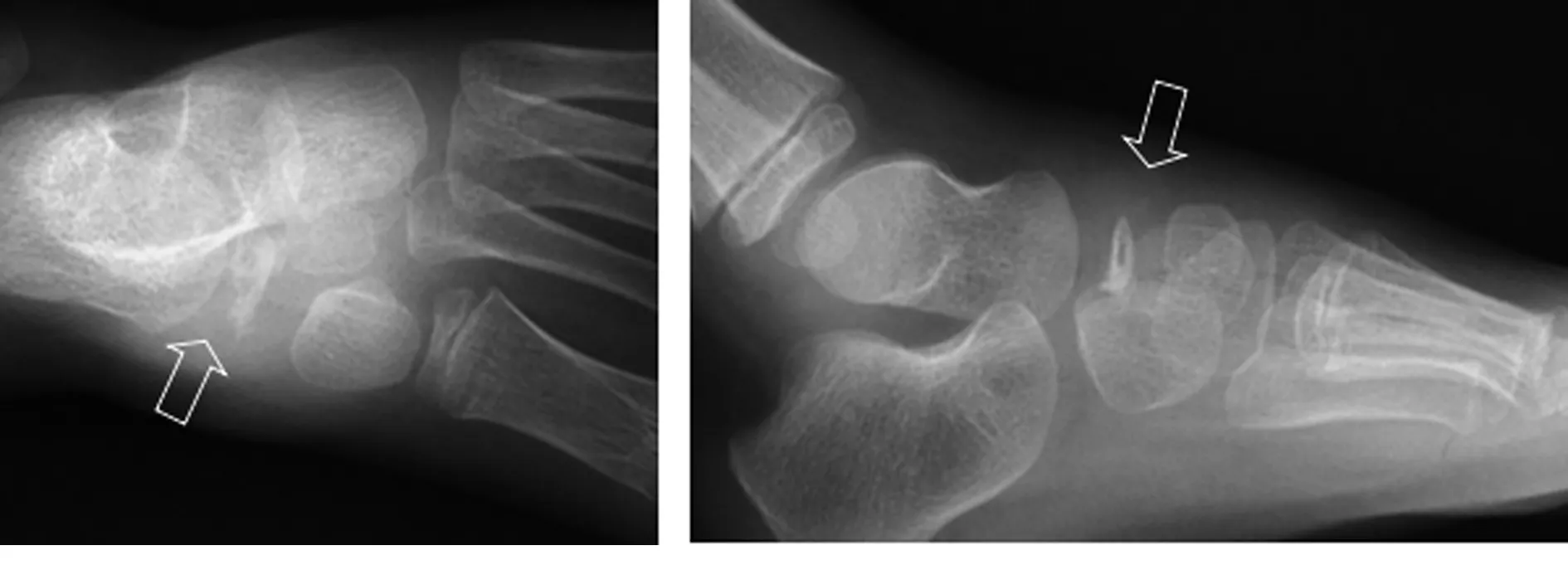
圖1 圖2
2.3高樂病的發病機制 大部分有關高樂病發病機制的推測來自于X線片,基于病理標本的報道極少。個別研究者的少量病理研究發現,顯微鏡下看到的是散在的骨破壞區,壞死的骨小梁間夾雜著正常的骨組織,這些對于病因病機的研究都沒多大用處[9]。盡管沒有比較有價值的組織學和細菌學方面的材料來說明,但是男孩發病率高以及自限性的特點說明感染不大可能是高樂病的病因[9]。
而K?hler[17]認為,單一的外傷不足以導致本病,但過度的、持續幾個月的張力作用于正常的足舟骨上或者正常的張力持續地作用于發育不良的足舟骨上可能會導致這種狀況。
Waugh[9]認為骨化延遲可能是所有導致異常骨化或高樂病的事件中的起始事件,他認為足舟骨在足弓的特殊位置以及足舟骨是跗骨當中骨化最晚的一個,這兩個事實表明生長發育中的足舟骨對體質量所形成的壓力非常敏感,隨著軟骨成分相對骨性成分的比例減少,骨性成分直接承受壓力并且松質骨會順著壓力方向縱向排列,如果骨化核延遲出現,加之此時兒童體質量的增加,足舟骨負重亦增加,甚至超過其負重能力。可以推測,骨化異常就是未受保護的足舟骨對正常負重的反應。根據骨化核的狀態、這些機械因素以及它們相互作用的時間可以導致不同類型的異常骨化。如果參與骨化的血管在穿過軟骨與骨交界處受壓,缺血就由此產生了。這種缺血還會導致反應性充血及疼痛,這有可能就是高樂病的病因。
2.4恢復機制 壞死的足舟骨具有顯著的恢復能力,這與Perthes病中常出現殘余畸形形成鮮明的對比。
綜合文獻所述,兩個因素可能起作用:①X線片上雖然顯示骨化核變扁,但是距骨和楔骨之間的空間沒有減小,并且這一空間由肥大的軟骨充滿,肥大的軟骨可能是對于增加的壓力的一種反應,或更大可能是對骨化核中央性缺血的反應,它形成了一層厚厚的組織,充當減震器,從而保證了骨化核可以正常發育。②更重要的一點是呈放射狀排列的血管,即使骨化核僅由單一的血管供應,軟骨周圍環狀的血管也會發出分支朝向骨化核,這與僅有兩條主要血液供應來源的股骨頭形成鮮明的對比,而且股骨頭的骺板成了再血管化的屏障,足舟骨沒有這樣的屏障,放射狀排列的血管滲入骨化核是很容易的,所以保證了足舟骨能迅速再血管化并在周圍軟骨的保護下重建自身[9]。
3 高樂病的診斷、治療及預后
高樂病的診斷主要依據臨床癥狀(中足部位的疼痛、觸痛及腫脹)加上X線片上足舟骨密度增高及變窄的表現,兩者對于該病的診斷缺一不可。若X線片表現與高樂病相似,但無臨床癥狀,應視為不規則骨化;再者即使有多骨化中心但沒有密度增高的情況亦不能與之混淆;最后對有疼痛主訴的患兒也應當仔細檢查有無其他致病原因,如拍X線片來排除感染所致的疼痛(雖然可能性極小)。總之,高樂病的診斷不應該出現在無任何癥狀的足上[10]。
本病預后較好,盡管有關本病的長期隨訪報道較少,但是僅有的幾項研究結果較為一致,即治療方式與最終結果間無差異,但是是否選擇治療會影響病程長短。Ippolito等[18]1945年開始對12例患兒進行了一項長達33年的隨訪研究,治療方法分別為石膏制動和采用足弓墊。結果顯示,所有患者足舟骨結構完全恢復至兩側沒有任何差別,無一例患者出現跗骨間關節退行性變,恢復時間平均8個月,最少6個月,最長13個月,兩種治療方式效果無差異,但前者對于緩解疼痛更快速。Williams等[10]1948年開始對20例患兒進行了平均9.5年的隨訪研究,治療方法分別為行走石膏固定8周和不作處理,最終20例患兒癥狀體征及影像學表現均完全恢復正常,無一例發生骨性關節炎。Borges等[19]1948年開始對14例患兒進行了平均31.5年的隨訪,治療方法分別為7例患兒行走石膏固定后穿正常鞋類,另7例患兒則不作特殊處理(可以休息,也可拄拐),結果12例完全恢復正常,2例恢復稍欠(1例患兒因為平足并有副足舟骨,另1例因為有距跟融合),無較差結果。其中采用行走石膏固定治療的患兒平均恢復時間為3個月,未做特殊處理的患兒則平均需10個月;采用行走石膏固定治療的患兒中,固定8周者恢復最快,固定周數越短恢復越慢,但最長不超過4個月。
雖然高樂病預后良好,但當患兒的局部癥狀較為嚴重并難以忍受時,可積極采取保守的方法治療,且治療的方法應遵循一定的原則,即首選膝關節以下的行走石膏固定治療8周,此時若癥狀消失則患兒恢復自由活動,若癥狀加重或復發,那么需要繼續固定一段時間[20]。其他治療方法包括穿矯正鞋、戴足弓墊、休息、拄拐等。雖然各種治療方式的最終結果無統計學意義,但是適當的治療會顯著縮短病程。
4 小 結
兒童足舟骨是骨化最晚的跗骨,當骨化延遲時,容易發生異常骨化,男孩足舟骨骨化晚于女孩,更易發生異常骨化,這點與高樂病較易發生于男孩身上不謀而合,而且高樂病也是一種自限性的過程,因此究竟高樂病只是足舟骨發育過程中的一種異常形式,還是一種獨立的“病”,尚有待研究。基于目前的文獻回顧結果,暫當作疾病來處理,臨床工作中不宜忽視,需要積極進行病理學等研究,促進對該問題的認識。
[1] K?hler A.über eine h?ufige,bisher anscheinend unbekannte Erkrankung einzelner kindlicher Knochen[J].Münch Med Wschr,1908,55:1923-1925.
[2] Nguyen NA,Klein G,Dogbey G,etal.Operative versus nonoperative treatments for Legg-Calvé-Perthes disease:a meta-analysis[J].J Pediatr Orthop,2012,32(7):697-705.
[3] Kim HK.Pathophysiology and new strategies for the treatment of Legg-Calvé-Perthes disease[J].J Bone Joint Surg Am,2012,94(7):659-669.
[4] Thompson GH.Salter osteotomy in Legg-Calvé-Perthes disease[J].J Pediatr Orthop,2011,31(2):192-197.
[5] Gips S,Ruchman RB,Groshar D.Bone imaging in Kohler′s disease[J].Clin Nucl Med,1997,22(9):636-637.
[6] Shastri N,Olson L,Fowler M.K?hler′s Disease[J].West J Emerg Med,2012,13(1):119-120.
[7] Khan AQ,Sherwani MA,Gupta K,etal.K?hler′s disease[J].Saudi Med J,2008,29(9):1357-1358.
[8] Herring J.Tachdjian′s PEdiatric orthopaedics[M].4th ed.New York:WB Saunders,2001:406-408.
[9] Waugh W.The ossification and vascularisation of the tarsal navicular and their relation to K?hler′s disease[J].J Bone Joint Surg Br,1958,40(4):765-777.
[10] Williams GA,Cowell HR.K?hler′s disease of the tarsal navicular[J].Clin Orthop Relat Res,1981(158):53-58.
[11] Ertel AN,O′Connell FD.Talonavicular coalition following avascular necrosis of the tarsal navicular[J].J Pediatr Orthop,1984,4(4):482-484.
[12] Tsirikos AI,Riddle EC,Kruse R.Bilateral K?hler′s disease in identical twins[J].Clin Orthop Relat Res,2003(409):195-198.
[13] Pourlis AF,Antonopoulos J.The ossification of the pelvic girdle and leg skeleton of the quail(Coturnix coturnix japonica)[J].Anat Histol Embryol,2013.
[14] Schuh A,Honle W.Minor foot curses (12):cornuate navicular and accessory tarsal navicular[J].MMW Fortschr Med,2009,151(22):44.
[15] Dyson S,Marks D.Foot pain and the elusive diagnosis[J].Vet Clin North Am Equine Pract,2003,19(2):531-565.
[16] Karp MG.K?hler′s disease of the tarsal scaphoid[J].J Bone Joint Surg Am,1937,19:84-96.
[17] K?hler A.Roentgenology[M].London:Bailliere,Tindall and Cox,1928:114.
[18] Ippolito E,Ricciardi Pollini PT,Falez F.K?hler′s disease of the tarsal navicular:long-term follow-up of 12 cases[J].J Pediatr Orthop,1984,4(4):416-417.
[19] Borges JL,Guille JT,Bowen JR.K?hler′s bone disease of the tarsal navicular[J].J Pediatr Orthop,1995,15(5):596-598.
[20] Cox MJ.K?hler′s disease[J].Postgrad Med J,1958,34(397):588-591.

