內鏡黏膜下剝離術治療上消化道黏膜下病變療效及安全性
喬麗娟,徐 輝,陳虹彬,蔣明德,賀 莉,湯善宏
內鏡技術的發展使得上消化道黏膜下病變的發現率明顯提高,由于性質不能完全確定,如不及時處理,可能會導致惡變,但外科手術切除創傷較大。內鏡下黏膜剝離術(ESD)對上消化道黏膜下病變的治療已逐漸顯示出優越性,其切除率高、創傷小、復發率低、費用低廉等優點受到越來越多人的關注[1]。我院消化內鏡中心從2009年起,對內鏡檢查發現的上消化道黏膜下隆起病變行ESD切除,取得了較好的療效。本研究對57例ESD的療效和安全性進行分析。
1 資料與方法
1.1病例資料 2009年6月~2013年11月,我科對食管及胃黏膜下隆起病變的患者行ESD切除手術共57例,其中男28例,女29例,年齡34~74歲,平均51.5歲。所有患者術前均經超聲內鏡檢查確定黏膜下隆起性質及層次。
1.2方法
1.2.1儀器 電子胃鏡、內鏡超聲系統以及海博刀(高頻電切裝置,氬離子凝固器以及水刀)。
1.2.2ESD方法[2]用IT刀于距病灶邊緣約0.5 cm處進行1周的電凝標記;于病灶處黏膜下注射靛胭脂,分離黏膜層。重復以上步驟逐步剝離黏膜和瘤體。對裸露的小血管、出血點等進行處理,出血較大或者穿孔較小者,使用鈦夾封閉。術畢安置胃管。在ESD整個操作過程中,使用CO2泵注氣。
1.2.3術后處理 所有患者均住院治療,術后第1 d禁食;第2 d若無出血、腹痛和腹脹,進流食;第3 d進軟食、冷食。常規使用抗生素和止血藥物,觀察有無腹痛、腹脹和便血等并發癥表現。術后1年內1、3、6個月患者分別門診隨訪1次。
2 結果
2.1ESD手術相關情況 所有患者內鏡檢查發現黏膜下隆起病變(圖1),術前接受超聲內鏡檢查確定病變的種類及層次(圖2)。57例均成功切除黏膜下病變,術中出血6例經止血鉗、3例鈦夾封閉等內鏡止血后有效得到控制;2例在剝離黏膜下瘤體過程中出現0.3~0.4 cm大小穿孔,內鏡下鈦夾夾畢。術后復查腹部未見出血、穿孔表現。術后1年內胃鏡隨訪,切除部位見白色瘢痕。

圖1 消化胃鏡下見黏膜下隆起
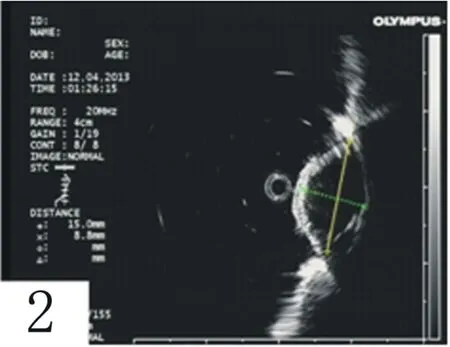
圖2 超聲內鏡提示間質瘤
2.2術后病理結果 57例病理檢查結果如下:病理示間質瘤40例(圖3),囊腫2例,胃黏膜下血管瘤1例,平滑肌瘤8例,胃異位胰腺5例,胃早癌1例。超聲內鏡診斷與病理一致率達94.7%(54/57)。其中3例術前超聲內鏡考慮間質瘤,病理結果提示為平滑肌廇。

圖3 間質瘤HE染色
2.3術后隨訪 55例接受術后常規內鏡隨訪,另外2例患者失訪。術后1個月隨訪,其中10例鈦夾仍存留;3、6個月隨訪,53例切除部位均為白色瘢痕(圖4)。隨訪患者均未發現遠期穿孔、出血、感染、復發及瘢痕導致狹窄。

圖4 術后復查原病灶處為瘢痕組織
3 討論
上消化道黏膜下隆起病變是常見疾病,一旦發現病變,給患者及家屬帶來心理及經濟負擔。傳統外科手術治療黏膜下隆起性病變,手術創面大、費用高、恢復慢,且影響患者以后的生活質量,超聲內鏡的出現使得黏膜下病變的發現率及診斷率明顯提升。ESD是新興的微創技術,由日本內鏡醫生Oda等在內鏡下黏膜切除術(EMR)基礎上創立[3]。IT刀、彎刀、鉤刀等的出現,使得ESD術對大的黏膜下病變可以進行全瘤切除[3]。ESD術在提高患者生活質量方面具有絕對優勢,因創傷小、恢復快、費用低等優點而得到廣泛應用。我院消化內鏡中心在國內較早開展ESD術,并熟練掌握該技術。從我院開展的病例來看,其對上消化道黏膜下病變療效確切,取得很好的治療效果。
本組57例病灶均成功切除,術中少量出血經內鏡下成功止血,未發現穿孔,術后無特殊異常。術后3、6個月隨訪,切除部位均為白色瘢痕,隨訪均未發現遠期穿孔、出血、感染、復發及瘢痕導致狹窄。據國外文獻報道,ESD切除病變中胃早癌比例為2%~10%[4-5],術中穿孔率不足1%[6],與本研究結果基本一致。
超聲內鏡檢查黏膜下病變具有較好的優勢,能清晰顯示消化道壁層次結構,較為準確判斷隆起病灶起源、大小、是否浸潤及周圍有無淋巴結腫大等。本組病例中切除病變組織均進行全瘤送檢病理診斷,相比術前超聲內鏡診斷準確率僅為94.7%(54/57)。分析誤診的原因,可能是由于超聲醫生視覺、感觀經驗,以及輔助檢查技術客觀局限性所致。
總之,ESD術為切除黏膜下病變安全、有效的方法。能夠使患者盡早得到確診,解除患者及家屬憂慮,得到及時最佳的治療,并為患者節約費用,降低手術風險,是一項值得推廣的實用技術。
【參考文獻】
[1] Noriaki Matsui,Kazuya Akahoshi.Endoscopic submucosal dissection for removal of superfi cial gastrointestinal neoplasms:a technical review[J].World J Gastrointest Endoscopy,2012,4(4):123-136.
[2] Jiro Watari,Toshihiko Tomita.Clinical outcomes and risk factors for perforation in gastric endoscopic submucosal dissection:a prospective pilot study[J].World Journal of Gastrointestinal,2013,5(6):281-287.
[3] Cai M,Zhou P,Yao L.Current status of endoscopic resection in China[J].Digestive Endoscopy,2012,24(Suppl 1):166-171.
[4] Min BH,Lee JH,Kim JJ,et al.Clinical outcomes of endoscopic submucosal dissection(ESD)for treating early gastric cancer:comparison with endoscopic mucosal resection after circumferential precutting(EMR-P)[J].Dig Liver Dis,2009,41(3):201-209.
[5] Watanabe K,Ogata S,Kawazoe S,et al.Clinical outcomes of EMR for gastric tumors:historical pilot evaluation between endoscopic submucosal dissection and conventional mucosal resection[J].Gastrointest Endosc,2006,63(6):776-782.
[6] Hanaoka N,Uedo N,Ishihara R,et al.Clinical features and outcomes of delayed perforation after endoscopic submucosal dissection for early gastric cancer[J].Endoscopy,2010,42(12):1112-1115.

