肌肽預處理對缺氧缺血后大鼠認知功能的影響
張香敏,張展,程秀永,徐發林,賈天明,欒斌,賈莉婷
圍生期缺氧導致的新生兒缺氧缺血性腦損傷(hypoxic ischaemic brain damage,HIBD)是新生兒科的常見病和多發病,發病重,病死率高。近年來,隨著新生兒重癥監護病房的建立,死亡率較前降低,但重度窒息新生兒存活者中神經系統后遺癥如智力障礙、神經行為問題、腦性癱瘓等發生率較前上升,給家庭和社會帶來了沉重的經濟負擔和社會負擔,是值得關注的社會問題,也是目前廣大兒科醫務人員研究的熱點問題。
有研究證實,肌肽對缺血性腦損傷、缺血再灌注性腦損傷等具有神經保護作用[1-3],但肌肽是否對缺氧缺血(hypoxic ischaemic,HI)性腦損傷具有神經保護作用,目前未見報道。本研究旨在對7日齡大鼠制作HI模型,通過Morris水迷宮實驗,探討肌肽對HI大鼠認知功能的影響,從而推斷肌肽是否對HI大鼠具有神經保護作用。
1 材料與方法
1.1 實驗動物 7日齡清潔級SD大鼠(證書編號:SCXK(滬)2008-0016),雌雄不拘,體質量12~18 g,均購自中科院實驗研究實驗室,并經復旦大學動物倫理委員會批準,按照實驗動物有關保護條例進行,在研究期間新生大鼠與母鼠在同一籠內飼養,光照時間12 h,自由攝食水。
1.2 方法
1.2.1 實驗分組及給藥方法 將36只SD大鼠按隨機數字表法分為3組,每組12只,(1)肌肽預處理組:在HI誘導前30 min腹腔注射肌肽1次250 mg/kg[4,5];(2)HI組:在相同條件下用等容積的生理鹽水代替;(3)假手術組:不接受任何治療和處理。
1.2.2 HI模型制作 在室溫(25±2)℃環境下,將大鼠四肢及頭部固定在手術臺上,吸入無水乙醚誘導麻醉;皮膚常規消毒后小心剪開頸部皮膚,逐層分離暴露左側頸總動脈并小心分離迷走神經,用4個0號外科絲線雙線結扎該動脈并從中間剪斷,造成永久性斷流。此后將大鼠放回到母鼠身邊恢復1.5 h,氧氮混合氣體(8%氧氣/92%氮氣)缺氧箱中持續通入濕化的氮氧混合氣2 h,缺氧結束即制成7日齡大鼠HI腦損傷動物模型。假手術組動物與HI組動物來自同一窩動物,動物置于相同條件下,既不結扎血管阻斷血流,也不置于缺氧箱里缺氧,皮膚切一小口,僅分離左側頸總動脈。建模完成后動物放回母鼠籠內,并送回動物房,由專人飼養。
1.2.3 Morris水迷宮實驗步驟 大鼠28~33 d時通過Morris水迷宮測試系統評價其空間學習和記憶能力,參考以前的方法并作小的修改[6]。每日9:00~16:00進行,以盡量保證實驗條件的均衡。(1)Morris水迷宮系統:本系統包括一個盛有水的黑色圓形水池(水池的直徑1.8 m,深度65 cm,水深27.5 cm,水溫(25±2)℃左右),為了突出水中的目標,水用墨汁染黑,以便于攝相機的跟蹤。池中隱藏在水下2 cm的半透明的站臺一個(10 cm×10 cm);一套圖像采集與處理系統(攝像機、錄像機、顯示器和分析軟件等)。所有實驗均在一安靜的屏蔽室內進行,為了避免可能利用的視覺提示,水池周圍的白色窗簾在實驗時被放下。正式實驗的前一天讓動物在撤離平臺的水池內適應性訓練1次,實驗者不了解大鼠的分組情況。(2)經典的Morris水迷宮實驗分為定位航行實驗和空間探索實驗兩個部分。定位航行實驗:歷時5 d,每次將大鼠面向池壁分別從4個不同象限的入水點放入水中,記錄其尋找到隱藏在水面下站臺的時間即逃避潛伏期和找到站臺前游泳的距離以及游泳的速度,每次120 s。如果大鼠在規定時間內不能找到站臺,測試者直接把大鼠放到站臺上停留30 s,以加強大鼠的記憶。然后以同樣的方法再測試下一只大鼠。每次訓練間隔1 min。空間探索實驗:在定位航行試驗結束后的次日(第6天)撤去平臺,然后選擇離站臺最遠的入水點將大鼠面對池壁放入水池中。記錄其在一定時間內的游泳軌跡,考察大鼠對隱藏站臺位置的記憶情況。測試時間為30 s。記錄其在目標象限停留時間的百分比,此參數是空間記憶的特別測試。連接到水池正上方的計算機跟蹤軟件記錄實驗的全過程。實驗參數包括:大鼠的游泳時間、游泳距離及在目標象限游泳時間的百分比。
2 結果
2.1 各組大鼠在Morris水迷宮定位導航測試中游泳時間和距離的比較 見表1、2。
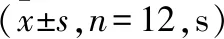
表1 各組大鼠在Morris水迷宮定位導航測試中游泳時間的比較
注:與HI組比較,aP<0.05。
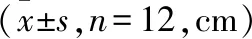
表2 各組大鼠在Morris水迷宮定位導航測試中游泳距離的比較
注:與HI組比較,aP<0.05。
在評價與大鼠學習能力有關的Morris水迷宮定位導航測試中,HI組動物的游泳時間明顯大于肌肽預處理組,差異有統計學意義(P<0.05);其游泳距離亦相應增加,差異有統計學意義(P<0.05);肌肽預處理組較HI組減少了HI動物的游泳時間及距離,差異有統計學意義(P<0.05);而游泳時間和游泳距離在肌肽預處理組和假手術組之間差異無統計學意義(P>0.05);此外,肌肽預處理后各組動物游泳速度之間的差異亦無統計學意義(P>0.05)。
2.2 肌肽預處理對大鼠在目標象限游泳時間百分比的影響 在評價與大鼠記憶能力有關的Morris水迷宮探索實驗中,預處理組大鼠在目標象限游泳時間所占百分比為(27.75±4.04)%,HI組為(19.75±2.80)%,假手術組為(29.00±4.37)%。3組比較差異有統計學意義(F=20.93,P<0.001),預處理組與HI組比較,差異有統計學意義(P<0.01)。
3 討論
評價有關空間學習和記憶認知測試的方法有很多[7-9],但Morris水迷宮是公認的評價與認知功能有關的空間學習和記憶能力的標準測試系統[10-13],Morris水迷宮是一種應激性測試,能較準確的反映學習和記憶能力,這一特點已經在一個研究中得到證實[14]。該實驗包括定位航行實驗和空間探索實驗;定位航行實驗評價空間學習能力,評價指標包括游泳時間和游泳距離,學習能力下降時,游泳時間延長,游泳距離增加;空間探索實驗評價記憶能力,評價指標是目標象限游泳時間的百分比。而且,有關研究已經證實海馬和大腦皮質與學習和記憶能力有關,神經元損傷可導致認知功能下降[10,12,15-20]。有研究表明:海馬CA1區的神經元比CA3區神經元明顯敏感,因為海馬CA1區含有比CA3區神經元較高的超氧陰離子[21]。而且,從CA1區神經元分離的線粒體比CA3區釋放更多的ROS[22],所以海馬CA1區對HI較敏感。生后28~33 d的大鼠按照腦發育的過程來講其相當于2歲左右的幼兒[22],這一階段是學習和記憶的關鍵時期。因此,本研究選擇生后28~33 d的大鼠作為研究對象,評價學習和記憶能力。
曾經有研究報道,肌肽對轉基因缺血大鼠的認知功能無明顯影響[23]。本研究結果表明,肌肽預處理降低了HI大鼠的游泳時間和游泳距離,增加了大鼠在目標象限游泳時間的百分比,因此改善了由于HI導致的遠期空間學習和記憶能力下降,結果與文獻報道不一致,分析其原因可能是由于模型不同,鼠齡不同有關。本課題組曾經通過TUNEL染色證實肌肽預處理后HI大鼠大腦皮質和海馬CA1區的TUNEL陽性細胞數明顯減少。肌肽預處理后海馬和大腦皮質神經細胞凋亡減少與改善HI大鼠認知功能有關[24]。
總之,肌肽預處理不僅改善由于HI誘導的腦損傷的生理和病理變化,而且也改善了HI大鼠的遠期認知功能。這些結果表明:肌肽有可能成為一個有前途的腦損傷神經保護藥物,并有可能為臨床腦損傷的治療開辟新的途徑。
[1] Rajanikant GK,Zemke D,Senut MC,et al.Carnosine is neuroprotective against permanent focal cerebral ischemia in mice[J].Stroke,2007,38(11):3023-3031.
[2] Min J,Senut MC,Rajanikant K,et al.Differential neuroprotective effects of carnosine,anserine,and N-acetyl carnosine against permanent focal ischemia[J].J Neurosci Res,2008,86(13):2984-2991.
[3] Dobrota D,Fedorova T,Stvolinsky S,et al.Carnosine protects the brain of rats and Mongolian gerbils against ischemic injury:after-stroke-effect[J].Neurochem Res,2005,30 (10):1283-1288.
[4] Aydín AF,Küskü-Kiraz Z,Doqru-Abbasoqlu S,et al.Effect of carnosine treatment on oxidative stress in serum,apoB-containing lipoproteins fraction and erythrocytes of aged rats[J].Pharmacol Rep,2010,62(4):733-739.
[5] Aydin AF,Kücükgergin C,Ozdemirler-Erata G,et al.The effect of carnosine treatment on prooxidant-antioxidant balance in liver,heart and brain tissues of male aged rats[J].Biogerontology,2010,11(1):103-109.
[6] Barhwal K,Singh SB,Hota SK,et al.Acetyl-L-carnitine ameliorates hypobaric hypoxic impairment and spatial memory deficits in rats[J].Eur J Pharmacol,2007,570(1-3):97-107.
[7] Holmes A,Wrenn CC,Harris AP,et al.Behavioral profiles of inbred strains on novel olfactory,spatial and emotional tests for reference memory in mice[J].Genes Brain Behav,2002,1(1):55-69.
[8] Holscher C,Schmid S,Pilz PK,et al.Lack of the metabotropic glutamate receptor subtype 7 selectively impairs short-term working memory but not long-term memory[J].Behav Brain Res,2004,154(2):473-481.
[9] Lange-Asschenfeldt C,Lohmann P,Riepe MW.Spatial performance in a complex maze is associated with persistent long-term potentiation enhancement in mouse hippocampal slices at early training stages[J].Neuroscience,2007,147(2):318-324.
[10] Gozal E,Row BW,Schurr A,et al.Developmental differences in cortical and hippocampal vulnerability to intermittent hypoxia in the rat[J].Neurosci Lett,2001,305(3):197-201.
[11] Ikeda T,Mishima K,Yoshikawa T,et al.Selective and long-term learning impairment following neonatal hypoxic-ischemic brain insult in rats[J].Behav Brain Res,2001,118(1):17-25.
[12] Row BW,Kheirandish L,Neville JJ,et al.Impaired spatial learning and hyperactivity in developing rats exposed to intermittent hypoxia[J].Pediatr Res,2002,52(3):449-453.
[13] Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc,2006,1(2):848-858.
[14] Zhao P,Peng L,Li L,et al.Isoflurane preconditioning improves long-term neurologic outcome after hypoxic-ischemic brain injury in neonatal rats[J].Anesthesiology,2007,107(6):963-970.
[15] D'Hooge R,De Deyn PP.Applications of the Morris water maze in the study of learning and memory[J].Brain Res Brain Res Rev,2001,36(1):60-90.
[16] Farr SA,Flood JF,Morley JE.The effect of cholinergic,GABAergic,serotonergic,and glutamatergic receptor modulation on posttrial memory processing in the hippocampus[J].Neurobiol Learn Mem,2000,73(2):150-167.
[17] Hagewoud R,Havekes R,Novati A,et al.Sleep deprivation impairs spatial working memory and reduces hippocampal AMPA receptor phosphorylation[J].J Sleep Res,2010,19(2):280-288.
[18] Hok V,Save E,Lenck-Santini PP,et al.Coding for spatial goals in the prelimbic/infralimbic area of the rat frontal cortex[J].Proc Natl Acad Sci U S A,2005,102(12):4602-4607.
[19] Sargolini F,Roullet P,Oliverio A,et al.Effects of intra-accumbens focal administrations of glutamate antagonists on object recognition memory in mice[J].Behav Brain Res,2003,138 (2):153-163.
[20] Steffenach HA,Witter M,Moser MB,et al.Spatial memory in the rat requires the dorsolateral band of the entorhinal cortex[J].Neuron,2005,45(2):301-313.
[21] Wang X,Pal R,Chen XW,et al.High intrinsic oxidative stress may underlie selective vulnerability of the hippocampal CA1 region[J].Brain Res Mol Brain Res,2005,140(1-2):120-126.
[22] Mattiasson G,Friberg H,Hansson M,et al.Flow cytometric analysis of mitochondria from CA1 and CA3 regions of rat hippocampus reveals differences in permeability transition pore activation[J].J Neurochem,2003,87(2):532-544.
[23] Pekcetin C,Kiray M,Ergur BU,et al.Carnosine attenuates oxidative stress and apoptosis in transient cerebral ischemia in rats[J].Acta Biol Hung,2009,60(2):137-148.
[24] 張香敏,張展,程秀永,等.肌肽對缺氧缺血性腦損傷大鼠凋亡生化指標的影響[J].中國中西醫結合兒科學,2014,6(1):41-44.

