大蒜素及前藥對人食管癌細胞 Eca9706 的增殖抑制及其凋亡基因表達的影響
常全娥, 茍 萍
(新疆大學生命科學與技術學院, 新疆 烏魯木齊 830046)
大蒜素及前藥對人食管癌細胞 Eca9706 的增殖抑制及其凋亡基因表達的影響
常全娥, 茍 萍*
(新疆大學生命科學與技術學院, 新疆 烏魯木齊 830046)
目的 研究大蒜素和它的前藥 (蒜氨酸 +蒜氨酸酶) 對食管癌細胞 Eca 9706 的增殖抑制及對凋亡基因表達的影響。 方法 用大蒜素和大蒜素前藥處理食管癌細胞 Eca 9706, 采用 MTT法檢測癌細胞的增殖抑制作用, 實時定量RT-PCR檢測凋亡基因的表達。 結果 大蒜素及其前藥對食管癌細胞增殖抑制呈現時間和劑量相關性, 大蒜素前藥的抑制效果優于大蒜素。 實時定量 RT-PCR表明大 蒜素和它的前藥上 調了癌細胞 bax和 caspase-3 mRNA的表 達, 下調survivin、 突變型 p53 和 bcl-2 mRNA的表達。 結論 大蒜素及其前藥抑制食管癌細胞增殖和誘導凋亡可能是通過線粒體通路實現。
大蒜素;大蒜素前藥;食管癌細胞;細胞增殖;細胞凋亡
近年來惡性腫瘤的發病率和死亡率均呈上升趨勢,已成為常見病和多發病。食管癌是人類消化道的常見腫瘤, 我國每年因食管癌死亡者約15萬人,占癌癥患者死亡率近 1/4, 位居第二位。 我國抗腫瘤藥物近10年來取得了令人矚目的成就。 現能生產的抗腫瘤藥物 (不含免疫調節劑) 包括:烷化劑類、抗代謝藥、天然抗腫瘤藥、抗腫瘤抗生素等,但多數抗腫瘤藥物存在毒副作用較大,療效不穩定、復發率高等問題。因此,尋找一種低毒、療效穩定、使用方便且具有廣譜抗腫瘤活性的藥物成為抗腫瘤藥物研究和臨床中亟待解決的問題。腫瘤的中藥治療是當今臨床治療的重要手段之一,中草藥及其活性成分抗腫瘤藥物的研究和開發已成為人們關注的熱點, 我國具有 1 000 多年中草藥研究的悠久歷史,有很多的古代偏方和有名中醫的經驗方,開發中草藥抗腫瘤藥物具有廣闊的發展前景。
大蒜 Allium sativum L.是 歷 史 悠久的藥 食 兩 用植物, 早在 4 000 多年前人們就開始食用大蒜, 并用大蒜治療疾病。大蒜的多種藥理作用主要源于它所特有的有機含硫化合物,如蒜氨酸及其分解產物大蒜素[1-3]等, 大蒜組織損傷時釋放蒜氨酸酶 (Alliinase), 蒜氨酸酶催化蒜氨酸縮合形成具有強烈辛辣味的揮發性大蒜素 (Allicin, 主要成分是二烯丙基硫代亞磺酸脂)。 大蒜素遇光、 熱容易降解成二烯丙基三硫和二烯丙基二硫化合物 (DADS) 等含硫有機化 合 物[3]。 近 年 來 國 內 外 研 究 表 明, 大蒜素對胃癌、結腸癌、前列腺癌、肺癌等癌細胞有明顯抑制 作 用[4-7]。 發 現 大 蒜 素 通 過 抑 制 腫 瘤 細 胞的增殖,影響細胞周期,誘導腫瘤細胞凋亡,對抗癌 藥 具 有 增 敏 作 用[4-5,7-9]等 抑 制 或 殺 死 腫 瘤 細 胞 。大蒜素生 物 半衰期短 (t1/2=2.32 h), 理 化 性 質 不穩定,在常溫下可進一步分解,引起分子中二硫鍵斷 裂,降 解 成 各 種 化 合 物,如 阿 藿 烯 類(ajoenes) 、 乙 烯 基 二 硫 雜 苯 類 (vinyldithiins) 和硫醚類 (sulfides) 等有機硫化合物, 導致活性大大降低, 影 響其藥理作 用 及 療效[10]。大 蒜 素 前 藥(蒜氨酸和蒜氨酸酶) 較穩定, 本實驗通過比較大蒜素及大蒜素前藥對食管癌 Eca9706 細胞的增殖抑制作用, 以及檢測 bcl-2、bax、 survivin、caspase-3和 p53 基因在轉錄水平的變化, 為探討大蒜素及其前藥誘導食管癌凋亡的分子機制及抗腫瘤治療提供可靠的依據。
1 儀器和實驗材料
Real Time PCR檢 測 系 統 (Applied Biosystems 7500 型, 美 國) ; 凝 膠 成 像 系 統 (Alpha Innotech Corporation TM-26 型, 美 國); 真 空 冷 凍 干 燥 機(Christ Alpha 1-2 LDplus型, 德 國); 倒 置 顯 微 鏡( 江 南 XD-101 型, 中 國) ; 酶 標 儀 (Feic Benchmark Plus型, 美 國 ); CO2細 胞 培 養 箱 (Heal Force HF240 型, 中國)。
新鮮大蒜 (本地購買), 人食管癌 Eca9706 株由鄭州大學基礎醫學院董子明教授饋贈,新疆生物資源基因工程重點實驗室保存。
蒜 氨 酸 (Sigma), 二 烯 丙 基 二 硫 化 物(DADS, 純 度 為 80%,Sigma) 。 RPMI1640 培 養基、 0.25%胰酶消化液、 二甲基甲砜 (DMSO)、四甲基硝唑藍 (MTT)、 胰酶和 10%胎牛血清 (鼎國昌盛生物技術有限責任公司); 青霉素和鏈霉素(ICN Biomedicals公 司)、 引 物 ( 上 海 生 工 生 物 技術有 限 公 司); Trizol RNA提 取 液 和 SYBR Green Supermix kit(Invitrogen, 上 海 普 飛 生 物 技 術 有 限公司); Tag DNA聚合酶、 DnaseⅠ、dNTP、 RNAse抑制劑 、 Oligo(dT)、 Reverse Transcriptase M-mLV (RNase H-) 和 DNA Marker(均為 大 連 TaKaRa公司產品);其它試劑均為分析純。
2 方法
2.1 大蒜素的制備 大蒜素提取方法參照曾哲靈[11]方法進 行, 得 到的大蒜素 冷 凍 干燥, 大 蒜 素干粉得率 為 2.41 g/kg。 大蒜素 測定參 照 DTNB比色法進行[12], 測得 大蒜素質量 濃 度 為0.3 μg/mL。稱取 大 蒜 素 干 粉 45 mg溶 于 5 mL RPMI1640 培 養液, 配 置 質 量 濃 度 為 9 mg/mL, 過 濾 除 菌, 置-20 ℃冰箱 保存。臨用前用 RPMI1640 培 養液分別稀釋至 5、 10、 15、 20、30 μg/mL。
2.2 大 蒜 素前藥的制 備 稱取新 鮮 去 皮 蒜 瓣200 g,4 ℃ 預 冷, 加 入 預 冷 的 磷 酸 緩 沖 液 200 mL (蒜瓣∶提取液 =1 ∶1,W/V), 勻漿。 勻漿液在4 ℃低溫 下 4 000 r/min 離 心 20 min, 棄 去 殘 渣,在上清液中加入硫酸銨, 使飽和度為20%,4 ℃下靜置 2 h,8 000 r/min 冷 凍 離 心 20 min, 棄 沉 淀 。上清液繼續加入硫酸銨, 使飽和度達到 50%, 在4 ℃ 下 靜 置過夜,4 ℃ 低 溫 下 8 000 r/min 冷凍離心20 min, 沉淀冷凍干燥得到蒜氨酸酶。 蒜氨酸酶活力的測定采用丙酮酸法[13]。 分離得到的蒜氨酸酶活力單位為 24 720 U/mg,SDS-PAGE檢測有一 條 主 要的蛋白 帶 (圖 1), 其 分 子質 量 大 小約 為54 kDa左右, 與已有的報道[14]分子質量大小一致。
將30 mg蒜 氨 酸 和 15 mg蒜 氨 酸 酶 混 合 溶 于5 mLRPMI1064 培 養液, 配置 成 9 mg/mL, 過 濾 除菌后置于 -20 ℃冰箱保存。 臨用時, 用 RPMI1640培養液分別稀釋至 5、 10、 15、 20、 30 μg/mL。
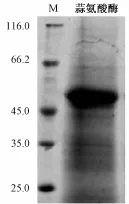
圖 1 蒜氨酸酶 SDS-PAGE電泳Fig.1 SDS-PAGE of alliinase
2.3 體外細胞毒試驗 (MTT法) 將對數生長期的食管癌細胞 Eca9706, 用 0.25%胰蛋白酶消化收集后, 進行細胞計數, 用新鮮的 RPMI1640 培養基稀釋 Eca9706 至 2 ×104個/m L,100 μL/孔接種于96 孔板, 置于 37 ℃,5%CO2的飽和濕度培養箱中培養, 培養 12 h 后, 加入 100 μL制備好的大蒜素、 大蒜素前藥 (5、 10、 15、 20、 30 μg/m L) 和4.8 μg/mL的陽性對照 DADS(DADS 用 DMSO配制成 0.5 mg/mL, 置 于 4 ℃ 保 存 。 臨 用 前 用 新 鮮RPMI1640 培養液稀釋至終質量濃度 4.8 μg/mL),陰性對照加入等體積的細胞培養液,空白對照組(無細胞) 加入等體積 PBS, 用于調零, 各組設 3個重復孔。 培養 24、48、 72 h 后, 棄 去 各 孔 培 養基, 每孔加入20 μL 5mg/mLMTT溶液和80 μL培養基, 繼續培養4 h。 棄去各孔殘液, 每孔加入二甲基亞砜 100 μL, 置 搖 床 上 低 速 振 蕩 30 min, 使結晶物充分溶解。 用 酶標儀檢測 490 nm波 長處測量各孔的吸光值 (A490)。
細胞生長抑制率 (%)=[(陰性對照組 A490-空白組 A490)-(實驗組 A490-空白組 A490)/(陰性對照組 A490-空白組 A490)] ×100%。
IC50的測定 測定方法同 MTT實驗, 根據不同質量濃度大蒜素及其前藥處理食管癌細胞不同時間的增殖抑制率,計算出達到最大抑制率一半時所對應的大蒜素及其前藥的質量濃度 (IC50)。
2.4 實時定量 RT-PCR檢測 分別收集經高、 中、低質量濃度 (10、 20、 40 μg/mL) 大蒜、 大蒜素前藥處理不同時間 (24、 48、 72 h) 的 Eca9706 細胞, 并用 PBS 清 洗 3 次, 加 入 1 mL Trizol。用 Trizol法提取 Eca9706 細胞的總 RNA, 進行 cDNA反轉錄,按試劑盒說明書進行。
實時定量 RT-PCR檢測采用 Sybrgreen 法, 每一個樣品同時進行 β-actin 和 survivin、 p53、 bcl-2、 bax、 caspase-3 基 因 的 檢 測。 總 反 應 體 系 為25.0 μL, 其 中 SYBR 熒 光 染 料 12.5 μL, 10 μmol/mL上下游引物 ( 表 1) 各 1 μL,cDNA (1 μg/mL) 模板 1.5 μL, 補 充 ddH2O 10 μL, 每一樣本設 3 個復孔。 95 ℃、 3 min 變性后, 共進行40 個 循 環 擴 增, 每 一 個 循 環 包 括 95 ℃ 、 10 s, 61 ℃、 50 s。 從 65 ℃ 到 95 ℃, 每隔 0.5 ℃ 保 持5 s, 記錄一次熒光 值, 獲 得 溶 解 曲 線。 所有 樣 品檢測均設置陰性對照 (無模板) 以排除假陽性。
相對定量的計算方法:mRNA表達量變化 = 2-ΔΔCt, 其中 ΔΔCt=(處理樣本目的基因 Ct-處理樣本內參基因 Ct)-(對照樣本目的基因 Ct-對照樣本內參基因 Ct)。

表1 不同基因的引物序列Tab.1 Prim er sequences of the differen t genes
2.5 統計學分析 每組實驗重復 3 次, 采用 Prism軟件對數據進行兩因素方差分析和顯著性檢驗;多組間參數采用單因素方差分析和多重比較。
3 結果與討論
3.1 大蒜素及其前藥對食管癌細胞的增殖抑制作用 以 4.8 μg/mL二烯丙基二硫化物 (DADS) 為對照,用不同質量濃度的大蒜素和大蒜素前藥處理Eca9706 細胞 24、 48 和 72 h,MTT比 色 法 測 定 細胞的增殖抑制率 (圖 2A,2B)。 大蒜素及其前藥處理24 和 48 h 均呈現出時間和劑量依賴性抑制食管癌細胞的增殖,而較高質量濃度的大蒜素及其前藥 (20、 30 μg/mL) 處 理 72 h 未 表 現 出 劑 量 依賴, 這是由于增殖抑制率已達到較高水平 (94%以上) 而滯長。 大蒜素及其前藥抑制 Eca9706 細胞增殖的最佳作用質量濃度為 20 μg/mL, 最佳作用時 間 為 48 h, 其 抑 制 率 分 別 達 到 94.5% 和 96.7%。 20 μg/mL大蒜素及其前藥作用食管癌的抑制率 (48 和 72 h) 與 4.8 μg/mL DADS 接 近 。大蒜素前 藥 處 理 Eca9706 細 胞 24 和 48 h 的 IC50均小于大蒜素 (表 2), 大蒜素前藥處理 24 h 的 IC50比大蒜素降低了 46%。 說明大蒜素前藥抑制食管癌細胞的效果優于大蒜素。
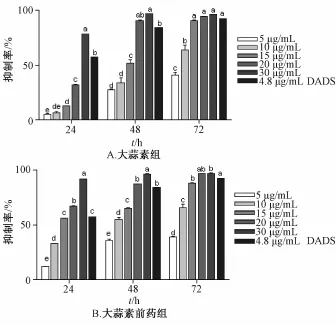
圖 2 大蒜素及其前藥對 Eca9706 細胞的抑制作用Fig.2 Inhibitory effect of allicin and its prodrug on Eca9706 cells

表 2 大 蒜素及 其 前 藥 作 用 (20 μg/m L) Eca9706 細 胞 不同時間的 IC50值Tab.2 IC50of allicin and its prodrug (20 μg/m L) on Eca 9706 cells at different tim es
3.2 大蒜素及其前藥對食管癌細胞 p53 基因表達的影響 p53 基因的突變和高表達是多種癌癥發生的重要因素, 突變型的 p53 通過上調 bcl-2 和下調bax基因表達, 阻止細胞色素 c從線粒體中的釋放,最終抑制癌細胞凋亡。本實驗結果顯示,低、中、 高質量濃度大蒜素及其前藥處理 Eca9706 細胞不同時間后,p53 表達量均顯著低于對照組 (表3)。 與對照組相比, 低、 中、 高質量濃度大蒜素及其前藥處理 72 h 后 p53 基因表 達 量 分別下降了24.2%、 56.3%、 82.6% 和 43.9%、 65.1%、73.9%, 呈現出劑量依賴性。大蒜素及其前藥能導致 Eca9706 細胞中的 p53 基因下調, 進而影響凋亡 相關基因的表達, 最終可引起食管癌細胞凋亡。
表 3 大蒜素及其前藥處理 Eca9706 細胞后 p53 基因轉錄水平的變化 ()Tab.3 Variety of p53 m RNA expression after Eca9706 cells treated w ith allicin and its prod rug ()
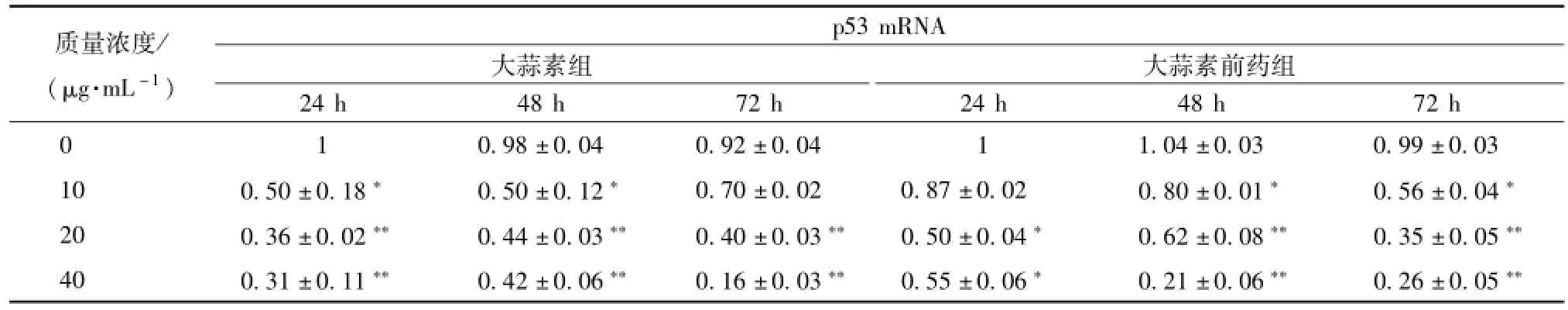
表 3 大蒜素及其前藥處理 Eca9706 細胞后 p53 基因轉錄水平的變化 ()Tab.3 Variety of p53 m RNA expression after Eca9706 cells treated w ith allicin and its prod rug ()
注: 與對照組比較,*P<0.05,**P<0.01
質量濃度/ (μg.m L-1) p53 mRNA大蒜素組大蒜素前藥組24 h 48 h 72 h 24 h 48 h 72 h 0 0.98 ±0.04 0.92 ±0.04 1 1.04 ±0.03 0.99 ±0.03 10 0.50 ±0.18* 0.50 ±0.12* 0.70 ±0.02 0.87 ±0.02 0.80 ±0.01* 0.56 ±0.04*20 0.36 ±0.02** 0.44 ±0.03** 0.40 ±0.03** 0.50 ±0.04* 0.62 ±0.08** 0.35 ±0.05**40 0.31 ±0.11** 0.42 ±0.06** 0.16 ±0.03** 0.55 ±0.06* 0.21 ±0.06** 0.26 ±0.05 1 **
3.3 大蒜素及其前藥對食管癌細胞 survivin 基因表達的影響 Survivin 是一種凋亡抑制基因, 過度表達使細胞失去了正常增生周期中凋亡 “開關”的限制,造成細胞增殖增加,凋亡減少,導致癌癥的發生。不同質量濃度的大蒜素及其前藥處理Eca9706 細胞不同時間,survivin 的表達量與對照組相比均有所下降 (表 4), 說明大蒜素及其前藥在轉錄水平上抑制了 Eca9706 細胞 survivin 的 mRNA表達,起到誘導癌細胞凋亡的作用。高質量濃度的大蒜素及其前藥 處理 72 h,survivin 表達量顯著降低,誘導癌細胞凋亡的作用較強,并且大蒜素前藥的效果優于大蒜素。
表 4 大蒜素及其前藥處理 Eca9706 細胞后 survivin基因轉錄水平的變化 ()Tab.4 Variety of survivin mRNA expression after Eca9706 cells treated with allicin and its prodrug ()
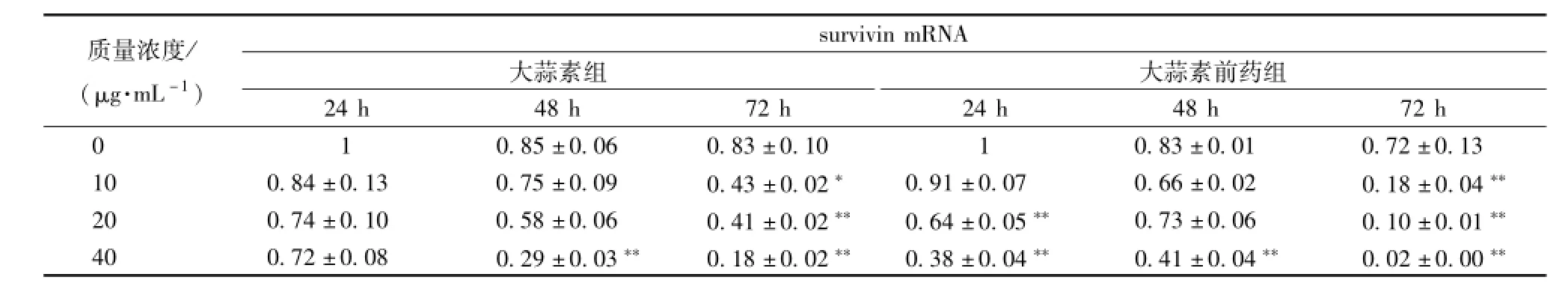
表 4 大蒜素及其前藥處理 Eca9706 細胞后 survivin基因轉錄水平的變化 ()Tab.4 Variety of survivin mRNA expression after Eca9706 cells treated with allicin and its prodrug ()
注: 與對照組比較,*P<0.05,**P<0.01
質量濃度/ (μg.m L-1) survivin mRNA大蒜素組大蒜素前藥組24 h 48 h 72 h 24 h 48 h 72 h 0 0.85 ±0.06 0.83 ±0.10 1 0.83 ±0.01 0.72 ±0.13 10 0.84 ±0.13 0.75 ±0.09 0.43 ±0.02* 0.91 ±0.07 0.66 ±0.02 0.18 ±0.04**20 0.74 ±0.10 0.58 ±0.06 0.41 ±0.02** 0.64 ±0.05** 0.73 ±0.06 0.10 ±0.01**40 0.72 ±0.08 0.29 ±0.03** 0.18 ±0.02** 0.38 ±0.04** 0.41 ±0.04** 0.02 ±0.00 1 **
3.4 大蒜素及其前藥對食管癌細胞 bcl-2 和 bax基因表達的影響 bcl-2 基因是一種原癌基因, 它具有抑制細胞凋亡的作用。與對照組相比,不同質量濃度的大蒜素及其前藥處理 Eca9706 細胞不同時間,bcl-2 基因表達均呈現下調 (表 5)。中、 高質量濃度的大蒜素及其前藥處理 24 和 72 h,bcl-2 基因表達下調較顯著, 說明它們能夠通過下調 bcl-2基因表達促進 Eca9706 細胞凋亡。 bax為誘導凋亡基因,bax基因的高表達促進細胞凋亡。與對照組相比, 不同質量濃度的大蒜素處理 24 h,bax基因上調表達極顯著 (表6), 前藥組呈現一定程度的上調, 處 理 48 和 72 h bax基 因 表 達 上 調 不 顯 著,有些處理還表現出一定程度的下降。
bcl-2 家族成員的構成比例是凋亡調控的關鍵因素, 其中 bcl-2/bax比率 是啟動細胞凋亡的 “ 分子開關”, 當 bcl-2/bax比率降低可誘導細胞凋亡。與對照組相比,不同質量濃度的大蒜素及其前藥處理 Eca9706 細胞不同時間,bcl-2/bax比率均下降(表7)。 低、 中、高質量濃度的大蒜素及其前藥處理 Eca9706 細 胞 24 h,bcl-2/bax比 率 下 降 顯 著,分別 比 對 照 下 降了 76%、 89%、 93% 和 61%、69%、 78%。 大蒜素及其前藥可能通過調控 bcl-2/bax比率誘導食管癌細胞凋亡。
表 5 大蒜素及其前藥處理 Eca9706 細胞后 bcl-2 基因轉錄水平的變化)Tab.5 Variety of bcl-2mRNA expression after Eca9706 cells treated with allicin and its prodrug ()
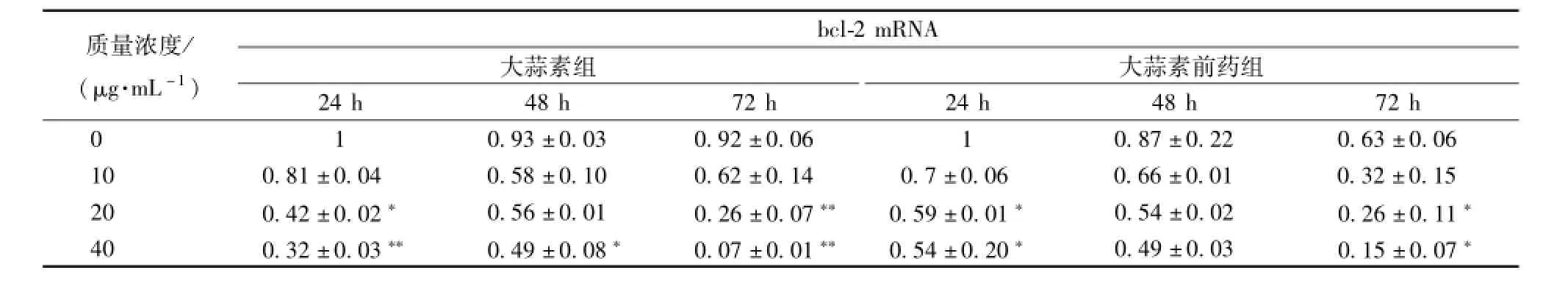
表 5 大蒜素及其前藥處理 Eca9706 細胞后 bcl-2 基因轉錄水平的變化)Tab.5 Variety of bcl-2mRNA expression after Eca9706 cells treated with allicin and its prodrug ()
注: 與對照組比較,*P<0.05,**P<0.01
質量濃度/ (μg.m L-1) bcl-2 mRNA大蒜素組大蒜素前藥組24 h 48 h 72 h 24 h 48 h 72 h 0 0.93 ±0.03 0.92 ±0.06 1 0.87 ±0.22 0.63 ±0.06 10 0.81 ±0.04 0.58 ±0.10 0.62 ±0.14 0.7 ±0.06 0.66 ±0.01 0.32 ±0.15 20 0.42 ±0.02* 0.56 ±0.01 0.26 ±0.07** 0.59 ±0.01* 0.54 ±0.02 0.26 ±0.11*40 0.32 ±0.03** 0.49 ±0.08* 0.07 ±0.01** 0.54 ±0.20* 0.49 ±0.03 0.15 ±0.07 1 *
表 6 大蒜素及其前藥處理 Eca9706 細胞后 bax 基因轉錄水平變化 ()Tab.6 Variety of bax m RNA expression after Eca9706 cells treated w ith allicin and its prod rug ()
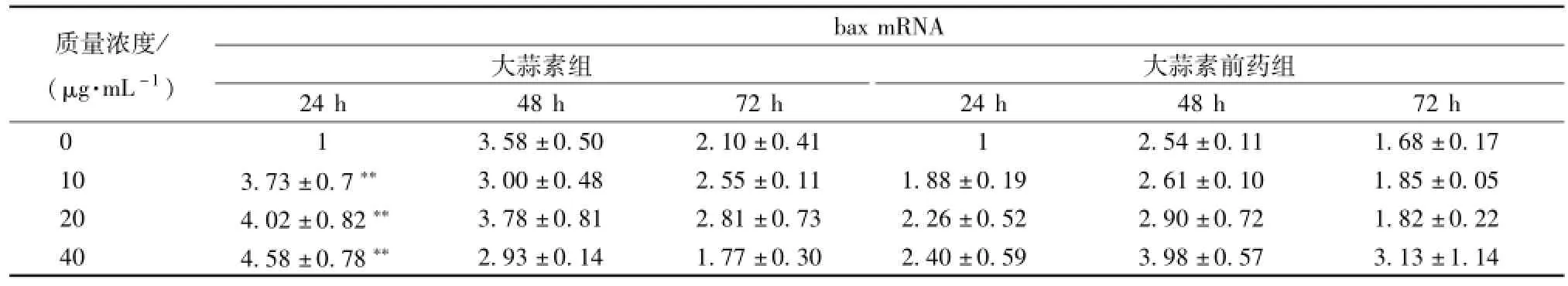
表 6 大蒜素及其前藥處理 Eca9706 細胞后 bax 基因轉錄水平變化 ()Tab.6 Variety of bax m RNA expression after Eca9706 cells treated w ith allicin and its prod rug ()
注: 與對照組比較,*P<0.05,**P<0.01
質量濃度/ (μg.mL-1) baxmRNA大蒜素組大蒜素前藥組24 h 48 h 72 h 24 h 48 h 72 h 0 3.58 ±0.50 2.10 ±0.41 1 2.54 ±0.11 1.68 ±0.17 10 3.73 ±0.7** 3.00 ±0.48 2.55 ±0.11 1.88 ±0.19 2.61 ±0.10 1.85 ±0.05 20 4.02 ±0.82** 3.78 ±0.81 2.81 ±0.73 2.26 ±0.52 2.90 ±0.72 1.82 ±0.22 40 4.58 ±0.78**1 2.93 ±0.14 1.77 ±0.30 2.40 ±0.59 3.98 ±0.57 3.13 ±1.14
表 7 大蒜素及其前藥處理 Eca9706 細胞后 bcl-2/bax 比率的變化 ())Tab.7 Variety of bcl-2/bax rate after Eca9706 cells treated w ith allicin and its prodrug (
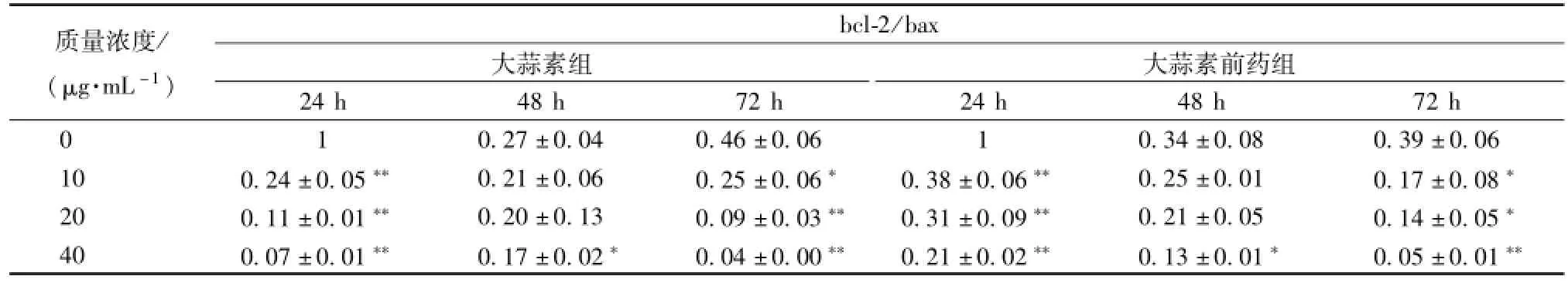
表 7 大蒜素及其前藥處理 Eca9706 細胞后 bcl-2/bax 比率的變化 ())Tab.7 Variety of bcl-2/bax rate after Eca9706 cells treated w ith allicin and its prodrug (
注: 與對照組比較,*P<0.05,**P<0.01
質量濃度/ (μg.m L-1) bcl-2/bax大蒜素組大蒜素前藥組24 h 48 h 72 h 24 h 48 h 72 h 0 0.27 ±0.04 0.46 ±0.06 1 0.34 ±0.08 0.39 ±0.06 10 0.24 ±0.05** 0.21 ±0.06 0.25 ±0.06* 0.38 ±0.06** 0.25 ±0.01 0.17 ±0.08*20 0.11 ±0.01** 0.20 ±0.13 0.09 ±0.03** 0.31 ±0.09** 0.21 ±0.05 0.14 ±0.05*40 0.07 ±0.01** 0.17 ±0.02* 0.04 ±0.00** 0.21 ±0.02** 0.13 ±0.01* 0.05 ±0.01 1 **
3.5 大蒜素前藥對食管癌細胞 caspase-3 基因表達的影響 半胱天冬酶 (caspase) 家族在介導細胞凋亡的過程中起著極其重要的作用,caspase-3 是caspase級聯 “瀑布” 下游凋亡程序的中心, 阻斷caspase-3 的激活是許多藥物發揮細胞保護作用的關鍵機 制 之 一[15-16]。 不 同 質 量 濃 度 的 大 蒜 素 及 其前藥處理 Eca9706 細胞不同時間后,caspase-3 表達均高于對照組 (表8), 并表現出劑量依賴性。中、高質量濃度的大蒜素及其 前藥處 理 24 和 48 h 時, caspase-3 表達量升高顯著 (P<0.05)。 大蒜素及其 前 藥 誘 導 caspase-3 高 表 達 的 質 量 濃 度 為40 μg/mL, 最佳時間為 48 h。 這 些 結果表明 大 蒜素及其前藥能夠通過上調 caspase-3 的表達, 激活下游凋亡程序,促進食管癌細胞凋亡。
表 8 大蒜素及其前藥處理 Eca9706 細胞后 caspase-3 基因轉錄水平的變化 ())Tab.8 Variety of caspase-3mRNA exp ression after Eca9706 cells treated with allicin and its prodrug (
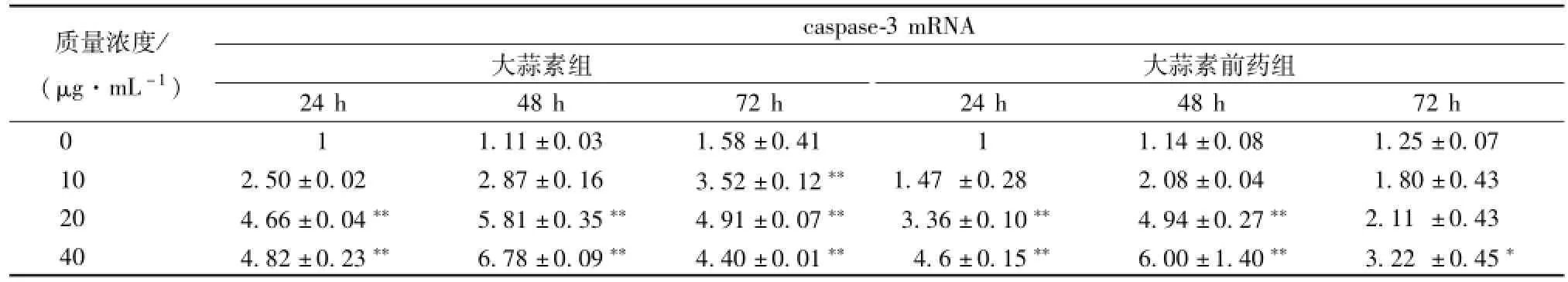
表 8 大蒜素及其前藥處理 Eca9706 細胞后 caspase-3 基因轉錄水平的變化 ())Tab.8 Variety of caspase-3mRNA exp ression after Eca9706 cells treated with allicin and its prodrug (
注: 與對照組比較,*P<0.05,**P<0.01
質量濃度/ (μg.mL-1) caspase-3 mRNA大蒜素組大蒜素前藥組24 h 48 h 72 h 24 h 48 h 72 h 0 1.11 ±0.03 1.58 ±0.41 1 1.14 ±0.08 1.25 ±0.07 10 2.50 ±0.02 2.87 ±0.16 3.52 ±0.12** 1.47 ±0.28 2.08 ±0.04 1.80 ±0.43 20 4.66 ±0.04** 5.81 ±0.35** 4.91 ±0.07** 3.36 ±0.10** 4.94 ±0.27** 2.11 ±0.43 40 4.82 ±0.23** 6.78 ±0.09** 4.40 ±0.01** 4.6 ±0.15** 6.00 ±1.40** 3.22 ±0.45 1 *
4 討論
細胞增殖的失控是腫瘤細胞的基本生物學特征之一,大量的研究表明大蒜素能夠抑制多種癌細胞的增殖,Oommen 等 人[17]的 研 究 表 明, 鼠 纖 維 肉瘤細胞 L-929、 人結腸癌細胞 SW480 和人宮頸癌細胞 HeLa隨著大蒜素的質量濃度增加存活率降低。大蒜素呈劑量依賴性抑制胃癌 SGC-7901 細胞, 高質量濃度 的 大 蒜 素 (0.1 mg/mL) 處 理 48 h 抑 制率達到 89%[4]。 本實驗也證實了大蒜素及其前藥顯著抑制食管癌細胞增殖,在大蒜素及其前藥質量濃度為 20 μg/mL, 處 理 時 間 為 48 h, 其 抑 制 率 分別達到 94.5%和 96.7%。 不同時間和劑量處理食管癌細胞均呈現出時間和劑量依賴型抑制癌細胞的增殖。 大蒜 素 前 藥 處 理食 管 癌 細胞 (24 和 48 h)的 IC50小于大蒜 素 ( 表 1), 說 明 前 藥抑制食 管 癌細胞的效果優于大蒜素,這可能與前藥相對于大蒜素較穩定有關。
腫瘤的發生是多基因參與的復雜過程,涉及多個癌基因和抑癌基因的激活與失活。大蒜素能夠誘導前列 腺 癌 LNCaP細 胞[18]、 小 鼠 黑 色 素 瘤 細 胞B16-F1[19]、 人胃 腺 癌 SGC-7901 細 胞 株[20]等 癌 細胞的凋亡。大蒜素誘導腫瘤細胞凋亡涉及到多種蛋白的作用, 包括 bcl-2 家族、 caspase家族、 p53 和survivin 等。 野生型的 p53 是一種抑癌基因, 在細胞增殖、 分化、 DNA修復、 細胞周期和凋亡中起重要的作用[21]。 p53 基因 突 變 失去 了 對 細胞 增 殖的抑制,而且出現類似癌基因蛋白類的促細胞惡性轉化的作用, 在多種腫瘤細胞中都發現 p53 基因的突變或缺失[22]。 癌 細 胞 中的突變 型 p53 通 過 上 調凋亡抑制基因 bcl-2, 下調凋亡促進基因 bax, 抑制癌細胞的凋亡。 survivin 基因是一個被野生型 p53基因抑制的基因, 由于癌細胞中 p53 基因的突變,喪失了對 survivin 基因轉錄的抑制作用, 從而促進suvivin 基 因 的 異 常 表 達[23-24]。 survivin 與 p53 在 喉癌組織中的表達呈顯著正相關[25]。 survivin 可 以抑制細胞凋亡的執行者 caspase-3 的活性, 阻斷各種刺激誘導的細胞 凋 亡 過 程[26]。 已 有 的 研 究 發 現 在喉癌和肝癌組織中 survivin 與 caspase-3 的表達呈明顯負相關[25,27]。許 多 研 究表明大 蒜 素 及大蒜中的有機硫化合物誘導多種癌細胞凋亡的機制,主要表現在能下調 p53、 bcl-2 表達, 上調 bax和 caspase-3基因表達,bax/bcl-2 基因表達比率上升, 最終導致癌細 胞 凋 亡[28-35]。 本 實 驗 結 果 證 實 了 大 蒜 素 及其前藥 能 夠 上 調 Eca9706 細 胞 中 bax和 caspase-3 mRNA表達, 下調 p53、 bcl-2 和 survivin mRNA表達。 大蒜素及其前藥誘導 Eca9706 細胞凋亡的機理可能是通過線粒體途徑實現, 首先突變型 p53 基因表達下調, 抑制 bcl-2 和促進 bax基因的表達; 其次突變型 p53 基因作為 survivin 的負調控因子下調其表達; 最終由于 survivin 基因表達的下調, 促進了 caspase-3 基因表達, 它們之間的協同作用導致食管癌細胞凋亡。
綜上所述,大蒜素及其前藥能通過調控凋亡相關基因,抑制食管癌細胞增殖,誘導食管癌細胞凋亡。大蒜素前藥比大蒜素穩定,有望成為控制腫瘤生長的天然理想藥物。
[ 1 ] Agarwal K C.Therapeutic actions of garlic constituents[ J]. Med Res Rev,1996,16(1):111-124.
[ 2 ] Iciek M,Kwiecien I,W lodek L.Biological properties of garlic and garlic-derived organosulfur compounds[ J] .Environ Mol Mutagen,2009,50(3):247-265.
[ 3 ] Davis S R.An overview of the antifungal properties of allicin and its breakdown products-the possibility of a safe and effective antifungal prophylactic[ J] .Mycoses,2005,48(2):95-100.
[ 4 ] Sun L,Wang X.Effects of allicin on both telomerase activity and apoptosis in gastric cancer SGC-7901 cells[ J] .World J Gastroenterol,2003,9(9):1930-1934.
[ 5 ] Jakubíkova J,Sedlak J.Garlic-derived organosulfides induce cytotoxicity,apoptosis,cell cycle arrest and oxidative stress in human colon carcinoma cell lines[ J] .Neoplasma,2006,53 (3):191-199.
[ 6 ] Sengupta A,Ghosh S,Bhattacharjee S.Allium vegetables in cancer prevention:an overview[ J] .Asian Pac J Cancer Prev, 2004,5(3)237-245.
[ 7 ] Arunkumar A,Vijayababu M R,Gunadharini N,etal.Induction of apoptosis and histone hyperacetylation by diallyl disulfide in prostate cancer cell line PC-3 [ J] .Cancer Lett,2007,251 (1)59-67.
[ 8 ] Wu X J,Kassie F,Mersch-Sundermann V.The role of reactive oxygen species(ROS)production on diallyl disulfide(DADS) induced apoptosis and cell cycle arrest inhuman A549 lung carcinoma cells[ J] .Mutat Res,2005,579(1/2):115-124.
[ 9 ] Shao S L,Zhang W W,Li F Y.Apoptosis of human gastric cancer cell Line SGC-7901 induced by allicin.In:Advanced Materials Research[ M] .Switzerland:Trans Tech Publication, 2012,(343-344):1285-1289.
[10 ] Fujisawa H,Suma K,OriguchiK,etal.Biological and chemical stability of garlic-derived allicin [ J].Agric Food Chem, 2008,56(11):4229-4235.
[11] 曾哲靈, 熊 偉, 熊 濤, 等.大蒜素的提取工藝研究[J].食品與發酵工業,2006,32(2):121-123.
[12 ] Han J,Lawson L,Han G,et al.A spectrophotometric method for quantitative determination of allicin and total garlic thiosulfinates[J] .Anal Biochem,1995,225(1):157-160.
[13] 王秀奇, 秦淑媛, 高天慧, 等.基礎生物化學實驗[M].北京: 高等教育出版社,2003:219-222.
[14 ] Kuettner B E,Hilgenfeld R,Weiss M S.Purification,characterization,and crystallization of alliinase from garlic[ J] .Arch Biochem Biophys,2002,402(2):192-200.
[15 ] Hengartner M O.The biochemistry of apoptosis[ J] .Nature, 2000,407(6805):770-776.
[16 ] Leist M,Jaattela M.Four deaths and a funeral:from caspases to alternativemechanisms[J] .Nat Rev Mol Cell Biol,2001,2 (8):589-598.
[17 ] Oommen S,Anto R J,Srinivas G,et al.Allicin(from garlic) induces caspase-mediated apoptosis in cancer cells[ J] .Eur J Pharmacol,2004,485(1-3):97-103.
[18 ] Gunadharin D N,Arunkumar A,Krishnamoorthy G et al.Antiproliferative effectof diallyl disulfide(DADS)on prostate cancer cell line LNCaP[ J] .Cell Biochem Funct,2006,24(5): 407-412.
[19] 陳思遠, 黃長征, 錢 悅, 等.大蒜素對小鼠黑素瘤細胞B16-F1 增殖 和 凋 亡 的 影 響 [ J].中 華 皮 膚 性 病 學 雜 志, 2006,20(1):13-15.
[20 ] Sharpe J C,Arnoult D,Youle R J.Control of mitochondrial permeability by Bcl-2 family members[ J] .Biochim Biophys Acta,2004,1644(2/3):107-113.
[21] Wu X,Deng Y.Bax and BH3-domain-only proteins in p53-mediated apoptosis[ J].Front Biosci,2002,7(1):151-156.
[22] Ikawa S,Nakagawara A,Ikawa Y.p53 family genes:structural comparison,expression and mutation [ J].Cell Death Differ, 1999,6(12):1154-1161.
[23] Wang Z,Fukuda S,Pelus L M.Survivin regulates the p53 tumor suppressor gene family[ J] .Oncogene,2004,23(49): 8146-8153.
[24] Okada H,Bakal C,Shahinian A,et al.Survivin loss in thymocytes triggers p53-mediated growth arrest and p53-independent cell death[J] .Exp Med,2004,199(3):399-410.
[25] 謝 洪, 張寶泉.Survivin 在喉鱗狀細胞癌組織中的表達及與 caspase-3、 P53 相關性的初步研究[ J].中國現代醫學雜志,2007,17(12):1460-1463.
[26] Lakhani SA,Masud A,Kuida K,et al.Caspases3 and 7:key mediators of mitochondrial events of apoptosis[ J] .Science, 2006,311(5762):847-851.
[27] 佘曉玲, 馮德云, 鄭 暉, 等.Survivin 和 Caspase-3 在肝細胞癌中表達的相關性及其生物學意義[J].中國現代醫學雜志,2005,15(18):2750-2753.
[28] Wang Z,Liu Z,Cao Z.Allicin induces apoptosis in EL-4 cells in vitro by activation ofexpression of caspase-3 and-12 and upregulation of the ratio of Bax/Bcl-2 [ J].Nat Prod Res,2011, 26(11):1033-1037.
[29] Lu H F,Sue CC,Yu CS,etal.Diallyl disulfide(DADS)induced apoptosis undergo caspase-3 activity in human bladder cancer T24 cells[ J] .Food Chem Toxicol,2004,42(10): 1543-1552.
[30] Sriram N,Kalayarasan S,Ashokkumar P,etal.Diallyl sulfide induces apoptosis in Colo320 DM human colon cancer cells:involvement of caspase-3,NF-κB,and ERK-2[ J] .Mol Cell Biochem,2008,311(1-2):157-165.
[31] 王旭平, 趙 玲, 王 容, 等.大蒜素對人結腸癌 HT29細胞增殖影響及作用機制研究[J] 中國現代普通外科進展,2007,10(4):306-309.
[32] Xiao D,Choi S,Johnson D E,et al.Diallyl trisulfide-induced apoptosis in human prostate cancer cells involves c-Jun N-terminal kinase and extracellular-signal regulated kinase-mediated phosphorylation of Bcl-2[ J] .Oncogene,2004,23(33):5594-5606.
[33] Karmakar S,Banik N L,Patel SJ,et al.Garlic compounds induced calpain and intrinsic caspase cascade for apoptosis in human malignant neuroblastoma SH-SY5Y cells[ J] .Apoptosis, 2007,12(4):671-684.
[34] Chu Y L,Ho C T,Chung JG,et al.Allicin induces p53-mediated autophagy in Hep G2 human liver cancer cells[ J].J Agric Food Chem,2012,60(34):8363-8371.
[35] Cha JH,Choi Y J,Cha SH.et al.Allicin inhibits cell growth and induces apoptosis in U87MG human glioblastoma cells through an ERK-dependent pathway[ J] .Oncol Rep,2012,28 (1):41-48.
A llicin and its prodrug inhibit proliferation and apoptosis gene expression in human esophageal cancer Eca9706 cells
CHANG Quan-e, GOU Ping*
(College of Life Scienceand Technology,Xinjiang University,Urumuqi830046,China)
AIM To study the inhibitory effect of allicin and its prodrug(alliin+alliinase)on proliferation and apoptosis gene expression of human esophageal cancer Eca 9706 cells.METHODS The proliferation inhibition and apoptotic gene expression of esophageal cancer cells treated with allicin and its prodrug were assayed by MTT and real-time quantitative RT-PCR,respectively.RESULTS Allicin and its prodrug inhibited cancer cells proliferation in a dose-and time-dependentmanner,and the inhibitory effectof the latterwas better than thatof the former.Real-time RT-PCR showed that allicin and its prodrug upregulatedmRNA expression of bax and caspase-3 genes of esophageal cancer cells,and downregulated mRNA expression of survivin,mutant p53,and bcl-2 genes. CONCLUSION The inhibition of cancer cells'proliferation and induction of apoptosis caused by allicin and its prodrug may be related to the mitochondrial pathway.
allicin; allicin prodrug; human esophageal cancer cells;proliferation; apoptosis
R966
:A
:1001-1528(2014)06-1117-08
10.3969/j.issn.1001-1528.2014.06.002
2013-06-12
新疆自治區高校科研計劃 (XJEDU2010I13)
常全娥 (1987—), 女, 碩士, 研究方向: 生物化學。 E-mail:cqe1987@163.com
*通信作者: 茍 萍 (1955—), 女, 教授, 研究方向: 生物化學。 E-mail:gou-ping@sina.com.cn

