姜黃素誘導骨髓間充質干細胞分化成肝細胞
陳 艷, 鄒文靜, 王盛豐, 喬洪翔
(1.浙江工業大學藥學院, 浙江 杭州 310014; 2.浙江康恩貝制藥股份有限公司, 浙江 杭州 310052)
姜黃素誘導骨髓間充質干細胞分化成肝細胞
陳 艷1, 鄒文靜1, 王盛豐1, 喬洪翔2
(1.浙江工業大學藥學院, 浙江 杭州 310014; 2.浙江康恩貝制藥股份有限公司, 浙江 杭州 310052)
目的 研究姜黃素誘導大鼠骨髓間充質干細胞分化為肝細胞的作用。方法 貼壁篩選法體外培養骨髓間充質干細胞, 流式細 胞 儀檢測其 表 面抗原。 分組誘導 培 養 14 d:1 組 (空白對照 組),2 組 (10 ng/mL成 纖 維 細 胞生 長 因 子-4,FGF-4),3 組 (10 ng/mL FGF-4+20 ng/mL肝 細胞生長 因 子,HGF),4 組 (10 ng/mL FGF-4+5 μmol/L姜 黃素), 5 組 (20 μmol/L姜黃素) 。 觀察細胞形態學改變; 利用 western-blotting分析肝特異性蛋白 HNF-3β的表達。 結果 大鼠骨髓間充質干細胞細胞表面抗原 CD34、 CD14、 CD45 陰性表達,CD44、 CD73、 CD90 表達陽性; 藥物誘導后光鏡下觀察到骨髓間充質干細胞細胞由梭形漸變成圓形肝細胞; 誘導分化后的細胞表達肝特異性蛋白 HNF-3β。 結論 姜黃素具有促進骨髓間充質干細胞分化為肝細胞的作用。
分化;肝細胞;大鼠骨髓間充質干細胞;姜黃素
姜 黃 Curcuma longa L.是 一 種 常 用 的 中 藥,具有 活 血、 化 瘀、 行 氣、 通 經、 止 痛 等 功 效[1],而姜黃素 (curcumin) 是從姜黃的根莖中提取的一種二苯基庚烴類成分 (如圖 1 所示), 含有量約占姜黃的 3% ~5%[2]。 研 究 證 明[3], 姜 黃 素 能 有 效促進大鼠骨髓間充質干細胞 (rat bonemesenchymal stem cells,rBMSCs) 早期成骨分化, 且能抑制肝星狀細胞 (HSC) 增殖、誘導 HSC凋亡, 使膠原合成減少,減輕肝纖維化大鼠肝內膠原的沉積,從多方面抑制肝纖維化的發生、 發展[4]。 為了進一步了解姜黃素誘導 rBMSCs分化的特點, 本實驗以姜黃素為研究對象,以分化為指標,觀察其對大鼠間充質干細胞分化為類肝細胞的影響。
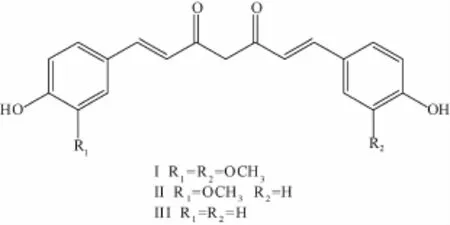
圖1 姜黃素化學結構Fig.1 Chem ical structure of curcum in
1 材料
1.1 藥物 與 試 劑 胎 牛 血 清 (Hyclone),DMEM高、 低 糖 培 養 基 (Gibco); PerPC 標 記 抗 大 鼠CD14、 CD44、 CD34、 CD90、 CD73、 CD45(Santa Cruz); PE標 記 抗 小 鼠 IgG(Katara) ; PerPC標 記抗小 鼠 IgG(Santa Cruz); FITC標 記 抗 小 鼠 IgG (Santa Cruz); 胰 島 素 ( 江 蘇 萬 邦 生 化 醫 藥 股 份 有限); 轉化 生 長 因 子 β1(RB); ITS+(Sigma);地 塞 米 松 (Sigma); FGF-4(peprotech); HGF (peprotech); 山 羊 抗 大 鼠 HNF-3β 一 抗 (Santa cruz); 兔抗山羊 IgG二抗 (Santa cruz); 兔抗大鼠β-actin 一抗 (Santa cruz);羊抗兔 IgG二抗 (博士德)姜黃素標準品購自中國藥品生物制品檢定所,編號 07372200173。
1.2 儀 器 流 式 細 胞 儀 (BD Biosciences) ;CO2細胞 培 養 箱 (Galaxy);Nikon 光 學 倒 置 顯 微 鏡(Nikon); 電 泳 儀 (Tanon); 日 立 高 速 離 心 機CR21G(日立工機株式會社); 紫外分光光度計UV2550(日本島津株式會社)。
1.3 動物 4 ~6 周齡雄性清潔級 SD大鼠 3 只,體質量 100 ~120 g, 購于浙江省醫學科學院, 許可證 SCXK(浙)2008-0233。
2 實驗方法
2.1 rBMSCs的分離與培養 脫頸法處死大鼠,取出股骨和脛骨置裝有 D-Hanks液的燒杯中; 用含血清培養基反復沖洗骨髓腔,收集骨髓細胞懸液, 200 目 篩 網過濾,1 500 r/min 離 心 3 min 后 混 懸 細胞, 接種到培養皿中, 置于 CO2培養箱中培養;接種后第 24 小時和第 48 小 時全量 換液, 后每 3 d全量換液一次, 至細胞 70% ~80%融合時, 進行傳代培養。
2.2 流式細胞術檢查 rBMSCs表面抗原 將生長狀態良好的第三代細胞按 1 ×105個/管的密度平均分到 1.5 mL離心管 中,1 000 r/min 離 心 5 min 后,棄去上清, 加入 D-Hanks液 100 μL重懸細胞; 分別向 各 管 細 胞 中 加 入 PerPC標 記 抗 大 鼠 CD14、FITC標記 抗 大 鼠 CD34、 FITC標 記 抗 大 鼠 CD44、PE標記抗大鼠 CD90、PE標記抗大鼠 CD73、 PE標記抗大鼠 CD45、 FITC標記抗小鼠 IgG、 PE標記抗小鼠 IgG、 PerPC標記抗小鼠 IgG, 以及 D-Hanks液 (陰性對 照管), 常溫 避 光 45 min, 用 D-Hanks液洗細胞3次后,進行流式細胞術檢測,以判斷rBMSCs的均一度。
2.3 姜黃素誘導 rBMSCs分化為肝細胞的實驗
將生長狀態良好的第三代細胞細胞懸液以 2 ×104細胞/mL接種于 6 孔板中; 待細胞完全融合生長時,棄去培養基,分成5組進行誘導分化,1組(空白對照組): 僅更換 DMEM低糖培養基; 2 組(單細胞 因 子 組):10 ng/mL FGF-4 誘 導 48 h 后,更換 DMEM低糖培養基;3 組 (聯合誘導組): 10 ng/mL FGF-4+5 μmol/L姜 黃 素 誘 導 48 h 后,更換 DMEM低糖培養基; 4 組 (雙細胞因子組): 10 ng/mL FGF-4+20 ng/mL HGF誘 導 48 h 后, 更換 DMEM 低 糖 培 養 基; 5 組 (姜 黃 素 組) 20 μmol/L姜黃素 誘 導 48 h 后, 更換 DMEM低糖培養基; 每3 d換液 一 次, 誘導14 d后 對 分化細胞進行鑒定。
2.4 細胞形態學觀察 每日于倒置顯微鏡下觀察細胞分化前后的形態學改變。
2.5 Western blotting法測定肝特異性蛋白 HNF-3β的表達 細胞誘導14 d后, 將蛋白裂解液加入收集到的細胞中; 每隔 5min 劇烈震蕩1min, 重復6 次,再將樣品 4 ℃ 12 000 r/min 離 心 30 min。 吸取 上 清細胞蛋白溶液, 采用 Coomassie Brilliant Blue法 進 行蛋白定量,將所有蛋白樣品調至等濃度,充分混合后加 loading buffer后 上 樣。 將 蛋 白 樣 品 在 15% 的SDS-PAGE凝膠中電泳約 3 h, 然后轉印至 PVDF膜上,5%脫脂 奶 粉 封 閉 2 h 后, 加 入 HNF-3β一 抗(1 ∶1 000) 過夜。 TTBS 洗 3 次后加入辣根過氧化物酶標記的二抗 (1 ∶1 000) 作用30 min,ECL法顯色、X光膠片顯影定影后分析處理。
3 結果
3.1 流式細胞儀檢測結果 流式結果顯示, 分離培養 得 到 的 細 胞 能 高 表 達 rBMSCs的 表 面 抗 原CD44、 CD73 以及 CD90, 但不能夠表達造血系細胞的表面抗原 CD14、 CD34 以及 CD45, 表明我們分離培養獲得較為均一的 rBMSCs。 具體流式結果見圖2所示。
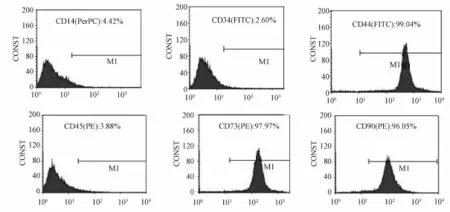
圖 2 rBMSCs表面抗原表達情況Fig.2 Analysis phenotype of the rBMSCs by flow cytometry
3.2 分化的細胞形態學的改變 每日光鏡觀察顯示, 細胞自分化后第 3 天起, 梭形的 rBMSCs形態逐漸發生改變,有向圓形細胞變化的趨勢;到第14天前后, 大部分細胞呈類似肝細胞樣的圓形,而空白對照組的細胞形態無改變。如圖3所示。
3.3 Western-blotting檢測細胞內 HNF-3β蛋白表達水平 從 western blotting圖可以看出, 在誘導的第14天, 單細胞因子、 雙因子以及姜黃素組都可以直接誘導 rBMSCs分化為肝細胞, 姜黃素聯合FGF-4 組 HNF-3β的表達量高于單細胞因子 FGF-4組; 而 20 μmol/L的姜黃素組對 rBMSCs具有單獨誘導分化的作用。如圖4所示。
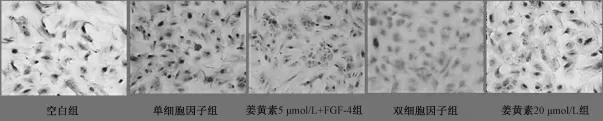
圖 3 rBM SCs分 化成肝細 胞 的形態學 變 化Fig.3 M orphology of MSCs at different culture times
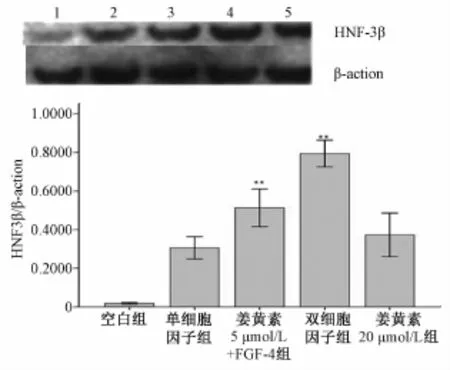
圖 4 分化的細胞表達肝特異性蛋白 (HNF-3β)Fig.4 Protein expression of HNF-3βin MSCs after differentiation
4 討論
肝纖維化是多種慢性肝病的終末期病理表現[5], 目前臨床 對 其 治 療 多 采 用 綜 合 療 法, 但 并未從根本上改變該病的預后。近年來有不少文獻報道[6], 骨髓 間 充 質干 細 胞 (BMSCs) 可 以 分化 為肝細胞,改善肝功能,從而為終末期肝臟疾病患者帶來希望。 與此同時, 中醫藥在 BMSCs增殖分化影響上的研究亦 有 不 少 突 破[7]。本 實 驗 通過 觀 察姜黃素聯合細胞生長因子 FGF-4 對 rBMSCs的肝向細胞誘導分化的作用效果,為從中藥中尋找適宜的誘導分化劑提供思路。
從臨床應用角度來講, 向培養的 BMSCs中加入相應的誘導因子 (如 FGF-4、bFGF、 血管內皮生長因子等)或者化學藥物是最有前途的體外誘導方案[8]。 FGF-4 是 一 種 內 胚 層 的 形 態 誘 導 發 生素, 在內 胚 層 的 起 源 和 分 化 中 發 揮 重 要 作 用[9]。然而,FGF-4 雖能啟動 MSCs向肝細胞的分化, 但由于其不是有效的分化劑,使得最后的分化效率非常低。 因此, 必須尋找能協同 FGF-4 進行有效分化的物質。肝細胞生長因子 (HGF) 是目前國際上采用細胞誘導分化的方法中都涉及到的關鍵因子, 其可以單獨誘導 BMSCs分化為肝 細胞[10]; 也可以聯合 FGF-4, 以提高分化的 效率[11]。 鑒于此,本研究中將 FGF-4+HGF作為陽性對照組, 單獨FGF-4 誘導組為陰性組。 但是,HGF因其存在促進腫瘤細胞的生長,侵襲及轉移等效應,故存在很多不確 定 性 和 潛 在 的 危 險 性[12-13]。 因 此, 本 研 究 的目的即要從中藥中找到一種無毒的誘導分化劑來代替 HGF。 實驗結果證明, 采用聯合生長因子 FGF-4及低劑量的姜黃素 (5 μmol/L) 的誘導模式成功的將 rBMSCs誘 導 分 化 為 肝 細 胞,Western blotting法檢測發現, 誘導后細胞肝臟蛋白 HNF-3β特異表達,HNF3β的表達在肝臟的發育和肝干細胞的分化中 具 有 重 要 作 用[14-15]。 在 此 基 礎 上, 實 驗 進 一步考察了姜黃素單獨誘導 rBMSCs的肝向分化作用。 結果顯示姜黃素在 20 μmol/L具有單獨誘導rBMSCs分化為肝細胞的作用, 而在 20 μmol/L以上則不具有更強的誘導能力,且具有潛在的毒性。
綜上所述,20 μmol/L姜黃素能單獨誘導 rBMSCs分化為肝細胞, 與 FGF-4 聯合應用可使姜黃素的誘導濃度降低,不僅效果更好,且安全性更可靠。
參考文獻:
[1] 趙秀玲.姜黃的化學成分、 藥理作用及其資源開發的研究進展 [ J] .中國 調味 品,2012,37(5):9-13.
[ 2 ] 涂永元, 徐 先祥, 邱 飛.姜黃 素 前 藥的研 究 進 展 [J].有機化學,2012,32(5):852-859.
[3] 顧巧麗,蔡 燕,黃 晨,等.姜黃素調控大鼠骨髓間充質干細胞的成骨分化[J].中國組織工程研究,2012,16 (27):5057-5061.
[4] 李志強, 曹文富.姜黃素防治肝纖維化作用機制的研究進展[ J].重慶醫學,2012,41(10):1024-1026.
[ 5 ] 陸倫根, 胡俊杰.肝纖維化研究進展[J].肝臟,2012,17 (9):617-620.
[ 6 ] Ayatollahi M,Soleimani M,Tabei S Z,et al.Hepatogenic differentiation ofmesenchymal stem cells induced by insulin like growth factor-I[ J] .World J Stem Cells,2011,3(12): 113-121.
[7] 龔圓淵, 張力華.中藥對骨髓間充質干細胞多向分化影響的研究進展[J].河南中醫,2012,32(2):252-254.
[ 8 ] Chivu M,Dima SO,S tancu C I,et al.In vitro hepatic differentiation of human bonemarrow mesenchymal stem cells under differential exposure to liver-specific factors[ J] .Transl Res,2009,154(3):122-132.
[ 9 ] Lee K D,Kuo T K,Whang-Peng J,etal.In vitro hepatic differentiation of human mesenchymal stem cells[ J] .Hepatology, 2004,40(6):1275-1284.
[10] Oh S H,Miyazaki M,Kouchi H,et al.Hepatocyte growth factor induces differentiation ofadult rat bonemarrow cells into a hepatocyte lineage in vitro[ J].Biochem Biophys Res Commun, 2000,279(2):500-504.
[11] Schwartz R E,Reyes M,Koodie L,et al.Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells[ J] .Clin Invest,2002,109(10): 1291-1302.
[12] Trusolino L,Comoglio PM.Scatter-factor and semaphorin receptors:cell signalling for invasive growth[ J] .Nat Rev Cancer,2002,2(4):289-300.
[13] Hillan K J,Logan M C,Ferrier R K,etal.Hepatocyte proliferation and serum hepatocyte growth factor levels in patientswith alcoholic hepatitis[ J] .JHepatol,1996,24(4):385-390.
[14] Kinoshita T,Miyajima A.Cytokine regulation of liver development[ J] .Biochim Biophys Acta,2002,1592(3):303-312.
[15] Silvia C.Liver-enriched transcription factors and hepatocyte differentiation[ J] .FASEB J,1996,10(2):267-282.
Curcum in induces the differentiation of bone m arrow m esenchym al stem cells into hepatocytes
CHEN Yan1, ZOUWen-jin1, WANG Shen-feng1, QIAO Hong-xiang2
(1.College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China; 2.Zhejiang Conba Pharmaceutical Co.,Ltd., Hangzhou 310052,China)
AIM To investigate whether curcumin can induce differentiation of rat bone mesenchymal stem cells(rBMSCs)into hepatocytes in vitro.MWTHODS rBMSCswere isolated from adult SD rats,and then were cultured and cloned by density gradientmethod and adhesive cultivation.Their cell surface antigens were detected with flow cytometer.rBMSCs obtained were randomly assigned to five groups:group 1(control),group 2(induced by 10 ng/mL FGF-4),group 3(induced by 10 ng/mL FGF-4 combined with 5 μmol/L curcumin),group 4(induced by 10 ng/mL FGF-4 combined with 20 ng/mL HGF),and group 5(induced by 20 μmol/L curcumin).After induction,hepatocytes cell percentage was determined,and the expression of specific proteins of HNF-3βwas analyzed.RESULTS CD44,CD73 and CD90 expression of rBMSCs was positive while that of CD34,CD14 and CD45 was negative,indicating the successful culture of rBMSCs.After induction with curcumin,rBMSCs showedmorphological variation.The expression levels of HNF-3 βin group 2,3,and 4 were significantly higher than those in the group 1.CONCLUSION Curcumin can induce rBMSCs to differentiate into hepatocytes cells in vitro.
differentiation; hepatocytes; rBMSCs;curcumin
R285.5
:A
:1001-1528(2014)06-1124-05
10.3969/j.issn.1001-1528.2014.06.003
2013-04-12
浙江省自然科學基金資助 (Y2111178); 浙江省科技廳重大專項基金資助 (2010C13015)
陳 艷 (1977—), 女, 博士, 副教授, 研究方向: 中藥藥理。 Tel:15888851620,E-mail:chenyan2008@zjut.edu.cn

