中鏈脂肪酸對THP-1巨噬細胞源性泡沫細胞膽固醇流出的影響
張新勝,楊雪艷,王 覲,張 永,劉英華,徐 慶,于曉明,劉 釗,薛長勇
解放軍總醫院 營養科,北京 100853
中鏈脂肪酸對THP-1巨噬細胞源性泡沫細胞膽固醇流出的影響
張新勝,楊雪艷,王 覲,張 永,劉英華,徐 慶,于曉明,劉 釗,薛長勇
解放軍總醫院 營養科,北京 100853
目的觀察中鏈脂肪酸對THP-1巨噬細胞源性泡沫細胞膽固醇流出的影響。方法采用WST-1試劑檢測200 μmmol/ L濃度的不同脂肪酸:辛酸(C8∶0)、癸酸(C10∶0)、豆蔻酸(C14∶0)、棕櫚酸(C16∶0)、硬脂酸(C18∶0)、油酸(C18∶1)、亞油酸(C18∶2)、α-亞麻酸(C18∶3)對THP-1細胞活性的影響;建立ApoA1介導的膽固醇流出細胞模型;不同濃度脂肪酸(0 μmmol/L、100 μmmol/L、200 μmmol/L)干預富集3H-膽固醇的THP-1巨噬細胞源性泡沫細胞24 h后,用液體閃爍計數儀檢測并計算膽固醇的流出率。結果不同脂肪酸在200 μmmol/L濃度時,對THP-1細胞無細胞毒性作用(P>0.05);與空白組比較,ApoA1介導的細胞膽固醇流出明顯增加(P<0.05);隨著脂肪酸濃度的增加,C8∶0、C18∶0、C18∶1和C18∶3脂肪酸對細胞膽固醇流出影響差異有統計學意義(P<0.05);在200 μmmol/L濃度時,C8∶0和C18∶3脂肪酸與對照組比較更能促進細胞膽固醇的流出(P<0.05),且C8∶0脂肪酸對促進膽固醇流出的影響明顯高于C10∶0、C14∶0、C16∶0、C18∶0、C18∶1、C18∶2脂肪酸(P<0.05)。結論中鏈脂肪酸C8∶0能夠促進THP-1巨噬細胞源性泡沫細胞膽固醇的流出,且在200μmmol/L濃度時明顯優于其他脂肪酸。
中鏈脂肪酸;脂肪酸;巨噬細胞;膽固醇流出
材料和方法
1 細胞及材料 THP-1細胞株由北京協和醫科大學細胞庫提供;RPMI-1640培養基(改良型)、胎牛血清(fetal bovine serum,FBS)均購自Gibco公司;佛波酯(phorbol 12-myristate 13-acetate,PMA)、載脂蛋白A1(apolipoprotein,ApoA1)、牛血清白蛋白(bovine serum albumin,BSA)均購自Sigma公司;低密度脂蛋白(low density lipoprotein,LDL)購自上海生工生物工程有限公司;3H-膽固醇購自Perkin Elmer公司;6孔板、24孔板、96孔板及培養瓶購自Corning公司;WST-1細胞增殖及細胞毒性檢測試劑盒購自凱基生物公司;C8∶0、C10∶0、C14∶0、C16∶0、C18∶0、C18∶1、C18∶2、C18∶3脂肪酸均購自Sigma公司。
2 低密度脂蛋白的氧化修飾 用PBS將LDL終濃度調整為1.5 g/L,加入CuSO4,LDL終濃度為10 μm/L,置于37℃條件下充分氧化24 h后,裝入透析袋,用含200 μm/L乙二胺四乙酸的PBS液中透析48 h,過濾除菌,BCA法定量蛋白質,用PBS調整蛋白質濃度為1 g/L,4℃保存備用。
3 細胞培養 THP-1細胞分別用含有10%胎牛血清DMEM培養液、RPMI-1640培養液,于37℃、5% CO2培養箱中靜置培養。培養液中加入青霉素100 U/ml、鏈霉素100 g/ml。細胞離心換液后用培養液將細胞計數調整到4×105~ 8×105/ml(用計數板計量:細胞數/ml=100小格內細胞個數/100×400×10 000×稀釋倍數),準備用于下一步實驗。
4 干預脂肪酸的配制 稱量各種脂肪酸,用95%乙醇溶液配制成20 mmol/L的脂肪酸,再用無血清培養液(含20 mg/ml BSA)分別稀釋成2 mmol/L、1 mmol/L濃度脂肪酸干預物備用,干預脂肪酸加入培養孔內最終濃度為200 μmmol/L、100 μmmol/L。
5 細胞活性的測定 按照WST-1細胞增殖及細胞毒性檢測試劑盒步驟,將培養好的THP-1細胞(細胞計數達到4×105~ 8×105/ml),接種于96孔板置37℃,5% CO2細胞培養箱12 h,隨機分為18組(n=6),包括空白組(無細胞+100 μl培養液)、細胞空白組(100 μl培養液)、200 μmmol/L及100 μmmol/L濃度下8種脂肪酸干預組(C8∶0、C10∶0、C14∶0、C16∶0、C18∶0、C18∶1、C18∶2、C18∶3)。37℃下孵育2 h。酶標儀(波長450 nm)檢測每孔吸光度。每組吸光度值減去空白組吸光度值得到各組實際吸光度值。細胞存活率=(干預物組實際吸光度值/對照組實際吸光度值)×100%。
6 油紅O染色 在加有蓋玻片的6孔板中,加入THP-1細胞,PMA誘導分化成泡沫細胞,吸掉培養液,PBS清洗3次后,50%異丙醇固定1 min,油紅染色10 min,水性封片劑封片,顯微鏡下觀察泡沫細胞形態。
7 膽固醇流出細胞模型的建立 將培養好的THP-1細胞接種于24孔板,同時每孔加入50 ng/ml PMA培養24 h,使其誘導分化成巨噬細胞。PBS液洗滌細胞,再加入Ox-LDL(50 μg/ml)、3H-膽固醇(2 μCi/ml,溶于乙醇,乙醇總濃度<0.2%)、含10% FBS培養液共同孵育48 h后,PBS液再洗滌細胞后,隨機分為2組(n=12):空白組只加入無血清的培養液、對照組加入無血清含10 μg/ml ApoA1培養液,培育12 h后,用閃爍計數法檢測培養液和細胞的3H-膽固醇放射活性每分鐘計數值(Cpm值)。膽固醇流出率=(培養液Cpm值/總Cpm值)×100%,其中總Cpm值=(培養液Cpm值+細胞Cpm值)。
8 膽固醇流出率的測定 將培養好的THP-1細胞,接種于24孔板,按照上述方法,誘導分化成巨噬細胞,富集3H-膽固醇后,隨機分為17組(n=7),包括對照組、200 μmmol/L及100 μmmol/ L濃度下8種脂肪酸干預組(C8∶0、C10∶0、C14∶0、C16∶0、C18∶0、C18∶1、C18∶2、C18∶3),按照分組加入不同脂肪酸干預物(其中對照組加入含2 mg/ml BSA的培養液)培育24 h后,用PBS液洗滌細胞,再分別加入無血清含10 μg/ml ApoA1培養液中培育12 h,用閃爍計數法檢測培養液和細胞的Cpm值,計算膽固醇流出率。
9 統計學分析 采用SPSS17.0統計軟件處理數據,所有數據均以±s表示。多組之間數據進行多因素方差分析及單因素方差分析,兩組間比較采用t檢驗,P<0.05為差異有統計學意義。
結果
1 THP-1巨噬細胞源性泡沫化 THP-1細胞由PMA誘導分化為泡沫細胞,經油紅O染色后,發現胞內有大量脂滴的存在,符合泡沫細胞的形態。見圖1。
2 200 μmmol/L濃度不同脂肪酸對THP-1細胞活性的影響 不同脂肪酸在200 μmmol/L濃度下對THP-1細胞無細胞毒性作用,各組之間差異無統計學意義(P>0.05)。見圖2。
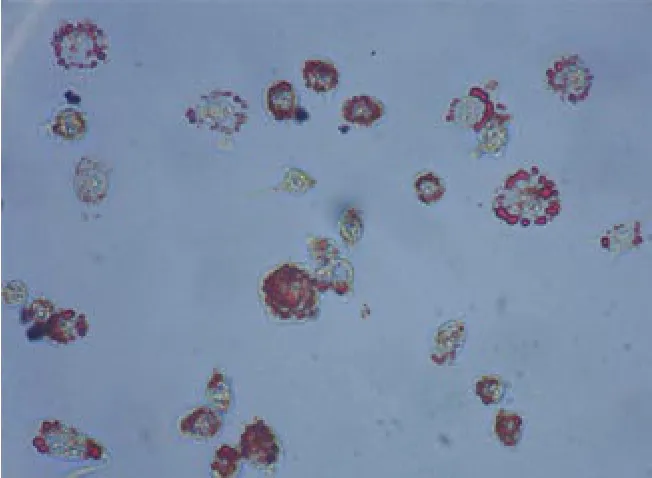
圖 1 THP-1巨噬細胞源性泡沫細胞油紅O染色Fig.1 Oil red O staining of THP-1 macrophage-derived foam cells (×40)
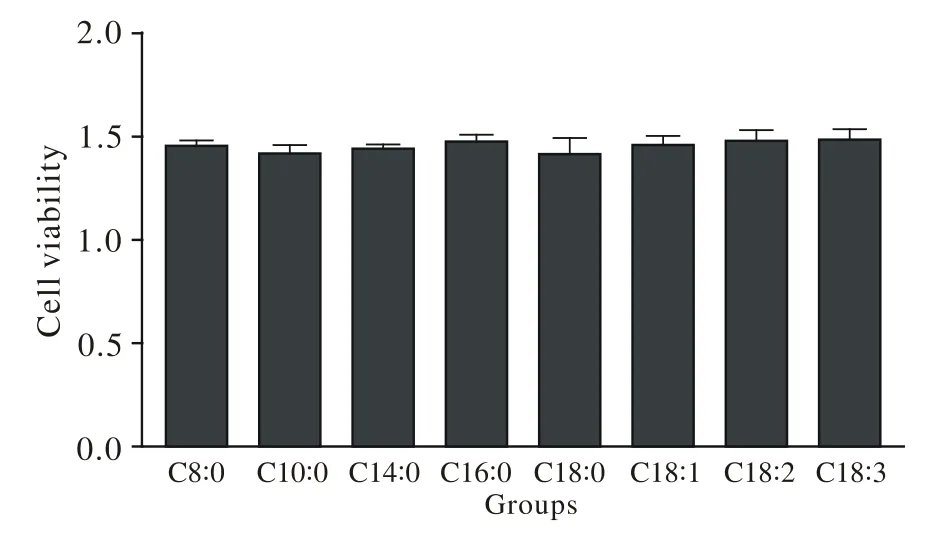
圖 2 不同脂肪酸對THP-1細胞活性的影響Fig.2 Effects of different fatty acids on cell viability (×40)
3 膽固醇流出細胞模型的建立 與空白組比較,對照組(+ApoA1)THP-1巨噬細胞源性泡沫細胞膽固醇流出顯著增加(P<0.05),見圖3。ApoA1介導的膽固醇流出明顯增加,提示膽固醇流出細胞模型復制成功。
4 中鏈脂肪酸對THP-1巨噬細胞源性泡沫細胞膽固醇流出的影響 多因素方差分析發現,隨著脂肪酸濃度的增加(0 ~ 200 μmmol/L),C8∶0、C18∶0、C18∶1和C18∶3脂肪酸對膽固醇的流出差異有統計學意義(P<0.05),特別是C8∶0脂肪酸具有隨著其濃度增加、膽固醇流出增加的趨勢。當不同的脂肪酸都在相同的200 μmmol/L濃度時,C8∶0和C18∶3脂肪酸促進膽固醇的流出,且顯著高于對照組(P<0.05)。此外,C8∶0對促進膽固醇流出的影響顯著高于C10∶0、C14∶0、C16∶0、C18∶0、C18∶1、C18∶2脂肪酸(P<0.05)。見表1。
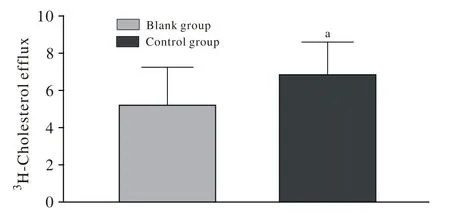
圖 3 ApoA1介導的細胞膽固醇流出Fig.3 Effect of ApoA1 on cholesterol eff l ux
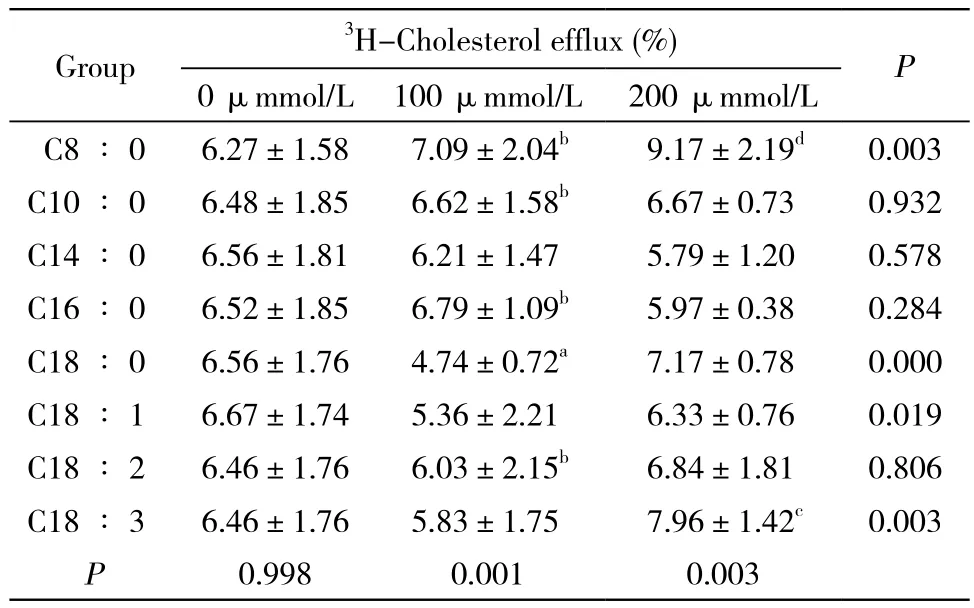
表1 不同脂肪酸對THP-1巨噬細胞源性泡沫細胞的膽固醇流出的影響Tab. 1 Effects of different fatty acids on cholesterol eff l ux in THP-1 macrophages-derived foam cells
討論
巨噬細胞內膽固醇大量聚集形成泡沫細胞,在炎性因子的作用下沉積于血管壁下,這一過程是AS的早期病理基礎。而RCT能夠清除細胞內多余的膽固醇,減緩巨噬細胞泡沫化進程,延緩AS的發生和發展。膽固醇流出是RCT過程中的限速步驟,已成為防治AS研究的熱點。
膳食脂肪酸被認為是影響AS發生、發展重要的營養因素,研究發現飽和脂肪酸增加血清低密度脂蛋白膽固醇水平,進而促進AS的發生[1]。而不飽和脂肪酸能夠對抗AS的發展,如亞油酸能夠降低血漿LDL-C水平而對抗AS形成,DHA或EPA能夠降低動脈粥樣硬化疾病的心血管并發癥[1,5-6]。MCFA作為一種特殊的飽和脂肪酸,具有快速代謝、減少脂肪組織富集以及增加機體能量消耗的特點,近年來多數研究已經表明,MCFA能夠減輕體質量,減少脂肪的堆積[7-8]。筆者研究團隊發現,MCFA能夠改善高膽固醇血癥小鼠血清膽固醇、三酰甘油、LDL-C及HDL-C水平,促進了糞便的中性固醇和膽汁酸的排泄[4]。提示MCFA能夠改善膽固醇代謝,防治AS的發生,進而預防和改善心血管疾病。本研究以THP-1巨噬細胞為研究對象,首先確認了在200 μmmol/L濃度下不同脂肪酸對THP-1巨噬細胞無細胞毒性作用,進一步膽固醇流出實驗發現,隨著脂肪酸濃度的增加(0 ~200 μmmol/L),C8∶0、C18∶0、C18∶1和C18∶3脂肪酸對膽固醇流出的影響有顯著差異,特別是C8∶0脂肪酸具有隨著其濃度增加、膽固醇流出增加的趨勢,而飽和脂肪酸C18∶0在100 μmmol/L濃度時,對膽固醇流出表現出抑制作用,說明了長鏈飽和脂肪酸對AS的不利影響。研究報道C18∶3能夠促進膽固醇流出而降低泡沫細胞膽固醇聚集[9]。本研究同樣發現,多不飽和脂肪酸C18∶3在200μmmol/L濃度時促進膽固醇的流出。Xie等[10]動物實驗發現,辛酸(C8∶0)與油酸(C18∶1)及亞油酸(C18∶2)相比能夠降低肝ApoB、三酰甘油及膽固醇的分泌。Wein等[11]研究發現,MCFA可以降低大鼠空腹膽固醇水平,表明了MCFA在膽固醇代謝方面優于長鏈脂肪酸。這些研究結果表明,MCFA在膽固醇代謝方面較其他脂肪酸具有顯著優勢。本研究在200 μmmol/L濃度時比較不同脂肪酸,發現C8∶0和C18∶3脂肪酸促進THP-1巨噬細胞源性泡沫細胞膽固醇的流出,此外,C8∶0對促進膽固醇流出的影響明顯高于C10∶0、C14∶0、C16∶0、C18∶0、C18∶1、C18∶2脂肪酸。
有關研究報道C18∶3促進膽固醇流出的機制是促進ABCA1、ABCG1及SR-BI表達而增加ApoA1介導的膽固醇流出[12]。目前已知有三磷酸腺苷結合盒轉運體超家族(ABCA1、ABCG1、 ABCG5、ABCG8)、7α-羥化酶(CYP7A1)及SR-BI等參與膽固醇RCT過程,并受核受體肝X受體(LXR-α)及過氧化物酶增殖物激活受體-α、(PPAR-α)調節。有關中鏈脂肪酸C8∶0如何促進膽固醇的流出還需要我們進一步探討。本實驗只是通過細胞實驗觀察到中鏈脂肪酸C8∶0促進膽固醇流出效應,是否對于動物或人群同樣具有效應,也需要進一步研究。
1 Mensink RP, Zock PL, Kester AD, et al. Effects of dietary fatty acids and carbohydrates on the ratio of serum total to HDL cholesterol and on serum lipids and apolipoproteins: a meta-analysis of 60 controlled trials[J]. Am J Clin Nutr, 2003, 77(5): 1146-1155.
2 Xue C, Liu Y, Wang J, et al. Consumption of medium- and longchain triacylglycerols decreases body fat and blood triglyceride in Chinese hypertriglyceridemic subjects[J]. Eur J Clin Nutr, 2009,63(7): 879-886.
3 徐慶,劉英華,王覲,等.中長鏈脂肪酸食用油對高甘油三酯血癥患者脂代謝的影響[J].軍醫進修學院學報,2009,30(4):511-513.
4 Xu Q, Xue C, Zhang Y, et al. Medium-chain fatty acids enhanced the excretion of fecal cholesterol and cholic acid in C57BL/6J mice fed a cholesterol-rich diet[J]. Biosci Biotechnol Biochem, 2013, 77(7):1390-1396.
5 Wijendran V, Hayes KC. Dietary n-6 and n-3 fatty acid balance and cardiovascular health[J]. Annu Rev Nutr, 2004, 24: 597-615.
6 Mozaffarian D, Rimm EB. Fish intake, contaminants, and human health: evaluating the risks and the benefits[J]. JAMA, 2006,296(15):1885-1899.
7 Ferreira L, Lisenko K, Barros B, et al. Influence of medium-chain triglycerides on consumption and weight gain in rats: a systematic review[J]. J Anim Physiol Anim Nutr (Berl), 2014, 98(1): 1-8.
8 Rego Costa AC, Rosado EL, Soares-Mota M. Influence of the dietary intake of medium chain triglycerides on body composition, energy expenditure and satiety: a systematic review[J]. Nutr Hosp,2012, 27(1): 103-108.
9 Zhang J, Kris-Etherton PM, Thompson JT, et al. Alpha-linolenic acid increases cholesterol efflux in macrophage-derived foam cells by decreasing stearoyl CoA desaturase 1 expression: evidence for a farnesoid-X-receptor mechanism of action[J]. J Nutr Biochem,2012, 23(4): 400-409.
10 Xie C, Woollett LA, Turley SD, et al. Fatty acids differentially regulate hepatic cholesteryl ester formation and incorporation into lipoproteins in the liver of the mouse[J]. J Lipid Res, 2002, 43(9):1508-1519.
11 Wein S, Wolffram S, Schrezenmeir J, et al. Medium-chain fatty acids ameliorate insulin resistance caused by high-fat diets in rats[J]. Diabetes Metab Res Rev, 2009, 25(2): 185-194.
12 K?mmerer I, Ringseis R, Biemann R, et al. 13-hydroxy linoleic acid increases expression of the cholesterol transporters ABCA1, ABCG1 and SR-BI and stimulates apoA-I-dependent cholesterol efflux in RAW264.7 macrophages[J]. Lipids Health Dis, 2011, 10: 222.
Effects of medium-chain fatty acids on cholesterol efflux in THP-1 macrophages -derived foam cells
ZHANG Xin-sheng, YANG Xue-yan, WANG Jin, ZHANG Yong, LIU Ying-hua, XU Qing, YU Xiao-ming, LIU Zhao, XUE Changyong
Department of Nutrition, Chinese PLA General Hospital, Beijing 100853, China
XUE Chang-yong. Email: cnxcy@163.com
ObjectiveTo observe the effect of medium-chain fatty acids on cholesterol eff l ux in THP-1 macrophages-derived foam cells.MethodsWST-1 were used to detect the effect of different fatty acids (in the presence of 200 μmmol/L) on the cell viability of THP-1, including caprylic acid (C8∶0), capric acid (C10∶0), myristic Acid (C14∶0), palmitic acid (C16∶0), stearic acid (C18∶0), oleic acid (C18∶1), linoleic acid (C18∶2) and alpha linolenic acid (C18∶3). The cell model of cholesterol eff l ux that mediated by ApoA1 was established. Different fatty acids (0 μmmol/L, 100 μmmol/L and 200 μmmol/L) were used to intervene the THP-1 macrophages-derived foam cells of enriched3H-cholesterol, then after 24 hours, the rate of cholesterol eff l ux were determined by the liquid scintillation.ResultsIn the presence of 200 μmmol/L, different fatty acids showed no adverse effect on the viability of THP-1 cell line (P>0.05). Compared with the blank group, ApoA1 mediated cholesterol eff l ux was signif i cantly higher (P<0.05). With the increase of concentration of fatty acids, C8∶0, C18∶0, C18∶2 and C18∶3 showed signif i cant effects on cholesterol eff l ux (P<0.05). In the concentration of 200 μmmol/L, C8∶0 and C18∶3 fatty acids signif i cantly promoted cholesterol eff l ux comparing with control group (P<0.05), furthermore, C8∶0 fatty acid promoted cholesterol eff l ux was signif i cantly higher than in C10∶0, C14∶0, C16∶0, C18∶0, C18∶1 and C18∶2 fatty acids groups (P<0.05).ConclusionThe medium-chain fatty acid C8∶0 can increase cholesterol eff l ux in THP-1 macrophages-derived foam cells and is obviously higher than that of other fatty acids when its concentration is 200 μmmol/L.
medium-chain fatty acids; fatty acids; macrophages; cholesterol eff l ux
R 589.2
A
2095-5227(2014)12-1245-04
10.3969/j.issn.2095-5227.2014.12.019
時間:2014-09-18 09:41
http://www.cnki.net/kcms/detail/11.3275.R.20140918.0941.001.html
動脈粥樣硬化(atherosclerosis,AS)是導致心血管疾病發生、發展的主要病理基礎,而引起AS的主要原因就是血膽固醇水平的升高,進而導致病變血管處膽固醇的堆積,巨噬細胞過度荷脂形成泡沫細胞,沉積于動脈壁形成早期的粥樣斑塊。膽固醇的逆轉運(reverse cholesterol transport,RCT)過程可將細胞內多余的膽固醇從細胞中流出并轉移至高密度脂蛋白(high density lipoprotein,HDL),再經血液循環轉運到肝進行代謝。因此,巨噬細胞的RCT對動脈粥樣硬化的形成起著關鍵的作用,也是目前認為對抗AS發生的主要機制[1]。膳食脂肪酸被認為是影響AS發生、發展的重要營養因素,而中鏈脂肪酸(medium chain fatty acids,MCFA)為一種特殊的飽和脂肪酸,是由8 ~ 12個碳原子構成的脂肪酸,主要來源于母乳、牛奶及其制品、棕櫚仁油和椰子油等,最常見的MCFA有C8∶0和C10∶0脂肪酸。MCFA與健康的關系日益受到重視,臨床試驗研究發現,MCFA除了能夠降低體質量、改善體脂外,還能夠顯著降低高脂血癥患者三酰甘油和膽固醇水平[2-3]。動物實驗研究同樣發現,MCFA能夠改善高膽固醇血癥小鼠血清膽固醇、三酰甘油、LDL-C及HDL-C水平,還能促進糞便的中性固醇和膽汁酸的排泄[4]。因此,MCFA對膽固醇代謝具有明顯的調節效應,本文以THP-1巨噬細胞源性泡沫細胞為研究對象,與其他脂肪酸比較,觀察中鏈脂肪酸對THP-1巨噬細胞源性泡沫細胞膽固醇流出的影響,探討MCFA在防治AS發生及發展中的作用。
2014-05-14
國家自然科學基金項目(81172667)
Supported by the National Natural Science Foundation of China(8117 2667)
張新勝,男,在讀碩士,主治醫師。Email: zhangxinsheng198431@126.com
薛長勇,男,碩士,主任醫師,碩士生導師,主任。Email: cnxcy@163.com

