雙側睪丸支持細胞瘤1例報告并文獻復習
于 滿申興斌李俊鵬王澤民趙立軍李春輝
1. 承德醫學院附屬醫院泌尿外科(承德 067000); 2. 承德醫學院附屬醫院病理科
雙側睪丸支持細胞瘤1例報告并文獻復習
于 滿1*申興斌2李俊鵬1王澤民1趙立軍1李春輝2
1. 承德醫學院附屬醫院泌尿外科(承德 067000); 2. 承德醫學院附屬醫院病理科
成人睪丸支持細胞瘤發病率較低,臨床較為罕見,其惡性程度不高,臨床預后較好。本院2006年11月收治1例雙側睪丸同時發生支持細胞瘤,結合文獻進行討論。
病例報告
患者,45歲,因雙側睪丸增大伴墜脹感3個月余,于2006年11月15日住院。入院時檢查心肺無異常,體溫36.9℃,外觀雙側陰囊增大,右側明顯(圖1)。體檢時觸及雙側睪丸增大,右側約8.0cm ×7.0cm×7.0cm,左側6.0cm×5.0cm×5.0cm,質地中等,表面光滑,輕觸痛,有沉重感。雙側精索及附睪觸之正常,雙側腹股溝未觸及腫大的淋巴結。血清甲胎蛋白(AFP)、絨毛膜促性腺激素β-亞基(HCG)均正常;超聲提示雙側睪丸實性占位,CT提示雙側睪丸實質內不均等實性占位,強化掃描時雙側睪丸占位性病變有強化(圖2)。胸部X片未見異常。故診斷雙側睪丸腫瘤,行腹股溝切口雙側睪

圖1 外觀雙側陰囊增大,右側明顯
丸根治性切除術。術后大體標本見右側睪丸8.0cm ×7.0cm×7.0cm,左側睪丸5.5cm×5.0cm×5.0cm(圖3)。術后病理鏡下所見:腫瘤邊界清楚,腫瘤細胞排列成巢狀,細胞多角形,核呈橢圓形、圓形或長形,核仁不突出,未見核溝及核內包涵體,胞漿嗜酸性。細胞形態總體平和,相對一致,核分裂像<5個/10HPF(高倍視野法)。間質由中等量纖維和透明變性的組織構成,可見擴張的血管,間質水腫,少量炎細胞浸潤,間質內殘存的腺體結構完好(圖4);免疫組化結果:肌特異性肌動蛋白(MSA)(-)、肌酸激酶(CK)(-)、Vimentin(+)、Desmin(+)、AFP(-)、NSE(+)(圖5)。診斷雙側睪丸支持細胞瘤,明顯核異性,有潛在惡性傾向。患者術后9個月時,訴腰痛,經CT檢查,腰2、3椎體有破壞,考慮骨轉移。雖經化療和放療,但于術后2年死亡。

圖3 手術切除大體標本
討 論
一、發病情況
睪丸支持細胞瘤(Sertoli cell tumors)是一種罕見的性索間質腫瘤,睪丸支持細胞瘤又稱男性母細胞瘤, 屬于性腺基質腫瘤。一般認為起源于生殖嵴的原始性腺間質或顆粒細胞組成, 即生殖腺內生殖細胞的支持成分。大約占睪丸所有腫瘤的1%[1]。1944年Teilum首次報道了睪丸支持細胞瘤。此后陸續個案報告,到目前,文獻顯示全世界成組或個案報道不足400例[2]。搜集國內文獻,自1989王麟根首先報道2例,到2013年底共計24例(見表1)[2-21]。本例為第25例。

圖4 術后病理鏡下所見

圖5 免疫組化結果
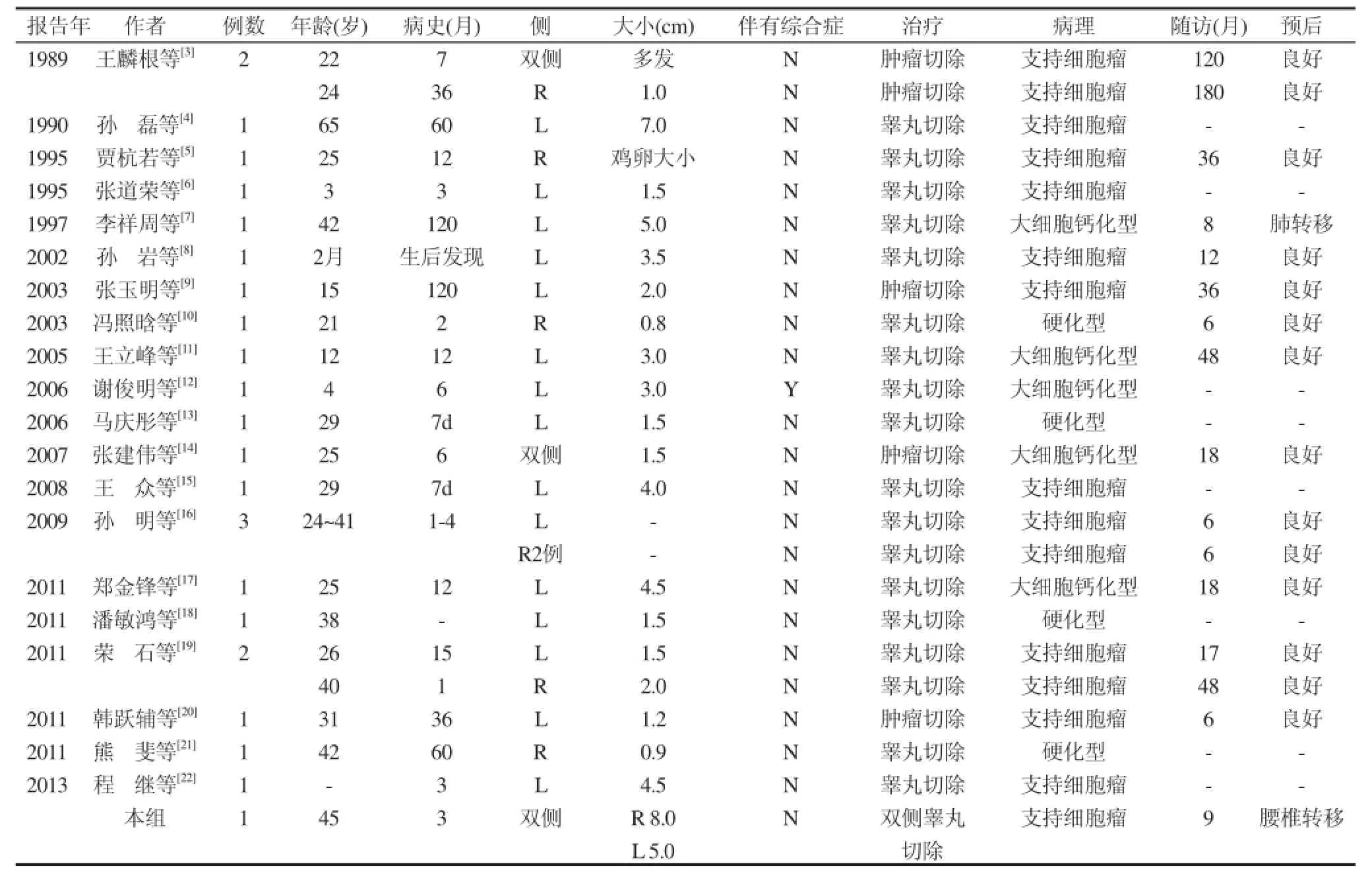
表1 國內報告的睪丸支持細胞瘤
睪丸支持細胞瘤可發生于各個年齡段,包括新生兒,但多見于中年人。國內25例中最小年齡2個月,最大年齡65歲,平均年齡27.3歲。原發性睪丸支持細胞瘤的病因至今尚不十分清楚,有多種因素參與。目前認為先天性因素中最主要的為隱睪和遺傳因素。后天因素中較常見的為損傷、激素異常和感染[16]。臨床上好發于隱睪及假兩性畸形患者的睪丸,可能與睪丸損傷、炎癥有關。
二、分類
睪丸支持細胞瘤被廣泛接受的分型包括非特殊類型、硬化型和大細胞鈣化型。這種組織學分類不是單純的病理學分類,而是代表著不同的代謝及激素異常的臨床特征,且有著不同的惡性潛能及預后意義。大多數睪丸支持細胞瘤屬于“非特殊型”,即典型的睪丸支持細胞瘤;另有兩種罕見亞型,即硬化型(Sclerosing Sertoli Cell Tumor,SSCT)和大細胞鈣化型(Large Cell Calcifying Sertoli Cell Tumor,LCCSCT)。國內25例中,典型的睪丸支持細胞瘤為16例(64.0%),LCCSCT 5例(20.0%),硬化型4例(16.0%)。硬化型睪丸支持細胞瘤自Zukerberg等1991年首次報道10例至今英文文獻共43例[1,22,23],國內共報道4例[10,13,18,21]。LCCSCT首例是由Proppe和 Scully在1980年描述,至2003年共有61例報道[24,25],到2014年2月僅增加了17例,目前在世界范圍內英文文獻共78例報道[26,27],國內有5例報道[7,11,12,14,17],是少見的亞型,大部分為散發,也可以是Carney和Pentz-Jeghers綜合征的一部分。
三、病理
睪丸支持細胞瘤直徑一般小于3cm,如果腫瘤較大,高度可疑惡性。肉眼觀察腫瘤為實質性,呈灰白色,切面呈淡黃色,有砂礫感,有點狀出血或壞死區域。鏡下見最顯著的特點是在豐富致密的纖維結締組織中包繞著腫瘤性上皮細胞,細胞排列成實性或中空的小管狀結構,小管通常較小且多為實性,分散或相互吻合,亦可呈不規則團簇狀、片巢狀、條索狀聚集; 腫瘤細胞小至中等大,邊界不清,胞質量中等、淡染,部分細胞含有偏心的大脂質空泡,核圓形、卵圓形,或呈不規則空泡狀,有一個或多個小核仁,核染色質空泡狀,細胞無異型或輕度異型性,核分裂象罕見。個別病例細胞有中度異型性,核分裂多見,腫瘤侵犯睪丸網、附睪和血管。
硬化型睪丸支持細胞瘤肉眼觀為實性、白色或黃白色的結節。鏡下見腫瘤呈條索狀、實性癌巢或篩狀分布于致密的膠原結締組織之間。
LCCSCT肉眼觀為灰白色或淡黃色結節,呈多灶性;鏡下見黏液樣或膠原性的間質中,腫瘤細胞呈巢狀或條索狀分布,胞質豐富,呈嗜酸性, 間質呈鈣化或骨化,鈣化是該瘤的一個重要特征。除惡性病例外,核分裂象少見。
免疫組化檢查主要有助于區分睪丸的其他腫瘤,但有作者提出免疫組化 CK和vimentin有助于分型,CK的表達與小管的分化程度有關;大細胞鈣化型vimentin陽性,低分子CK 灶性陽性。而硬化型CK常為陰性,vimentin強陽性。但國內24例中,做了免疫組化檢查13例,vimentin陽性12例,陰性1例為非特殊型;CK陽性5例,陰性8例。本文1例vimentin陽性,CK呈陰性。Kao等[1]報告20例SSCT免疫組化檢查結果,vimentin檢查7例均為陽性,CK11例中陽性6例,inhibin15例陽性4例。免疫組化檢查主要用于區分睪丸的其他腫瘤。如睪丸間質細胞瘤inhibin可呈強陽性。
四、臨床表現
睪丸支持細胞瘤的臨床表現隨就診時間而異, 左右睪丸的發病比例幾乎相等;但國內25例中除3例為雙側同時發病外,其余22例左側15例,右側7例,左:右為2.1:1。主要臨床表現為睪丸腫塊,呈圓形或卵圓形,生長緩慢,質地韌,部分伴有疼痛或不適感,腫塊生長緩慢,多為單發;也可出現內分泌變化,如男性乳房增大,約10%~38%有男性乳房發育,皮膚色素沉著等,青春期前患者偶有性早熟,雄激素、雌激素、促性腺激素升高,但也可正常。
硬化型睪丸支持細胞瘤見于青春期后,發病年齡18~80 歲,平均年齡為35歲。80%的腫瘤小于2.0cm,常為單一的無痛性腫塊,無激素生成異常或伴發發育不良性綜合征引起的性腺外癥狀,無遺傳傾向。腫瘤均為單側,左右睪丸的發病比例幾乎相等;國內4例年齡21~42歲,平均年齡32.5歲。多數患者以發現睪丸腫物就診, 均無激素異常的表現。
LCCSCT發病年齡多在20歲以下,平均年齡為16歲。國內5例中最小年齡4歲,最大年齡42歲,平均年齡21.6歲。以睪丸腫物為主要臨床表現,少數乳房呈女性樣發育或表現為性早熟。緩慢增長的睪丸腫塊為其主要臨床表現,偶伴有疼痛。部分患者有乳腺增生,尿中可排出大量雌激素。國內5例中有1例兒童先出現雙側乳房增大,進一步檢查發現左側睪丸腫瘤。嬰幼兒患者可出現性早熟現象。其中40%與遺傳性綜合征或內分泌異常(包括性早熟和男性乳腺發育)有關,通常多見為Carney綜合征,而Pentz-Jeghers綜合征少見;約20%為雙側睪丸發病或睪丸多灶性病變,而雙側者Carney 綜合征發生率更高[28]。Carney 綜合征表現有:皮膚、軟組織和心臟的黏液瘤,乳腺的黏液性病變,面部和口唇的雀斑,皮膚的藍痣,色素性腎上腺皮質增生結節繼發的Cushing綜合征,垂體性激素腺瘤,砂礫體性黑色素性神經鞘瘤,LCCSCT 等。Pentz-Jeghers綜合征,多見于兒童和青少年,是一種常染色體顯性遺傳病,患者有胃腸道多發性錯構瘤性息肉,手足皮膚及口腔黏膜的色素沉著,故又稱皮膚黏膜黑斑息肉病,息肉最常見于小腸[29]。需要注意LCCSCT有17%為惡性,惡性者發病年齡在20歲以上,腫瘤直徑>4.0cm。
五、影像學表現
1. 超聲檢查表現:睪丸內低回聲或等回聲團塊,邊界清晰,內部回聲欠均勻, 彩色多普勒顯示腫物內部及周邊可見少量血流信號,顯示睪丸內占位病變,無明顯特異性,而超聲不能對本病作出明確診斷。
2. CT:CT平掃顯示睪丸內實性占位,邊緣清晰,包膜完整,內在密度均勻或欠均勻,可有囊變壞死鈣化等。增強掃描顯示睪丸病灶包膜略有強化,有時中央可見小片狀不均勻強化影,但是確診只能依靠病理學檢查。
六、治療與預后
因睪丸支持細胞瘤臨床少見,在未獲得組織病理學之前,很難與睪丸其他惡性腫瘤區別,所以,睪丸根治性切除仍是首選。對于年輕雙側睪丸的小腫瘤(<2.0cm的腫瘤)可做保留睪丸的腫瘤切除術[26]。硬化型較非特殊類型及大細胞鈣化型預后要好,隨訪9個月至10 年,無一例復發或轉移,即使年齡最大(80 歲)的患者其組織學形態表現為惡性(核分裂較多見,侵犯睪丸網、附睪和血管),術后5年死于心臟疾病,也沒有睪丸腫瘤復發或轉移的臨床證據[22]。報道中腫瘤體積最大者7 cm,累及右側整個睪丸,隨訪6年也無癥狀[30]。而非特殊類型及大細胞鈣化型均有轉移的報道[25,27,31,32]。文獻報道年齡較大、或腫瘤超過4cm者,有惡性潛能,本組患者為45歲,在國內所有報告中除一例60歲者外是年齡最大者,而且雙側睪丸均彌漫性增大分別為8和5.5cm,該患者9個月時出現腰椎轉移。表明硬化型睪丸支持細胞瘤惡性潛能極低,其預后要比其他兩型好。因此,硬化型睪丸支持細胞瘤可以采取單純腫塊切除術,但由于術前往往明確診斷困難,根治手術仍為常用的術式。
睪丸腫瘤; 塞爾托利細胞瘤; 免疫組織化學
1 Kao CS, Kum JB, Idrees MT,et al. Sclerosing sertoli cell tumor of the testis: a clinicopathologic study of 20 cases.Am J Surg Pathol2014; 38(4):510-517
2 程繼, 鐘甘平, 董治龍. 睪丸支持細胞瘤1例報告. 中國男科學雜志 2013, 27(5): 65-66.
3 王麟根. 睪丸支持細胞瘤2例報道. 男性學雜志 1989; 3(2): 114-115
4 孫磊, 張林. 睪丸支持細胞瘤一例. 昆明醫學院學報1990; 11(3): 78
5 賈杭若, 王愛忠. 睪丸支持細胞瘤一例. 中華病理學雜志1995; 24(6): 374
6 張道榮, 宋繼渴, 張麗紅. 睪丸支持一間質細胞腫瘤. 診斷病理學雜志 1995; 2(2): 99
7 李祥周, 石鳳娟, 陸曉哲, 等. 睪丸惡性大細胞鈣化性支持細胞瘤一例. 中華病理學雜志 1997; 26(4): 213
8 孫巖, 陶文芳, 李昭鑄. 嬰兒睪丸支持細胞瘤一例. 中華小兒外科雜志 2002; 23(1): 39
9 張玉明, 曲凱, 白鵬. 睪丸支持細胞瘤1例. 臨床泌尿外科雜志 2003; 18(12): 727
10 馮照晗, 張釗, 姜永金. 睪丸支持細胞瘤一例報告. 中華泌尿外科雜志 2003; 24(3): 209
11 王立峰, 張淑杰, 戚基萍, 等. 睪丸大細胞鈣化性支持細胞瘤一例. 中華病理學雜志 2005; 34(11): 761-762
12 謝俊明, 江少波, 鄔賢德. 睪丸大細胞鈣化型支持細胞瘤合并乳房發育. 現代泌尿外科雜志 2006; 11(1): 53-54
13 馬慶彤, 趙英奇, 徐子強. 睪丸支持細胞瘤1例. 臨床泌尿外科雜志 2006; 21(1): 76
14 張建偉, 茍新敏, 李智, 等. 睪丸大細胞鈣化性支持細胞瘤一例. 中華病理學雜志 2007; 36(4): 281-282
15 王眾. 睪丸支持細胞瘤的超聲表現1例. 中國超聲醫學雜志 2008; 24(6Ⅱ): 28
16 孫明, 吳斌, 王鴻起, 等. 成人睪丸支持細胞瘤的診斷和治療 (附3例報告并文獻復習). 中華男科學雜志 2009; 15(10): 950- 951
17 鄭金鋒, 程童大, 劉曉紅, 等. 睪丸大細胞鈣化型支持細胞瘤臨床病理觀察. 中華男科學雜志 2011; 17(8): 730-733
18 潘敏鴻, 張智弘, 王聰, 等. 睪丸硬化型支持細胞瘤臨床病理觀察. 診斷病理學雜志 2011; 18(5): 368-370
19 榮石, 毛全宗, 嚴維剛, 等. 睪丸支持細胞瘤二例. 中華臨床醫師雜志(電子版) 2011; 5(24): 7459- 7460
20 韓躍輔, 吳寶國, 張朝勝, 等. 睪丸支持細胞瘤 1例報告并文獻復習. 現代泌尿外科雜志 2011 16(3): 254-255
21 熊斐, 羅良平, 史長征. 硬化性睪丸支持細胞瘤 1 例. 中國醫學影像技術 2011; 27(7): 1434
22 Zukerberg LR, Young RH, Scully RE. Sclerosing Sertoli cell tumor of the testis. A report of 10 cases.Am J Surg Pathol1991; 15(9): 829-834
23 Ishida M, Fujiwara R, Tomita K,et al.Sclerosing Sertoli cell tumor of the testis: a case report with review of the literature.Int J Clin Exp Pathol2013; 6(11): 2640-2643
24 Proppe KH, Scully RE. Large-cell calcifying Sertoli cell tumor of the testis.Am J Clin Pathol1980; 74(5): 607-619
25 De Raeve H, Schoonooghe P, Wibowo R,et al.Malignant large cell calcifying Sertoli cell tumor of the testis.Pathol Res Pract2003; 199(2): 113-117
26 Kaluzny A, Matuszewski M, Wojtylak S,et al. Organsparing surgery of the bilateral testicular large cell calcifying sertoli cell tumor in patient with atypical Peutz-Jeghers syndrome.Int Urol Nephrol2012; 44(4): 1045-1048
27 Petersson F, Bulimbasic S, Sima R,et al. Large cell calcifying Sertoli cell tumor: a clinicopathologic study of 1 malignant and 3 benign tumors using histomorphology, immunohistochemistry, ultrastructure, comparative genomic hybridization, and polymerase chain reaction analysis of the PRKAR1A gene.Hum Pathol2010; 41(4): 552-559
28 Halat SK, Ponsky LE, MacLennan GT. Large cell calcifying Sertoli cell tumor of testis.J Urol2007; 177(6): 2338
29 Gourgari E, Saloustros E, Stratakis CA. Large-cell calcifying Sertoli cell tumors of the testes in pediatrics.Curr Opin Pediatr2012; 24(4): 518-522
30 Abbas F, Bashir NW, Hussainy AS. Sclerosing Sertoli cell tumor of the testis.J Coll Physicians Surg Pak2005; 15(7): 437-438
31 Young RH, Koelliker DD, Scully RE. Sertoli cell tumors of the testis, not otherwise specif ed: a clinicopathologic analysis of 60 cases.Am J Surg Pathol1998; 22(6): 709-721
32 Henley JD, Young RH, Ulbright TM. Malignant Sertoli cell tumors of the testis: a study of 13 examples of a neoplasm frequently misinterpreted as seminoma. Am J Surg Pathol2002; 26(5): 541-550
(2014-05-20收稿)
10.3969/j.issn.1008-0848.2014.09.017
R 737.21
*通訊作者, Email: yumanok@126.com; Tel:13398692608

