高效液相色譜法測定米非司酮血藥濃度
鄧潔雄,肖洋娟,顏惠芳
(1.廣州市藥品檢驗所 四分所,廣東 廣州 510405;2.廣州市荔灣區骨傷科醫院,廣東 廣州510140)
?
高效液相色譜法測定米非司酮血藥濃度
鄧潔雄1,肖洋娟1,顏惠芳2
(1.廣州市藥品檢驗所 四分所,廣東 廣州 510405;2.廣州市荔灣區骨傷科醫院,廣東 廣州510140)
目的:建立高效液相色譜法測定血漿中米非司酮的濃度。方法:采用固相萃取技術處理血漿樣品,以炔諾酮為內標,Phenomenex Synergi 4u Fusion-RP 80A C18柱(4.6mm×250mm,4μm)為分析柱,流動相為甲醇-水(75∶25),流速1.0mL·min-1,柱溫:25℃。采用雙波長法檢測,炔諾酮的檢測波長為240nm,米非司酮檢測波長為302nm。結果:米非司酮的線性范圍為0.01~2.0μg·mL-1,最低定量限為0.01μg·mL-1,回歸方程為Y=1.6439X-0.0297,r=0.9998。結論:該方法簡便、準確、靈敏,適用于米非司酮藥代動力學研究。
米非司酮;血藥濃度;固相萃取;內標法;高效液相色譜法
米非司酮(mifepristone)是一種甾體類抗孕激素藥物,臨床廣泛應用于終止早孕、引產等[1]。目前報道的有關血漿中米非司酮濃度測定的方法有放射性免疫測定法(RIA)[2]、放射性受體測定法(RRA)[3]、高效液相色譜法(HPLC)[4]。RIA和RRA方法無法區分米非司酮母體和代謝物,且實驗過程復雜、危險、成本高,因此這兩種方法的使用受到限制。在報道的HPLC方法中,國內有研究[4-5]采用乙醚萃取方法處理樣本,由于乙醚提取的樣品中血漿內源性雜質太多,干擾米非司酮測定;國外有研究報道,Stith等[6]采用固相萃取技術測定米非司酮血藥濃度,但該方法所用內標物RTI-3021-003難以獲得,另有國外文獻[7]以炔諾酮為內標,采用固相萃取技術測定血漿中米非司酮濃度,其炔諾酮與血漿內源性物質分離效果差,影響測定結果的準確性。本研究通過優化固相萃取方法中清洗步驟,消除了血漿內源性物質對米非司酮及炔諾酮測定的干擾,建立了一種專屬性強、靈敏度高的HPLC方法測定血漿中米非司酮濃度,為藥代動力學研究和生物等效性評價提供了可靠的保證。
1 材料和對象
1.1 儀器
日本Shimadzu公司LC-20AT泵,SIL-20A全自動進樣器,SPD-M20A二極管陣列檢測器,LC-Solution工作站;德國IKA MS2渦旋混合器;TCL-16G高速臺式離心機(上海安亭科學儀器廠);固相萃取儀(天津奧特賽恩斯儀器有限公司);Oasis HLB固相萃取小柱(1cc/30mg)由Waters公司提供。
1.2 藥品和試劑
炔諾酮對照品(100053-200705)由中國食品藥品檢定研究院提供;米非司酮原料藥由浙江仙琚制藥股份有限公司提供,批號:100131;米非司酮普通片劑(規格:10mg)由北京紫竹藥業有限公司提供,批號:43090105;甲醇為色譜純(SK Chemicals),磷酸為分析純(天津富宇精細化工有限公司),水為重蒸餾水。
1.3 實驗動物
雌性Spague-Dawley大鼠,體重(200±20)g,由廣州中醫藥大學實驗動物中心提供。
2 色譜條件
色譜柱:Phenomenex Synergi 4u Fusion-RP 80A C18柱(4.6mm×250mm,4μm);流動相:甲醇-水(75∶25);流速:1.0mL·min-1;檢測波長:炔諾酮采用240nm,米非司酮采用310nm,柱溫:25℃,進樣量:30μL。
3 樣品處理
3.1 對照品溶液和內標溶液的制備
對照品溶液的配制:精密稱取10mg米非司酮置于100mL量瓶中,用甲醇溶解并稀釋至刻度,搖勻,得到米非司酮對照品儲備液。分別精密量取儲備液0.025、0.125、0.25、0.5、1.25、2.5、5.0mL置于50mL量瓶中,用0.025%磷酸稀釋至刻度,得濃度分別為0.05、0.25、0.5、1.0、2.5、5.0、10.0μg·mL-1的系列對照品溶液。
內標溶液的配制:精密稱取10mg炔諾酮置于100mL量瓶中,甲醇溶解并稀釋至刻度,搖勻,得炔諾酮對照品儲備液。精密量取儲備液1.25mL置于50mL量瓶中,用0.025%磷酸稀釋至刻度,配成2.5μg·mL-1的內標溶液。
3.2 血漿樣品處理
HLB小柱用1mL甲醇進行活化,1mL重蒸餾水平衡,備用。取血漿樣品150μL加入內標溶液30μL,渦旋2min,加入1mol·L-1磷酸30μL,渦旋2min,靜置5min后上樣。用3mL重蒸餾水清洗小柱,再用1mL 0.5%甲醇清洗小柱1次,棄去清洗液。最后用1mL甲醇洗脫樣品,洗脫液置于50℃真空干燥箱中揮干。洗脫液揮干后用100μL 50%甲醇溶解,渦旋2min, 16 000rpm離心4min,取上清液進樣。
4 方法與結果
4.1 方法專屬性
在上述色譜條件下測得空白血漿及空白血漿加樣色譜,見圖1。內標炔諾酮、米非司酮的保留時間分別為7.2、13.6 min,結果表明血漿中無內源性物質干擾炔諾酮及米非司酮。
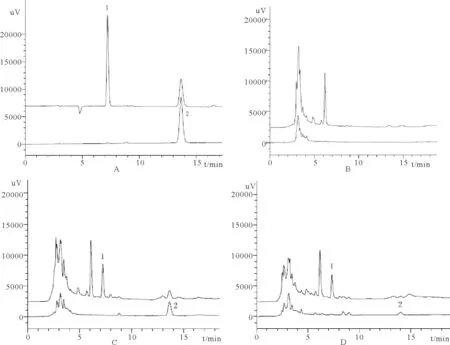
圖1 米非司酮+炔諾酮溶液(A)、空白血漿(B)、空白血漿+米非司酮+炔諾酮(C)、大鼠給藥后血漿樣品(D)色譜
4.2 線性關系及靈敏度
取大鼠空白血漿150μL,加入不同濃度的米非司酮系列對照品溶液30μL及內標溶液30μL,使血漿中米非司酮的濃度分別為0.01,0.05,0.1,0.2,0.5,1.0,2.0μg·mL-1,內標炔諾酮濃度為0.5μg·mL-1。自“加入1mol·L-1磷酸30μL”,按“3.2”項下方法操作,以血漿中米非司酮的濃度為橫坐標,米非司酮與內標的峰面積之比為縱坐標繪制標準曲線,回歸方程為:Y=1.6439X-0.0297,r=0.9998,定量下限為0.01μg/mL-1,結果表明米非司酮在0.01~2.0μg·mL-1濃度范圍內線性關系良好。
4.3 絕對回收率
按“4.2”項下方法制備米非司酮低、中、高(0.05、0.5、2.0μg·mL-1)三個濃度的對照品血漿質控樣本(QC),每個濃度平行制備5份樣品,自“加入1mol·L-1磷酸30μL”,按“3.2”項下操作處理后進樣,記錄米非司酮的峰面積為As。另取對照品儲備液適量,用0.025%磷酸稀釋成相應濃度的米非司酮溶液,不經處理直接進樣,記錄米非司酮的峰面積為Asd。血漿中米非司酮的絕對回收率=As/Asd×100%。按公式計算低、中、高三個濃度下血漿中米非司酮的絕對回收率,結果見表1。
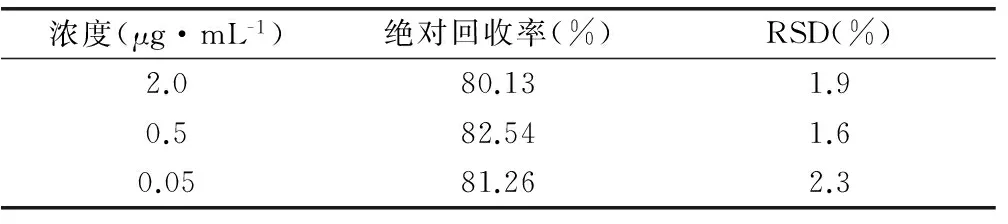
表1 血漿中米非司絕對回收率 (n=5)
4.4 精密度和準確度
按“4.2”項下方法制備米非司酮低、中、高三個濃度(0.05、0.5、2.0μg·mL-1)質控樣本,每個濃度平行制備6份樣品,自“加入1mol·μL-1磷酸30μL”,按“3.2”項下操作處理后進樣,連續測定3天并與標準曲線同時進行,以當日的標準曲線計算質控樣本的濃度,精密度以實際測得量的相對標準偏差(RSD)表示,計算日內RSD和日間RSD。準確度以質控樣品實測濃度值與理論濃度值之比計算,結果見表2。
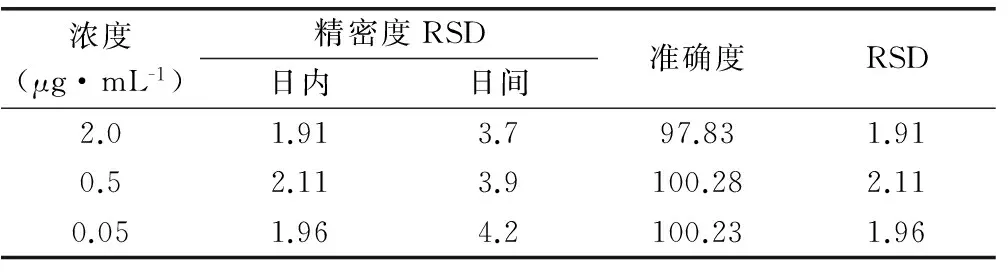
表2 米非司酮的日內、日間精密度和準確度 (%)
4.5 穩定性試驗
4.5.1 室溫穩定性 按“4.2”項下方法制備米非司酮低、中、高三個濃度(0.05、0.5、2.0μg·mL-1)質控樣本,每個濃度平行制備3份樣品,于室溫分別放置不同時間后,自“加入1mol·L-1磷酸30μL”,按“3.2”項下操作處理后進樣,與0h相比求得血漿樣本的RSD為3%。結果表明,對照品血漿質控樣本在8h內可保持穩定。
4.5.2 凍融穩定性 按“4.2”項下方法制備米非司酮低、中、高三個濃度(0.05、0.5、2.0μg·mL-1)質控樣本,每個濃度平行制備3份樣品,于-20℃冷凍24h,取出解凍,反復凍融3次后,自“加入1mol·L-1磷酸30μL”,按“3.2”項下操作處理后進樣,與未凍融前相比求得標準血漿樣本的RSD為3.6%。結果表明,對照品血漿質控樣本在凍融條件下可保持穩定。
4.5.3 長期穩定性 按“4.2”項下方法制備米非司酮低、中、高三個濃度(0.05、0.5、2.0μg·mL-1)質控樣本,每個濃度平行制備3份樣品,于-20℃分別冷凍7、14、21天后取出待完全解凍后,自“加入1mol·L-1磷酸30μL”,按“3.2”項下操作處理后進樣,與0h相比求得對照品血漿質控樣本的RSD為4.8%。結果表明,對照品血漿質控樣本在-20℃條件下可保持21天穩定。
4.6 樣品血藥濃度測定
取米非司酮片劑10片,碎成細顆粒,備用。取禁食12h的SD大鼠6只,按照5.2mg/kg劑量經特制灌胃針灌胃,試驗期間自由飲水,給藥后4h給予食物。分別于0.25、0.5、1、2、4、6、8、24h眼眶后靜脈叢取血0.5mL,置肝素化離心管中,4 000rpm離心10min,分離血漿,于-20℃下保存,直至分析。按“3.2”項下方法處理后進樣分析,各取樣時間點的平均血藥濃度為240.14、292.77、155.03、83.28、52.73、47.44、43.29、38.41ng·mL-1,其SD分別為7.76%、9.38%、4.14%、2.61%、1.31%、0.41%、0.43%、0.41%,以取樣時間點為橫坐標,血藥濃度為縱坐標作圖,結果見圖2。
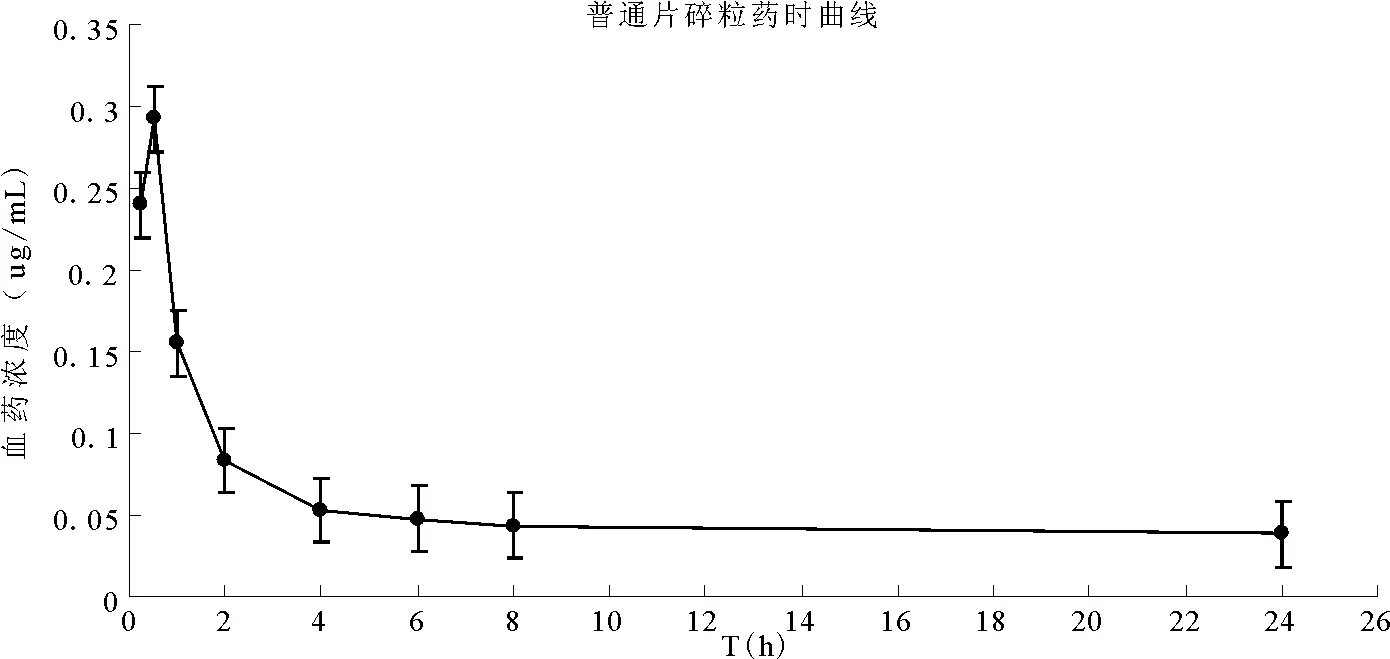
圖2 大鼠灌胃米非司酮后的平均血藥濃度-時間曲線
5 討論
5.1 固相萃取條件的選擇
加入血漿中的米非司酮對照品溶液及炔諾酮內標溶液若采用甲醇稀釋定容,會產生蛋白沉淀,使樣品通過固相萃取小柱變得極為困難,故不采用甲醇稀釋工作液。由于米非司酮難溶于水,在酸性條件下易溶解,因而采用0.025%的磷酸水溶液(pH值約為2.4)來稀釋定容對照品及內標溶液。
為保證被分析物的高回收率并盡可能除去血漿內源性物質,試驗過程中考察了幾種清洗液:水、5%的甲醇溶液、30%的甲醇溶液、5%甲醇-2%乙酸溶液、5%甲醇-2%氨水溶液對萃取結果的影響。結果表明加大清洗液中有機相的比例,并不能減少待測物質出峰位置的雜質干擾,反而導致部分待測物質在洗脫前已經被清洗出來,降低樣品回收率。此外,在5%甲醇中添加一定比例的乙酸或氨水,其清洗效果也未有明顯提高。本研究還對水的清洗量進行了比較,發現通過增加水的清洗量,能更好地降低雜質干擾。最后采用以3mL水、1mL0.5%甲醇依次清洗,1mL甲醇洗脫的方法。結果表明,血漿內源性物質與炔諾酮及米非司酮分離度良好,對炔諾酮及米非司酮的測定無干擾,萃取物的絕對回收率高,結果穩定可靠。
5.2 內標物的選擇
本研究采用雙波長檢測方法,以內標法定量分析,提高了分析結果的準確性和可靠性。試驗過程中,還對使用左炔諾孕酮和炔諾酮作為內標物質進行了對比。結果顯示,左炔諾孕酮主峰位置與血漿內源性物質分離度較差,而采用炔諾酮為內標,與血漿內源性物質分離度好,故選用炔諾酮作為內標物質。
5.3 色譜條件的選擇
本試驗對比了甲醇-0.2%甲酸溶液(75∶25)、甲醇-0.1%甲酸溶液(75∶25)、和甲醇-水(75∶25)三種流動相的分離效果。發現在酸性條件下,炔諾酮與米非司酮的保留時間大大縮短,與血漿中的內源性物質分離度差,而采用甲醇-水(75∶25)為流動相在保證分析時間不是太長的同時能實現炔諾酮、米非司酮與血漿內源性物質的良好分離。
5.4 方法適用性
本研究建立的米非司酮血漿濃度測定方法,具有操作簡便、專屬性強、靈敏度高等特點,可滿足體內藥物濃度測定,適用于米非司酮藥代動力學的研究。
[1] BAULIEU EE,SEGAL SJ.The antiprogestin steroid RU 486 and human fertility control[M].New York: Plenum Press,1985:1.
[2] WANG JD, SHI WL, ZHANG GQ, et al.Tissue and serum levels of steroid hormones and RU 486 after administration of mifepristone[J]. Contraception,1994,49( 3) :245.
[3] KAWAI S,NIEMAN L,BRANDON D,et al.Pharmacokinetic properties of the antiglucocorticoid and antiprogesterone steroid RU 486 in man[J].Pharmacol ExpTher,1987,241( 2):401.
[4] GUO ZHIYONG,WEI DANYI,CHU CHENGDING,et al.Determination of mifepristone in human plasma by high performance liquid chromatography[J].PTCA ( PART B:CHEM.ANAL),2007,43(1):15.
[5] WU LIHUA,SHENTU JIANZHONG,ZHANG XIA,et al.Determination of mifepristone in plasma by high performance liquid chromatograph[J].Chinese Journal of Modern Applied Pharmacy,2003,20(1):65.
[6] STITH C,HUSSAIN MD.Determination of mifepristone levels in wild canid serum using liquid chromatography[J].Journal of Chromatography B,2003,794(1):9.
[7] GUO ZY,WANG S,WEI DY,et al.Development of a high-performance liquid chromatographic method for the determination of mifepristone in human plasma using norethisterone as an internal standard: application to pharmacokinetic study[J].Contraception,2007,76(1):228.
(責任編輯:姜付平)
Determination of mifepristone in plasma using HPLC method
Deng Jiexiong, Xiao Yangjuan,Yan Huifang
(1.Guangzhou Fourth Substation Institute For Drug Control, Guangzhou 510405,China;2.Liwan District Orthopedics Hospital of Guangzhou,Guangzhou 510140 China)
Objective:A convenient HPLC method was developd to determine the concentration of mifepristone in plasma.Methods:Solid-phase extration cartridges were used to extract plasma samples .Separation was carried out on a Phenomenex Synergi 4u Fusion-RP 80A C18(4.6mm×250mm,4μm)column maintained at 25℃ with methanol-water(75∶25) as mobile phase at a flow rate of 1.0mL·min-1.Norethisterone was employed as the internal standard. Dual wavelength was used, with norethisterone monitored at 240 nm and mifepristone at 302 nm.Results:The linearity range of mifepristone was 0.01~2.0μg·mL-1and the lowest limit of quantification was 0.01μg·mL-1, the regressive equation was Y = 1.6439X-0.0297,r=0.9998.Conclusion:The method was simple, accurate and sensitive. And it could be applied to study on the pharmacokinetics of mifepristone.
Mifepristone; Plasma Drug Concentration;Solid-Phase Extraction; Internal Standard; HPLC
2014-03-19
鄧潔雄(1962-),女,廣州市藥品檢驗所四分所主管藥師,研究方向為藥物分析。
R284
A
1673-2197(2014)11-0019-03

