探究氫氧燃料電池的工作原理
李聰芳
氫氧燃料電池是利用原電池的工作原理,將氫氣(燃料)和氧氣(氧化劑)反應所放出的化學能直接轉化為電能的裝置。高中化學教材必修2第二章第二節中給出了氫氧燃料電池的構造示意圖,課后題第5題以信息的形式給出了堿性電解質溶液中氫氧燃料電池的電極反應式,使學生有一個大體的印象,選修4第四章第二節中簡單介紹了它的工作原理,但學生們還是搞不清是怎樣產生電流的,難以相信氫氣和氧氣不經點燃就能反應,還能產生電流。本文詳細探究了氫氧燃料電池的工作原理,設計了簡單的實驗,以事實來說明,使學生心服口服。
一般原電池的工作原理是具有還原性的物質在一個電極上失去電子發生氧化反應,失去的電子通過導線流向另一個電極,在該電極上具有氧化性的物質接受電子發生還原反應,從而形成電子的定向移動,也就形成了電流。一般原電池的構成條件是:兩個活性不同金屬或導電的非金屬作電極,兩電極材料均插入電解質溶液,電極相連形成閉合回路。
理論上任何一個能自發進行的、放出能量的化學反應均能設計為原電池,氫氣和氧氣反應生成水就符合這一條件。將2H2+O2=2H2O?拆成兩個半反應,氧化反應為:H2-2e-=2H+?,還原反應為:O2+4e-+2H2O=4OH-,可見,失去電子和得到電子的物質是氣體,而氣體不能作為電極材料,必須有一個氣體可以依附的導電的載體。我選擇的是1號電池的碳棒:將一端磨尖(尖端放電,更有利于反應),為了使碳棒表面吸附更多的氣體,將表面進行一下處理,即在酒精噴燈上燒紅,然后迅速放入冷水,如此反復幾次,可使表面變得疏松,也可用熱的濃硝酸處理一下碳棒(不建議用,因會放出NO2氣體,有毒),效果也很好。碳棒處理好了,該選擇電解質溶液了。由于該電池的電解質溶液不參與反應,所以電解質溶液只要不影響電池的工作均可,酸性電解液如H2SO4溶液,堿性電解液如NaOH溶液,中性電解液如Na2SO4溶液均可。再有導線若干,裝置材料就完成了。
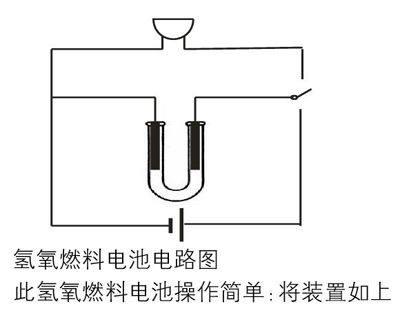
還有最重要的一個問題,即H2和O2的來源。實驗室中做氫氧燃料電池的實驗,若由外界通入H2和O2顯然比較復雜,所以我選用的是電解水產生H2和O2。生成的H2和O2吸附在碳棒上,利用碳棒上吸附的H2和O2構成氫氧燃料電池,用生日蠟燭中的電子發聲元件檢驗電流。為了快速的由電解水的電路轉化為燃料電池的電路,引入單刀雙擲開關,裝置見下圖
氫氧燃料電池電路圖
此氫氧燃料電池操作簡單:將裝置如上圖組裝好,打開電源,即可在兩極上觀察到明顯的氣泡產生,然后斷開電源,將單刀雙擲開關擲向另一端,馬上就能聽到生日歌,效果明顯,學生反響強烈。
這一實驗由廢電池的碳棒、泡沫塑料和實驗室中簡單的儀器制成氫氧燃料電池的裝置,具有電解水及燃料電池供電的雙重示范效果,是一套具有高效能和對環境友好的綠色實驗裝置,適合于電化學教學演示及學生親手做實驗,使我們在電化學的教與學上更為生動有趣,方便提高學生學習電化學這一知識板塊的興趣及學習成效。本專題通過對氫氧燃料電池工作原理的探究,使學生在自主的獲取知識、知識遷移、探索知識的形成過程等方面更為主動,符合新課程的教學理念。

