γ-氨基丁酸純化的研究
(烏魯木齊思科康達科技有限責任公司,烏魯木齊市,830000) 武建剛
γ-氨基丁酸(GABA)是中樞神經系統的抑制性神經遞質,具有重要的生理功能。目前,已有大量關于GABA生物合成方面的研究,但是關于GABA分離方面的研究報道卻不多,就γ-氨基丁酸純化進行研究,主要是γ-氨基丁酸分離、提取及與酶反應偶聯體系建立進行研究。
1 強酸性陽離子交換樹脂離子交換條件的研究
1.1 樹脂的預處理
用離子交換柱為內徑18mm,高400mm的柱子,柱子上下帶有封口,可以用恒流泵進行流速控制。
反洗:
取50mL樹脂,置于交換柱中,用去離子水進行反洗,樹脂的展開率為50-100%,直到樹脂中無可見機械雜質并出水澄清為止。
酸堿處理:
經反洗后的樹脂依次用50mL1mol/LHCl,100 mL去離子水,50mL1mol/LNaOH和100mL去離子水,自上而下通過樹脂層。試劑流量為2mL/min,去離子水流量為10mL/min。
基準型(Na型)樹脂的制備:
經酸堿處理的樹脂用400mL1mol/LNaCl溶液通過樹脂層,流速為14mL/min。然后用去離子水洗滌,直至用硝酸銀指示液檢測出液無白色沉淀時停止洗滌。將柱中樹脂全部轉入清潔的廣口瓶中。
H型樹脂的制備:
經酸堿處理的樹脂用400mL1mol/LHCl溶液通過樹脂層,流量為6mL/min。然后用去離子水洗滌,直至用甲基橙指示液檢驗流出液呈黃色時停止洗滌。將柱中樹脂全部轉入清潔的廣口瓶里待用。
1.2 過柱液組分預處理和裝柱樹脂體積的預估
以每100mL醋酸-醋酸鹽緩沖液(pH5.0,0.2 mol/L)計,含MSG1g,固定化酶15g,在1.5h內可完全反應(紙層析檢測不到MSG的斑點)。反應液中共含GABA5.34mmol(大部分以一價陽離子形態存在),主要的陽離子Na+14mmol,其他微量陽性離子忽略不計,反應液pH在5.5左右,此外溶液中還會存在破碎的海藻酸鈉等可見微粒。按理論值每升樹脂可以交換GABA2mol,交換反應中生成的GABA需要樹脂2.67mL,考慮到Na+的競爭吸附,則需要樹脂9.67mL,在本柱中體積約為3.8cm,反應液若以1mL/min的流速流速通過柱子,流程約0.4cm/min,此外考慮到離子交換過程中離子交換區所占的體積,為保證GABA能被充分交換,裝填的樹脂體積定為20mL,在柱中體積為7.9cm。
1.3 樹脂離子類型的選擇
Na型和H型預處理好的樹脂各取20mL,分別裝入離子交換柱,將配制好的100mL過柱液分別以1mL/min的流速通過樹脂層,收集流出液,檢測流出液中GABA含量,確定GABA是否被完全交換及最終選擇的樹脂離子類型。
1.4 過柱液流速的選擇
將配制好的100mL過柱液以1mL/min的流速通過樹脂層,收集流出液,檢測流出液中GABA含量,確定GABA是否被完全交換。重復以上實驗,但過柱液分別以2、3mL/min的流速通過樹脂層,檢測流出液中GABA含量,確定過柱液流速。
1.5 最大交換量的確定
將配制好的240mL過柱液以確定的最佳流速通過樹脂層,每收集30mL過柱液,測定其中GABA含量一次,并確定最大交換容量。
2 GABA的濃縮和結晶
2.1 洗脫液濃度的選擇
過柱液通過樹脂層后,用40mL2mol/L的氨水以1 mL/min的速度進行洗脫操作,收集洗脫液,測定其中GABA含量。重復以上實驗,但洗脫劑的濃度分別為1.6mol/L和1.4mol/L。
2.2 流速的選擇
過柱液通過樹脂層后,用最適的氨水濃度以1mL/min的速度進行洗脫操作,收集洗脫液,測定其中GABA含量。重復以上實驗,但洗脫劑的流速分別為2ml/min和3m l/min。
2.3 柱再生
進行洗脫操作后,用去離子水以10ml/min流速進行反洗至中性后,用1mol/LHCl洗至酸性后,用去離子水以10mL/min流速進行正洗至中性后即可。
2.4 濃縮和結晶
將洗脫液放入旋轉蒸發瓶中,在真空度0.085mpa、55~65℃下濃縮,至體積為原來體積的1/10左右(每100mL洗脫液濃縮至8~10mL),加入3~4倍體積的無水乙醇,攪拌、真空抽濾即得GABA體,將其收集并干燥為GABA成品。
3 酶柱反應及與分離偶聯
3.1 反應柱
為控制流速和保證反應充分進行,采用從柱子下端泵進反應液的模式。所采用的柱子上下封口,內徑為16mm,長度為20mm。柱子過長,會引起柱壓高,不便于反應液從底端泵入以及對固定化的酶造成壓力,迫使起破碎;柱子過短,固定化酶溶脹受阻,反應不能充分進行,也不利于反應生成的CO2由液體體系內上升并溢出。此外,柱子豎直置于37℃水浴中保溫,反應液于37℃水浴保溫后泵入。
3.2 反應液流速的控制
將100mL含1%MSG的醋酸-醋酸鹽緩沖液(pH5.0,0.2mol/L)由下經電腦恒流泵以1mL/min的速度泵入反應柱中,收集流出的反應液測定其中GABA含量。重復以上實驗,但反應液的速度分別為1.5mL/min和2mL/min,確定最佳的反應液流速。
3.3 最大反應量
將200mL含1%MSG的醋酸-醋酸鹽緩沖液(pH5.0,0.2mol/L)由下經電腦恒流泵以最佳的流速泵入反應柱中,每50mL收集一次流出的反應液并測定其中GABA含量,確定酶活損失情況及最大的反應量。
3.4 反應柱與交換柱相偶聯
將反應柱與交換柱相聯,如下圖1所示。
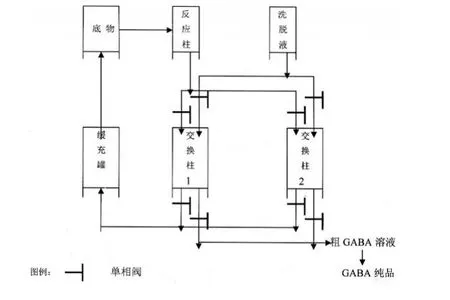
圖1 反應與分離裝置的連接
取200mL反應液,如圖1-1依次通過反應柱和離子交換柱后,對離子交換柱進行氨水洗脫,并對洗脫液真空濃縮收集GABA晶體。
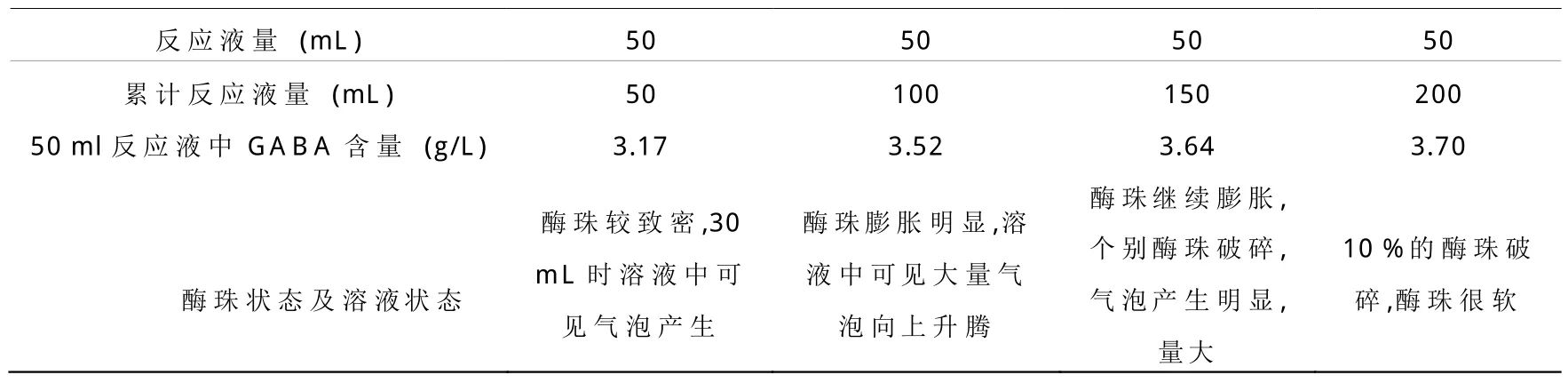
表1 最大反應量的確定
3.5 最大反應量
酶珠狀態及溶液狀態 酶珠較致密,30mL時溶液中可見氣泡產生酶珠膨脹明顯,溶液中可見大量氣泡向上升騰酶珠繼續膨脹,個別酶珠破碎,氣泡產生明顯,量大10%的酶珠破碎,酶珠很軟。
表1說明固定化酶在柱反應器中可以很好地反應,但主要的問題在于,柱反應器排氣不暢,柱壓過大,原因有三方面:⑴柱反應器液面較罐式反應器要高,酶珠單位面積所受壓力大;⑵酶珠在膨脹過程中相互擠壓和受到柱內壁的擠壓;⑶溶液中的CO2在向上升騰的過程中所造成的壓力。
因此,有必要針對此類產氣的固定化酶反應設計相關的柱。
3.6 反應柱與離子交換樹脂相偶聯
共獲得干燥的GABA晶體0.961g,是理論值的87.2%。主要的原因在于受傳質限制,酶反應沒有完全進行,此外反應柱、離子交換柱中的殘留反應液、洗脫液中的GABA,也是主要的損失來源。
4 總結
用于離子交換的樹脂為H型強酸性陽離子交換樹脂,過柱液的流速為3mL/min,采用2mol/L的氨水1mL/min的流速可以有效地將樹脂上的GABA洗脫下來,對洗脫液進行真空濃縮并加入適量的95%乙醇后可獲得GABA結晶。柱反應體系的最佳流速為1mL/mim,存在的主要問題在于柱壓過大導致的酶珠易碎。柱反應與產物分離可以很好的偶聯,能夠達到邊催化反應邊分離產物的目的。

