豬場廢水生產微生物絮凝劑發酵特性及動力學特征
郭俊元,信 欣,能子禮超,李劍鋒 (成都信息工程學院資源環境學院,四川 成都 610225)
微生物絮凝劑,由微生物代謝活動產生的具有絮凝活性的有機物質,以其環境友好和易降解的特點,成為環境治理領域的中堅力量[1-2].將有機物和氮磷含量豐富的廢水或廢棄物作為原材料生產微生物絮凝劑,一方面可以降低生產成本,另一方面可以實現廢水和廢棄物的資源化利用.豬場糞污是我國規模化畜禽養殖業的主要污染來源,豬場廢水中含有大量的有機物和氮磷,可為微生物的生長和代謝提供豐富的碳源、氮源和磷源[3-4].因此,利用豬場廢水生產微生物絮凝劑能夠降低生產成本,并實現資源化.邱國良等[5]通過向厭氧處理后的豬場廢水附加一定量的碳源和磷酸鹽生產微生物絮凝劑,考察了其絮凝性能[5].發酵動力學是研究微生物發酵過程中其生長和代謝之間相互關系的科學,目前多用經驗公式描述絮凝菌生長和產絮過程,鮮有建立菌體濃度、代謝產物濃度、pH值、溶解氧等工藝參數的控制方案[6-8].
試驗采用豬場廢水生產微生物絮凝劑,考察絮凝菌發酵過程中菌體濃度、代謝產物濃度、基質濃度、溶解氧、氨氮、總磷及pH值的變化規律,利用 Logistic和 Luedeking-Piret模型對絮凝菌生長和代謝產物生成的動力學過程進行擬合,以期為菌株發酵過程的優化提供先決條件,為提高經濟效益和實現工業化生產提供理論基礎.
1 材料與方法
1.1 試驗材料
1.1.1 試劑配制 CaCl2(分析純,天津恒興化學試劑制造公司),配制 10g/L的溶液.高嶺土(分析純,天津恒興化學試劑制造公司),配制 4g/L的懸濁液.NaOH和HCl(分析純,天津大茂化學試劑廠)均配制1mol/L的溶液.
1.1.2 微生物菌株和微生物絮凝劑 試驗所用菌株為紅平紅球菌(Rhodococcus erythropolis),保藏于中國典型微生物保藏中心,保藏號為ACCC.10543.微生物絮凝劑是菌株利用豬場廢水發酵制備的,豬場廢水中 COD和氨氮含量分別為1350,1283mg/L,廢水pH值為7.6.微生物絮凝劑的制備包括種子培養和發酵培養.種子培養基(g/L):蛋白胨 10,酵母粉 5,牛肉膏 2,NaCl 10,pH=7.0.挑取少許菌至 150mL種子培養基中,于發酵溫度30℃,搖床速度120r/min下培養得種子液.將種子液以2%(V/V)的接種量接種至121℃滅菌處理 30min的豬場廢水中(150mL),于發酵溫度 35℃,搖床速度 150r/min下發酵得到發酵液,采用丙酮(含0.07%的β-巰基乙醇)從發酵液中提取絮凝劑.所得絮凝劑為蛋白質類物質,紅外光譜圖顯示,絮凝劑中含有羥基,羧基以及含硫基團,其中 3430cm-1處的峰是—OH,1640cm-1處的峰為COO-的反對稱伸縮振動,1544cm-1是COO-的對稱伸縮振動,1620cm-1和 1082cm-1處的峰是CO[9-13].
1.2 試驗方法
1.2.1 微生物菌株生長量的測定 試驗采用比濁法測定菌體細胞密度,試驗過程中,以未接種的發酵培養基(采用相同的手段進行滅菌和發酵培養)作為對照組,對不同發酵階段的發酵液,使用分光光度計測定波長600nm處的OD值,可以反應本文絮凝菌的細胞數量.
1.2.2 絮凝率的測定 1.0L高嶺土懸液(4g/L)中加入5mL CaCl2溶液作為助凝劑,再加入2mL離心去菌體后的發酵液,常溫條件下,快速攪拌1.0min (180r/min),慢速攪拌 4.0min (80r/min),靜置 10min,取上清液,使用分光光度計測定波長550nm處的OD值(OD550),同時以2mL未接種的培養基作對照.計算公式如下:

式中: FR為絮凝率;A為絮凝后高嶺土懸液的OD550;B為高嶺土原懸濁液的OD550.
1.2.3 發酵動力學 Logistic動力學方程能很好地反應菌株生長過程中因菌體濃度的增加對自身生長的抑制作用,因此常用來表述菌株生長的動力學過程[14-15].Logistic方程如下:
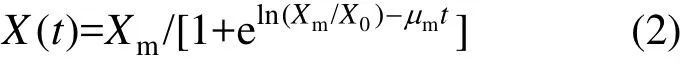
式中:X(t)為菌株濃度,g/L;X0為發酵初始菌株濃度,g/L;Xm為最大菌株濃度,g/L;t為發酵時間,h;μm為最大比生長速率,h-1.
Luedeking-Piret方程描述發酵過程中菌株生長和代謝產物生成之間的3種關系.(1)相關:代謝產物的生成伴隨著菌株生長,而且在菌株生長開始就有代謝產物生成,菌株生長進入穩定期后代謝產物的活性和生成量也達到最大,如寄生曲霉菌[16];(2)部分相關:菌株生長階段并無代謝產物生成,代謝產物是在菌株生長穩定期產生的,如地衣芽孢桿菌和假單胞菌[17];(3)不相關.如式(3)所示,當m1≠0,m2=0時,產物生成和菌株生長之間相關;當m1≠0,m2≠0時,產物生成和菌株生長之間部分相關;當m1=0,m2≠0時,表示產物生成和菌株生長之間不相關.
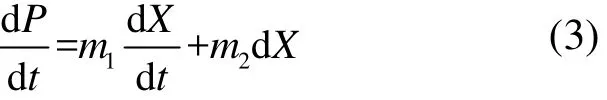
式中:P為絮凝劑產量,g/L;m1和m2分別是與菌株生長和菌株濃度相關的參數.
1.2.4 分析方法 COD濃度采用重鉻酸鉀法測定;氨氮采用鈉氏分光光度法測定;總磷采用鉬銻抗分光光度法測定;DO采用溶氧儀(HI2400)檢測;pH值采用多功能pH計(DELTA320A)檢測.
2 結果與討論
2.1 生長曲線
由圖1可知,菌株接種到豬場廢水培養基中,基本不存在滯后期,這是由于試驗中選擇的菌株菌齡和接種量較合適的原因.0~60h是菌株對數生長期,能充分利用豬場廢水中豐富的有機物和氮磷生長,菌體干重、細胞濃度 OD600和菌落數持續增加.12~36h,菌體干重、細胞濃度 OD600和菌落數分別由0.09g/L,0.26和1.3×107cfu迅速增加到0.76g/L,0.58和3.5×107cfu.菌株在60h進入穩定期,菌落數在66h達到最大(5×107cfu).78h菌株生長進入衰退期,菌體干重和細胞濃度 OD600依然有所增加,菌落數則逐漸減少.菌體干重的增加是由于其中不僅包含活菌株,還包含死亡的菌體;OD600的上升趨勢則歸因于菌死亡后引起的濁度增加;菌落數降低是由于其表述的是發酵過程中的活菌數,因此,菌落數的變化能夠反應細菌在發酵過程中的真實生長趨勢.
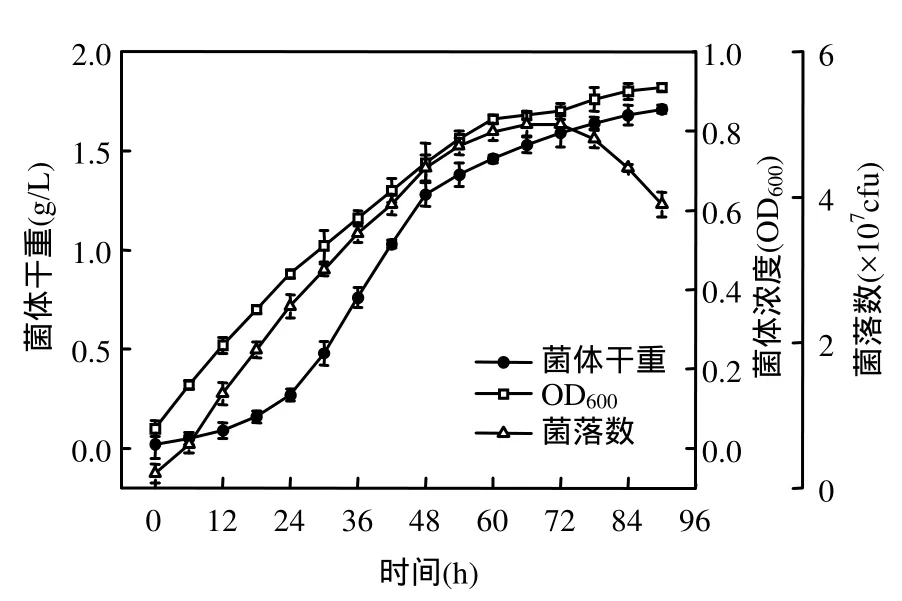
圖1 菌株的生長曲線Fig.1 Growth curve of the bacteria
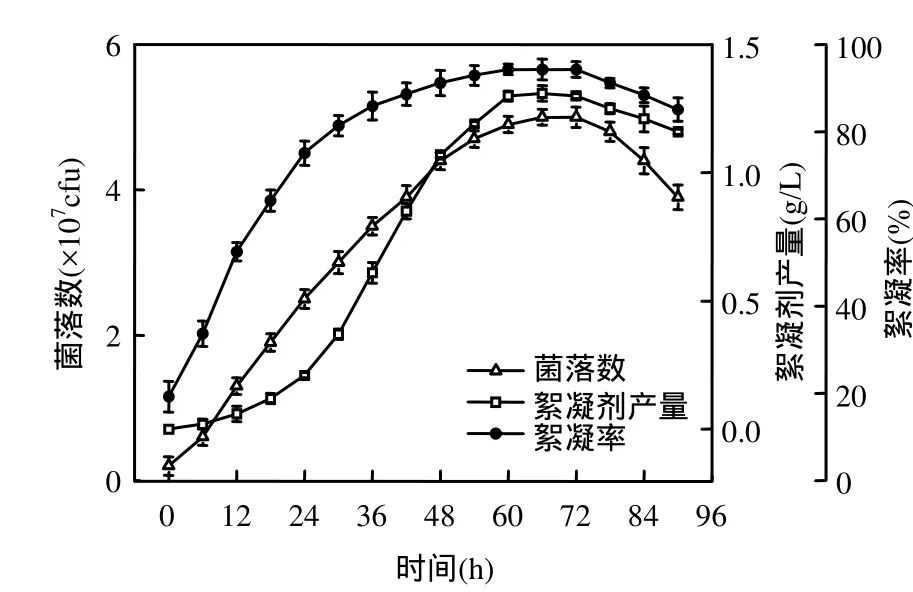
圖2 菌株生長與絮凝劑生產的關系Fig.2 Relations between growth and production
依據圖 1,計算菌株的繁殖代數n,生長速率常數R和世代時間G得:
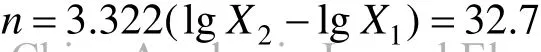

由圖 2可知,代謝產物的生成和積累基本上是伴隨著菌株的生長過程,當菌株進入穩定期后期時,菌落數達到最大的 5×107cfu,其代謝產物(1.31g/L)對高嶺土懸液(4.0g/L)的絮凝率也達到了最大的 94.3%,說明代謝產物的生成和菌株生長之間的關系屬于相關型.2.2 發酵過程參數分析
由圖 3可知,溶解氧僅在發酵初期維持較高水平,隨著絮凝菌的活躍生長和代謝,發酵液中的溶解氧迅速從初始狀態(0h)的4.5mg/mL下降至0.38mg/mL (12h),并一直維持在較低水平(0.55~0.75mg/mL),這是由于大量繁殖的細菌消耗了培養基中絕大部分溶解氧.由此可見,在絮凝菌生長過程中,培養初期較大的通氣量有利于絮凝劑的合成,同時可以避免菌體凝聚成顆粒,影響顆粒內部菌體對溶解氧的吸收和營養物質的攝入以及代謝產物向細胞外的擴散.
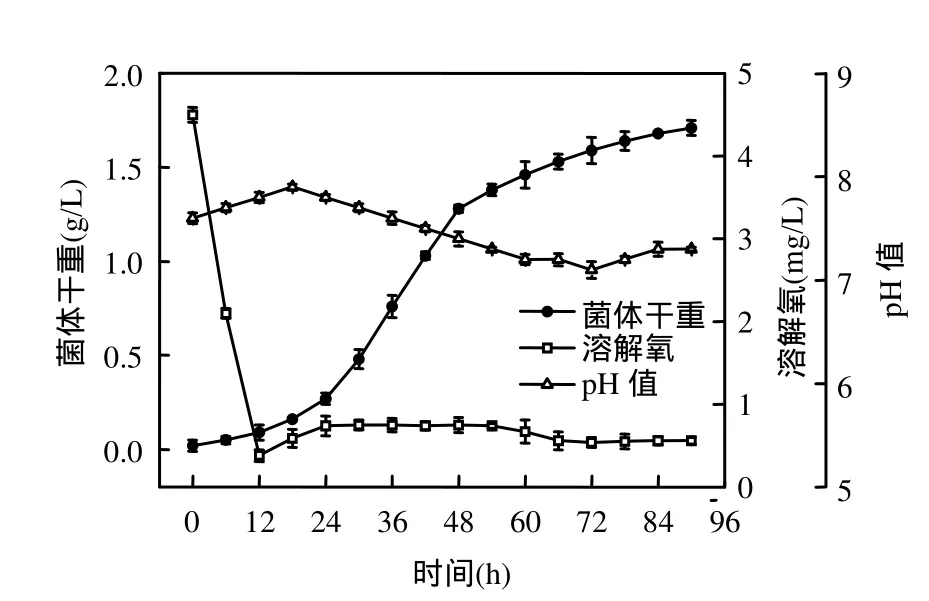
圖3 溶解氧、pH值隨菌株生長的變化Fig.3 Changes of DO and pH value with cell growth
發酵過程中pH值先上升再下降,pH值的上升是由于絮凝菌生長和代謝過程中消耗了培養基中的酸性多糖類物質,而代謝產物(蛋白質類絮凝劑)本身不含酸性多糖類物質.隨著菌體進入穩定期,pH值略有下降,此時溶解氧含量極少,使得其作為最終電子受體的作用減弱,絮凝菌以有機物氧化分解的中間代謝產物為最終電子受體進行發酵,產生有機酸等物質,導致了 pH值的下降.
由圖4可知,絮凝菌處于對數生長期時,培養基中 COD和氨氮含量分別迅速從 1350,1283mg/L降低到 273, 241mg/L.穩定期后期(66h),COD和總氮含量緩慢減少,并維持在低水平(220~251mg/L),這是由于在對數生長期,穩定期前期和中期菌體對有機物和氮源的利用速率較快.此外,衰亡期(78~90h)氨氮的含量緩慢回升,是由于菌體細胞大量死亡及菌體自溶致使胞內蛋白釋放到培養基中的緣故.
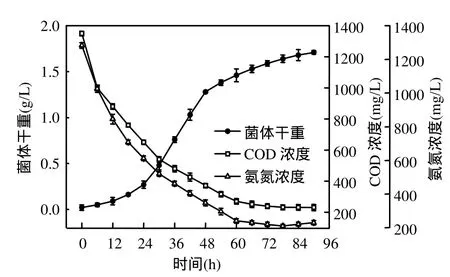
圖4 COD、氨氮隨菌株生長的變化Fig.4 Changes of COD and ammonium with cell growth

圖5 總磷、pH值隨菌株生長的變化Fig.5 Changes of TP and pH value with cell growth
由圖5可知,絮凝菌處于對數生長期時,總磷的含量迅速減少到 26mg/L.穩定期后期(66h),總磷含量緩慢減少,衰亡期(78~90h)總磷含量繼續下降,說明菌體在對數生長期、穩定期前期和中期對磷源的利用速率較快,磷不僅被菌株同化成為細胞組分,而且參與代謝過程中的磷酸化作用,用于貯存能量.此外,磷酸鹽作為緩沖劑,調節發酵過程中pH的變化.圖3和圖5中pH值先上升后下降,但整體變化并不顯著,這歸因于磷酸鹽的調節作用,當培養基中 H+濃度增加時,與弱堿性鹽(K2HPO4)結合形成弱酸性化合物,培養基 pH值不會過度降低;相反,pH 值也不會過度升高.總磷含量變化曲線中發現,培養基中的磷源含量充足,在發酵后期仍有殘留(11mg/L).
2.3 發酵動力學特征
發酵過程中,初始菌體干重X0=0.02g/L,最大菌體干重Xm=1.71g/L.對式(2)進行非線性擬合(圖 6a),得知μm=0.11.從而得到菌株生長動力學方程:
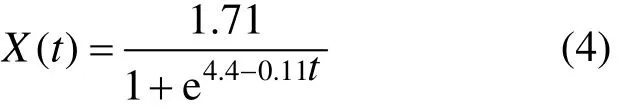
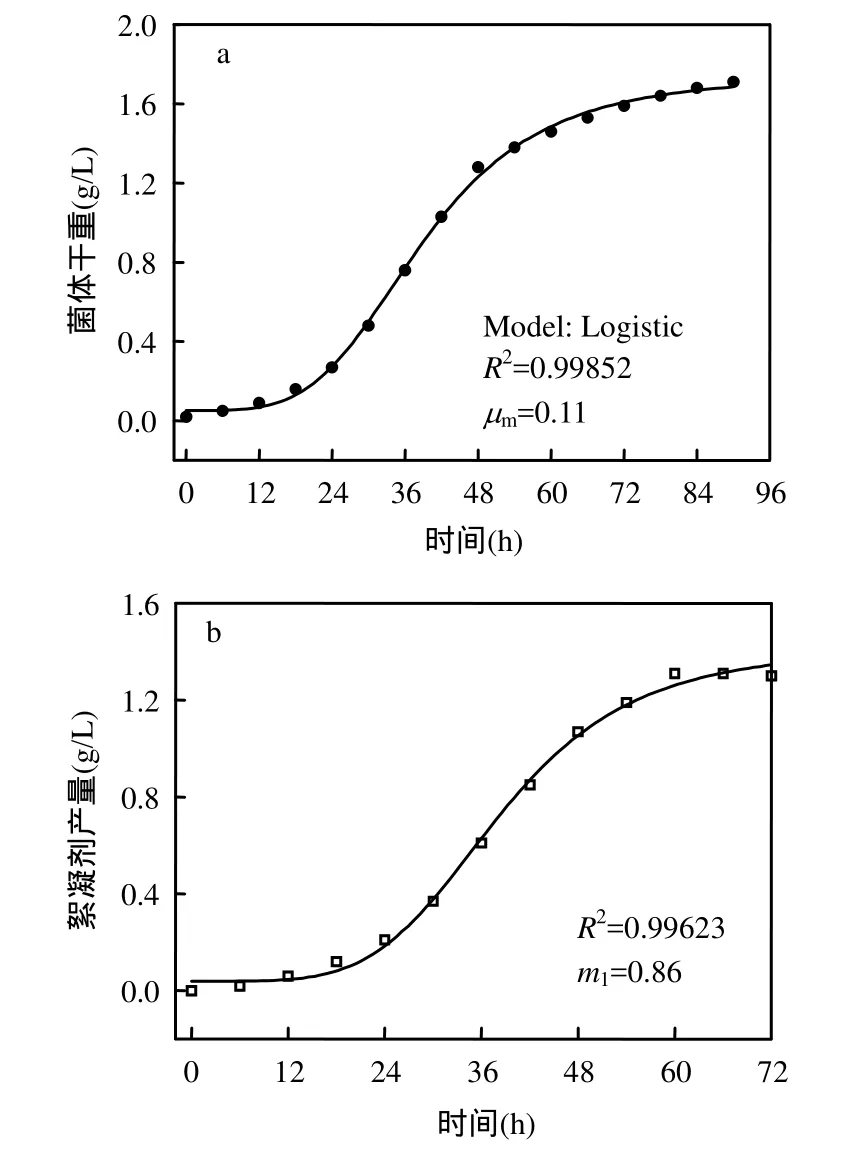
圖6 菌株生長和絮凝劑生產動力學模型擬合曲線Fig.6 Fitting curves of growth (a) and producing (b)kinetics model of the bacteria
對式(4)的菌株干重計算值與試驗過程中的實測值進行比較,排除發酵起始,平均相對誤差為7.8%<10%,計算值和實測值之間的擬合度R2=0.99852,說明該方程能夠較好地擬合試驗數據,并準確地描述菌株的生長過程.
由于菌株發酵過程中代謝產物的生成和菌株生長之間相關(m2=0),因此,菌株產絮凝劑的動力學研究主要集中在生長期和穩定期.對式(3)兩邊求導,整理后得出:
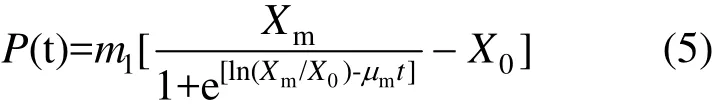
對式(5)進行非線性擬合(圖 6b),得知m1=0.86.從而得到絮凝劑生產動力學方程:
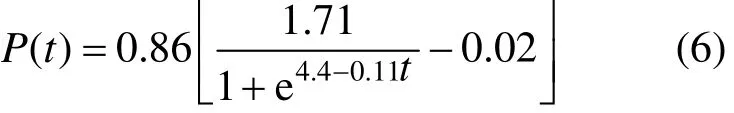
對式(6)的絮凝劑產量計算值與試驗過程中的實測值進行比較,在菌株生長期和穩定期內,平均相對誤差為 5.9%<10%,計算值和實測值之間的擬合度R2=0.99623,說明該方程能夠較好地擬合試驗數據,并準確地描述菌株產絮凝劑的動力學過程.
3 結論
3.1 由生長曲線可知,菌株在60h進入細胞增長的穩定期,菌落數達到最大的 5×107cfu,代謝產物(1.31g/L)對 4.0g/L高嶺土懸液的絮凝率達到最大的94.3%.
3.2 菌株發酵過程中,COD 和氮源(氨氮)在菌株生長過程中大量消耗;蛋白質作為主要絮凝活性成分,是菌株的主要代謝產物,與菌體生長呈相關型;磷酸鹽作為緩沖液,基本維持了菌株發酵過程中pH的恒定.
3.3 試驗對發酵過程中菌株生長和代謝產物生成的動力學過程進行了擬合,經計算,Logistic和Luedeking-Piret模型均較準確的模擬了其過程.
[1]Gong W X, Wang S G, Sun X F, et al. Bioflocculant production by culture ofserratia ficariaand its application in wastewater treatment [J]. Bioresource Technology, 2008,99(11):4668-4674.
[2]Yi T, Lee E H, Ahn Y G. Novel biodegradation pathways of cyclohexane byRhodococcussp. EC1[J]. Journal of Hazardous Materials, 2011,191(1-3):393-396.
[3]Tian Y. Behaviour of bacterial extracellular polymeric substances from activated sludge: a review [J]. International Journal of Environmental and Pollution, 2008,32(1):78-89.
[4]Drouin M, Lai C K, Tyagi R D, et al. Bacillus licheniformis proteases as high value added products from fermentation of wastewater sludge: pre-treatment of sludge to increase the performance of the process [J]. Water Science and Technology,2008,57(3):599-605.
[5]邱國良,楊春平,郭俊元,等.厭氧后豬場廢水資源化制備微生物絮凝劑 [J]. 環境工程學報, 2013,7(7):2506-2510.
[6]賀 力.假單胞菌M18G產PCA的發酵條件優化與動力學研究[D]. 上海:上海交通大學, 2008:41-56.
[7]邢 潔.絮凝菌F2產生物絮凝劑的發酵動力學及其活性成分分析 [D]. 哈爾濱:哈爾濱工業大學, 2009:44-54.
[8]劉 潔.菌株SHD-1發酵動力學及混合菌產絮凝劑的研究 [D].北京:中國石油大學, 2009:23-26.
[9]郭俊元,楊春平,曾光明,等.生物絮凝劑與改性沸石復配處理豬場廢水厭氧消化液的響應面優化 [J]. 中國環境科學, 2012,32(10):1309-1313.
[10]Guo J Y, Yang C P, Zeng G M. Treatment of swine wastewater using chemically modified zeolite and bioflocculant from activated sludge [J]. Bioresource Technology, 2013,143(9):289-297.
[11]Guo J Y, Yang C P, Peng L Y. Preparation and characteristics of bacterial polymer using pre-treated sludge from swine wastewater treatment plant [J]. Bioresource Technology, 2014,152(1):490-498.
[12]Ahmad H, Rajab A, Azni I, et al. Production and characterization of a bioflocculant produced byAspergillus flavus[J]. Bioresource Technology, 2013,127(1):489-493.
[13]Lian B, Chen Y, Zhao J, et al. Microbial flocculation byBacillus mucilaginosus: Applications and mechanisms [J]. Bioresource Technology, 2008,99(11):4825-4831.
[14]周長勝.絮凝劑產生菌GA1發酵動力學及絮凝性能的研究 [D].長沙:湖南大學, 2009:25-37.
[15]Xing J, Yang J X, Ma F, et al. Study on the Optimal Fermentation Time and Kinetics of Bioflocculant Produced byBacterium F2[J].Advanced Materials Research, 2010,113(7):2379-2384.
[16]Deng S B, Yu G, Ting Y P. Production of a bioflocculant byAspergillus parasiticusand its application in dye removal [J].Colloids and Surfaces B: Biointerfaces, 2005,44(4):179-18.
[17]Hideshi S, Hideo M, Yasuhiro S. Flocculation of diatomite by a soy protein-based bioflocculant [J]. Biochemical Engineering Journal, 2010,51(2):14-18.

