腸膜明串株菌Leuco 4的篩選、鑒定及產糖條件的優化
韓瑨,吳正鈞,季紅,高彩霞,游春蘋
(乳業生物技術國家重點實驗室,光明乳業股份有限公司,上海200436)
腸膜明串株菌Leuco 4的篩選、鑒定及產糖條件的優化
韓瑨,吳正鈞,季紅,高彩霞,游春蘋
(乳業生物技術國家重點實驗室,光明乳業股份有限公司,上海200436)
以M17蔗糖培養基為篩選模型,從云南泡菜中篩選得到一株高產多糖的菌株Leuco 4,經鑒定為腸膜明串珠菌(CGMCCNO.6432)。對該菌株進行產糖條件優化實驗后發現:在脫脂乳濃度10%(質量分數)、蔗糖濃度5%(w/v)、接種量2%(v/w)、發酵溫度28℃的條件下,180r/min搖床培養80h后發酵液中多糖含量可達到11g/L以上。
腸膜明串珠菌Leuco 4;脫脂乳蔗糖培養基;產糖條件優化
微生物胞外多糖是指某些特定微生物(如乳酸菌[1-2]、土壤桿菌[3]、根瘤菌[4-5]等)在生長代謝過程中分泌到細胞壁外的一類糖類化合物,其中,依附于微生物細胞壁外的多糖被稱為莢膜多糖,而黏液多糖則以滲透于生長環境中的形式存在。微生物胞外多糖不但可以賦予發酵乳制品特殊的風味[6],還具有一定的降血壓[7]、降血脂、免疫調節和抗腫瘤等保健功能[8-9]。隨著生活質量的不斷提高,食品添加劑(如增稠劑、乳化劑、穩定劑等)的安全問題越來越受到消費者的重視,因此,尋找來源明確、產量穩定、功能多樣的新型食品添加劑越來越受到研究者的重視。
明串珠菌(Leuconostoc)是一類乳品生產中重要的商業化菌株,屬于革蘭氏陽性菌。前期的研究表明,明串珠菌具有調節腸道紊亂[10]、代謝果糖生成甘露醇[11]、合成K族維生素[12]、水解α-半乳糖苷[13]、產細菌素[14]等益生功能,同時有助于形成干酪孔眼[15]、產生風味物質[16]。更重要的是,明串珠菌可在糖基轉移酶的作用下,利用蔗糖為底物合成右旋葡聚糖(dextran,多糖的一種)[17],具有增黏、穩定、乳化水體系以及持水性等特性[18],可作為天然來源的穩定劑或增稠劑來替代現有的合成添加劑應用于食品工業,因此,明串珠菌及其產糖特性已受到廣泛的重視。
本文報道了腸膜明串株菌Leuco 4的篩選、鑒定與產糖條件優化的過程,并比較了該菌株在脫脂乳蔗糖培養基和化學合成培養基中的產糖能力,旨在為明串珠菌的開發與應用提供理論依據。
1 材料與方法
1.1 試驗材料
試驗材料:云南泡菜,M17瓊脂/液體培養基(OXOID LTD.,英國),脫脂乳粉(Foterra,新西蘭),蔗糖,蛋白胨,酵母抽提物,K2HPO4,MgSO4·7H20,MnSO4,NaCl,CaCl2,FeSO4,三氯乙酸(上述材料均來自國藥集團化學試劑有限公司,上海)。
1.2 主要儀器設備
108H型電爐:Fisherscientific;HVE-50型高壓滅菌鍋:HIRAYAMA公司;SG-402TX型超凈工作臺:THE BAKERCOMPANY公司;XW-80A型漩渦混合儀:上海青浦滬西儀器廠;AVANTIJ30I型高速冷凍離心機:美國BECKMANCOULTER公司;FreeZone 12型真空冷凍干燥機;美國LABCONCO公司;DK-8D型電熱恒溫水槽、GNP-9270型隔水式恒溫培養箱:上海精宏實驗設備有限公司;PHS-25型pH計:美國奧立龍公司。
1.3 方法
1.3.1 菌種的篩選、保藏與鑒定
選取云南泡菜1 g放入50 mL無菌蒸餾水中,振搖2 min后,依次用無菌蒸餾水以10倍稀釋法逐管稀釋成10-1、10-2、10-3、10-4、10-5系列濃度,通過涂布的方式將稀釋液均勻涂布于無菌的M17蔗糖瓊脂培養基上,28℃好氧培養48 h后選取拉絲性好,菌落光滑有明顯突起的菌落反復接種于M17蔗糖瓊脂培養基上培養以達到純化的目的。用接種環挑取純化后的單菌落重懸于10%(質量分數)脫脂乳中,經冷凍干燥后-80℃保藏。
采用生理生化實驗結合16S rDNA基因序列比對的方法對菌株進行鑒定。
1.3.2 發酵種子的制備
將腸膜明串珠菌Leuco 4的凍干粉以少量無菌蒸餾水溶解,用接種環挑取一環劃線于M17蔗糖瓊脂培養[以5%(w/v)蔗糖取代M17培養基中0.5%(w/v)的乳糖,在120℃下滅菌20 min即得]上,28℃好氧培養24 h取出,用接種環挑取單菌落接入1 mL M17蔗糖液體培養基中,采用渦旋混合儀將細胞均勻分散后,28℃、180 r/min搖床培養48 h取出,再以2%(體積分數)接種量接種于50 mL上述M17蔗糖液體培養基中,再次于28℃、180 r/min搖床培養48 h,將培養物15000r/min離心10 min,棄去上清,沉淀部分以無菌蒸餾水洗滌2次后,用原培養體積的無菌蒸餾水懸浮,得到發酵用的種子。
1.3.3 發酵培養基的制備
脫脂乳蔗糖培養基的制備:將6.0%~12.0%(質量分數)脫脂乳粉與2.5%~10.0%(w/v)蔗糖按一定配比與蒸餾水混勻,充分溶解后,在120℃下滅菌20 min即得所需濃度的無菌脫脂乳蔗糖培養基。
化學合成培養基的制備:將蛋白胨10 g、酵母抽提物5 g、蔗糖50 g、K2HPO420 g、MgSO4·7H20 0.2 g、MnSO40.01 g、NaCl 0.01 g、CaCl20.02 g、FeSO40.01 g與1 L蒸餾水混勻,充分溶解后,在120℃下滅菌20 min即得所需的無菌化學合成培養基。
1.3.4 多糖的制備
將發酵液在沸水浴30 min,冷卻至室溫后加入三氯乙酸,使其終濃度達到2%~4%(體積分數),16 h靜置,15 000 r/min離心10 min,取上清,加入3倍(體積分數)的80%~100%乙醇于上述離心后的上清液中,靜置過夜,15 000 r/min離心10 min,收集沉淀物并溶于蒸餾水,用截留量為10000U的透析袋在蒸餾水中透析48h,每8小時換水1次,袋內透析液經真空冷凍干燥即可。
1.3.5 產糖條件的優化
1.3.5.1 不同接種量對腸膜明串珠菌Leuco 4多糖產量的影響
分別將腸膜明串珠菌Leuco4種子液按0.5%、1.0%、2.0%、4.0%(體積分數)的接種量接入脫脂乳蔗糖培養基中,該培養基含脫脂乳10%(質量分數)、蔗糖5%(w/v),28℃、180 r/min搖床培養,并于不同的培養時間,取發酵液按1.3.4所述方法制備多糖并稱重。
1.3.5.2 不同脫脂乳濃度對腸膜明串珠菌Leuco 4多糖產量的影響
分別將腸膜明串珠菌Leuco 4種子液以2%的接種量接入脫脂乳含量為6%、8%、10%、12%(質量分數),蔗糖含量為5%(w/v)的脫脂乳蔗糖培養基中,28℃、180 r/min搖床培養48 h,發酵終點處的發酵液按1.3.4所述方法制備多糖并稱重。
1.3.5.3 不同蔗糖濃度對腸膜明串珠菌Leuco 4多糖產量的影響
分別將腸膜明串珠菌Leuco 4種子液以2%的接種量接入脫脂乳含量為10%(質量分數),蔗糖含量為2.5%、5.0%、7.5%、10%(w/v)的脫脂乳蔗糖培養基中,28℃、180 r/min搖床培養48 h,發酵終點處的發酵液按1.3.4所述方法制備多糖并稱重。
1.3.5.4 不同發酵溫度對腸膜明串珠菌Leuco 4多糖產量的影響
將腸膜明串珠菌Leuco 4種子液以2%(體積分數)接種量接入脫脂乳蔗糖培養基中,該脫脂乳蔗糖培養基中含脫脂乳10%(質量分數),蔗糖5%(w/v),分別置于25、28、31、34℃、轉速為180 r/min的搖床培養48 h,發酵終點處的發酵液按1.3.4所述方法制備多糖并稱重。
1.3.5.5 腸膜明串珠菌Leuco 4在脫脂乳蔗糖培養基和純化學培養基中的產糖能力比較
將腸膜明串珠菌Leuco 4種子液以2%(體積分數)接種量接入脫脂乳蔗糖培養基和化學合成培養基中,該脫脂乳蔗糖培養基中含脫脂乳10%(質量分數),蔗糖5%(w/v),28℃、180 r/min搖床培養120 h,取不同培養時間的發酵液按按1.3.4所述方法制備多糖并稱重。
2 結果與討論
2.1 菌種的篩選與鑒定
純化后獲得的菌株Leuco 4在M17蔗糖瓊脂培養基上呈乳黃色、黏性的菌落,見圖1。進一步對其進行的生理生化實驗結果見表1。
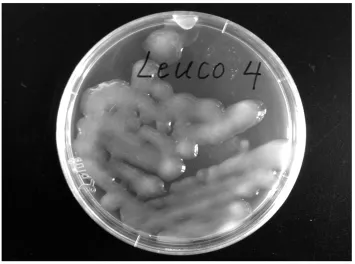
圖1 腸膜明串珠菌Leuco 4在M17蔗糖瓊脂培養基上的菌落形態Fig.1 Morphologic characteristic of Leuconostoc mesenteroides Leuco 4 growth on M17-sucrose media
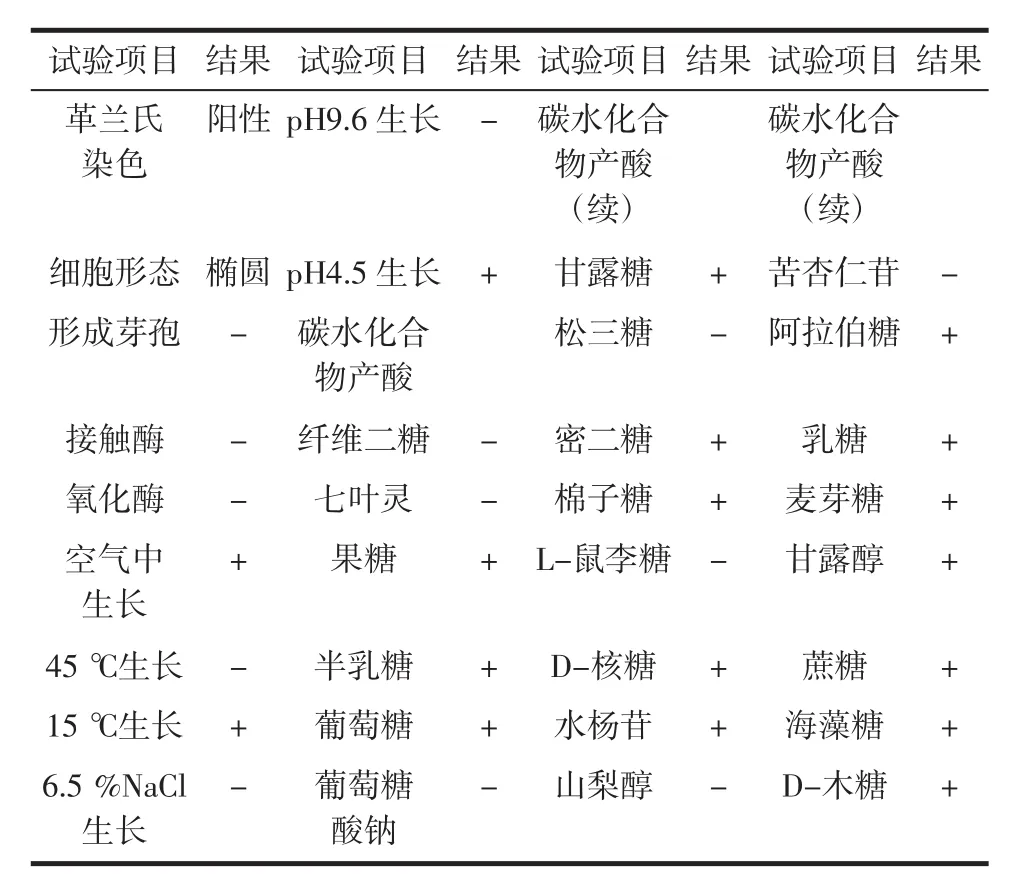
表1 腸膜明串珠菌Leuco 4的生理生化特性Table 1 Physiological and biochemical characteristics ofLeuconostoc mesenteroides Leuco 4
該結果結合其16S rDNA序列(未列出)顯示Leuco 4為一株腸膜明串珠菌,現保藏于中國微生物菌種保藏管理委員會普通微生物中心(CGMCC),編號為CGMCC NO.6432。
2.2 產糖條件的優化
2.2.1 接種量對腸膜明串珠菌Leuco 4多糖產量的影響
將腸膜明串珠菌Leuco 4的發酵種子液以不同接種量接入含有脫脂乳10%(質量分數)、蔗糖5%(w/v)的培養基中,28℃、180 r/min搖床培養,測定不同時間獲得的發酵液中多糖的含量,接種量對腸膜明串珠菌Leuco 4多糖產量的影響見圖2。
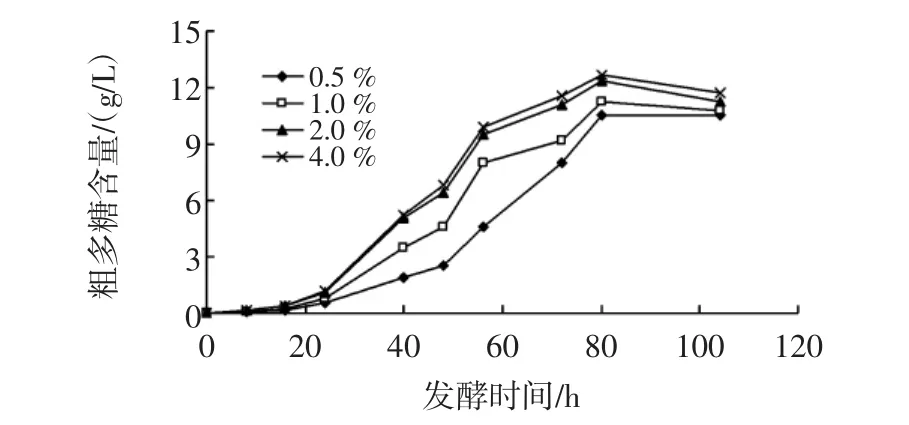
圖2 接種量對腸膜明串珠菌Leuco 4多糖產量的影響Fig.2 Effect of inoculation ratio on polysaccharide-production of Leuconostoc mesenteroides Leuco 4
在發酵前20小時,不同接種量的發酵液中多糖含量差異不顯著,說明在發酵初期,Leuco 4在脫脂乳蔗糖培養基中的增殖速率緩慢,不同接種量之間明串珠菌的生長差異不明顯,因此產生的多糖含量相差不多。
隨著發酵時間的延長,在20h至80h這段時間里,不同接種量的發酵液中多糖含量均呈明顯上升趨勢,菌株代謝蔗糖產多糖的能力逐漸增強。從圖中可以看出,在相同的取樣時間點,接種量越大的發酵液中多糖含量越高,如56h的各發酵液中多糖含量分別為:4.6g/L(0.5%)、8.0 g/L(1.0%)、9.5 g/L(2.0%)、9.9 g/L(4.0%)。
當發酵時間大于80 h時,各發酵液中累積的多糖總量不再增加,說明Leuco合成與消耗多糖的速率達到相對穩定狀態,導致單位體積的發酵液中多糖總量也慢慢開始趨于穩定或減少量。
比對2.0%(體積分數)和4.0%(體積分數)接種量的發酵液中多糖含量后發現,兩者對Leuco 4的產糖量影響無顯著差異(P>0.05)。考慮到工業化生產的效率和經濟因素,后續實驗均采用2.0%(體積分數)接種量作為最適接種量。
2.2.2 脫脂乳濃度對腸膜明串珠菌Leuco 4多糖產量的影響
將腸膜明串珠菌Leuco 4的發酵種子液以2%(體積分數)接種量分別接入脫脂乳含量為6%、8%、10%、12%(質量分數),蔗糖含量為5%(w/v)的脫脂乳蔗糖培養基中,28℃、180 r/min搖床培養48 h,測定發酵終點處的發酵液中多糖含量,脫脂乳濃度對腸膜明串珠菌Leuco 4多糖產量的影響見圖3。
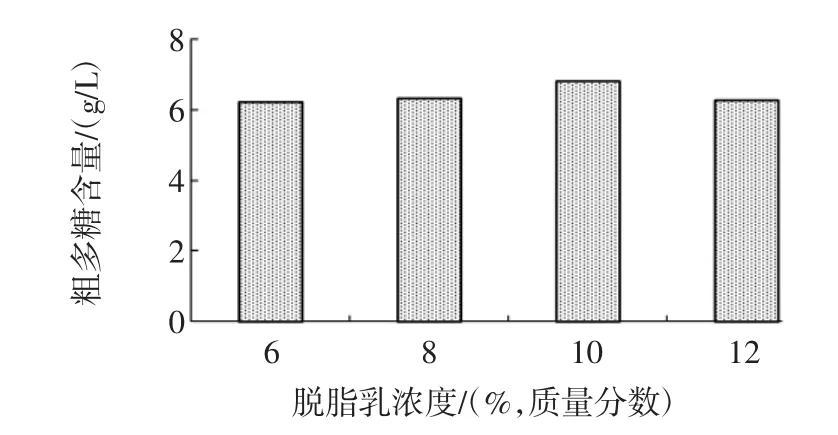
圖3 脫脂乳濃度對腸膜明串珠菌Leuco 4多糖產量的影響Fig.3 Effect of skimmed milk concentration on polysaccharideproduction of Leuconostoc mesenteroides Leuco 4
不同脫脂乳濃度的發酵液中多糖含量處于同一水平,分別為:6.3 g/L(6%),6.4 g/L(8%),6.7 g/L(10%),6.2 g/L(12%),以上數據顯示脫脂乳濃度對腸膜明串珠菌Leuco 4多糖產量的影響不顯著(P>0.05),考慮到脫脂乳濃度10%(質量分數)的發酵液中多糖含量相對較高,因此,選用10%(質量分數)為最適脫脂乳濃度。2.2.3 蔗糖濃度對腸膜明串珠菌Leuco 4多糖產量的影響
分別將腸膜明串珠菌Leuco 4種子液以2%的接種量接入脫脂乳含量為10%(質量分數),蔗糖含量為2.5%、5.0%、7.5%、10%(w/v)的脫脂乳蔗糖培養基中,28℃、180 r/min搖床培養48 h,測定發酵終點處的發酵液中多糖含量,蔗糖濃度對腸膜明串珠菌Leuco 4多糖產量的影響見圖4。
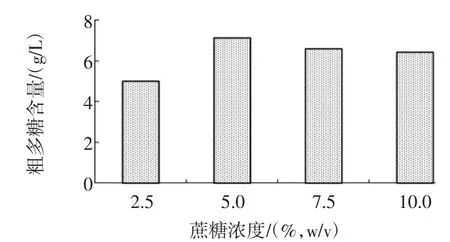
圖4 蔗糖濃度對腸膜明串珠菌Leuco 4多糖產量的影響Fig.4 Effect of sucrose concentration on polysaccharideproduction of Leuconostoc mesenteroides Leuco 4
蔗糖濃度對腸膜明串珠菌Leuco 4多糖產量的影響可能與培養基中代謝底物充分度和滲透壓大小的有關。不難理解,過低的蔗糖濃度會因代謝底物不充足而使多糖產量縮減,過高的蔗糖濃度則會因滲透壓過高而降低Leuco 4細胞膜的通透性,從而降低了菌株的活力,同樣會影響目標產物的合成。從圖4中可知,腸膜明串珠菌Leuco 4在蔗糖濃度5%(w/v)的脫脂乳蔗糖培養基中代謝蔗糖產生的多糖含量最高,為7.1 g/L,說明蔗糖濃度5%(w/v)的培養基對腸膜明串珠菌Leuco 4而言代謝底物充沛、滲透壓力適中,是Leuco 4發酵產多糖的最佳蔗糖濃度。
2.2.4 發酵溫度對腸膜明串珠菌Leuco 4多糖產量的影響
將腸膜明串珠菌Leuco 4種子液以2%(體積分數)接種量接入上述方法制備的脫脂乳蔗糖培養基中,該脫脂乳蔗糖培養基中含脫脂乳10%(質量分數),蔗糖5%(w/v),分別置于25、28、31、34℃、180 r/min搖床培養48 h,測定發酵終點處的發酵液中多糖含量,發酵溫度對腸膜明串珠菌Leuco 4多糖產量的影響見圖5。
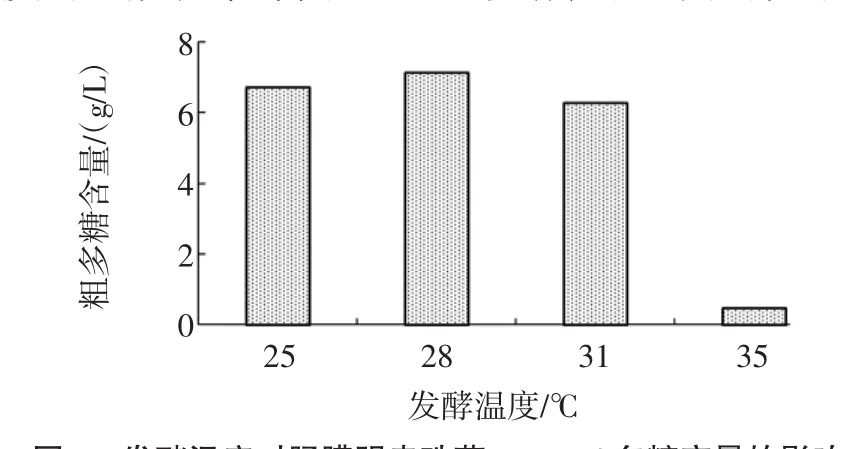
圖5 發酵溫度對腸膜明串珠菌Leuco 4多糖產量的影響Fig.5 Effect of fermentation temperature on polysaccharideproduction of Leuconostoc mesenteroides Leuco 4
如圖5所示,腸膜明串珠菌Leuco 4在28℃條件下在相同濃度的脫脂乳蔗糖培養基中合成與積累多糖的能力最強。這可能是由于28℃發酵有利于Leuco 4利用蔗糖代謝產生胞外多糖。因此,28℃是腸膜明串珠菌Leuco 4的最優發酵溫度。
2.2.5 腸膜明串珠菌Leuco 4在脫脂乳蔗糖培養基和化學合成培養基中的產糖能力比較
將腸膜明串珠菌Leuco 4種子液以2%(體積分數)接種量接入脫脂乳蔗糖培養基和純化學培養基中,該脫脂乳蔗糖培養基中含脫脂乳10%(質量分數),蔗糖5%(w/v),28℃、180 r/min搖床培養120 h,測定不同時間獲得的發酵液中多糖的含量,Leuco 4在不同培養基中的產糖能力比較見圖6。
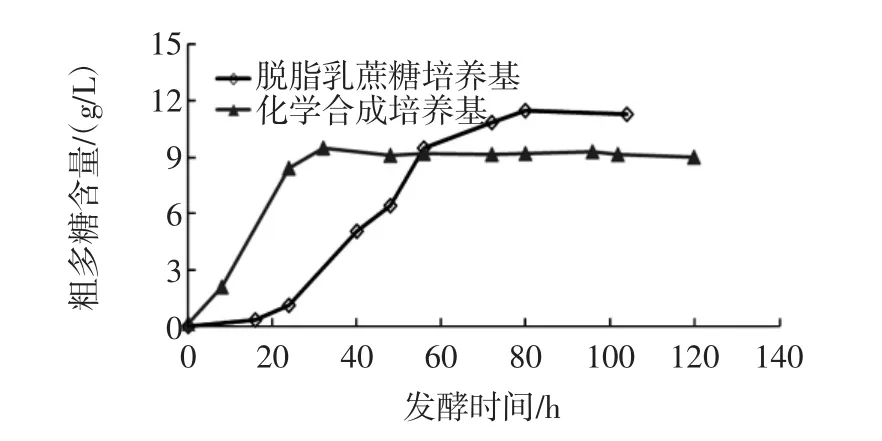
圖6 腸膜明串珠菌Leuco 4在脫脂乳蔗糖培養基和化學合成培養基中的產糖能力Fig.6 Polysaccharide-production of Leuconostoc mesenteroides Leuco 4 fermenting in skimmed milk-sucrose meida and chemically defined medium
從發酵時間來看,腸膜明串珠菌Leuco 4在化學合成培養基中發酵產多糖的峰值出現在32 h,而在脫脂乳蔗糖培養基中達到峰值耗時80 h,上述數據表明Leuco 4在化學合成培養基中的增殖速率顯著高于脫脂乳蔗糖培養基,這可能是兩者組分構架的差異性造成的。在化學合成培養基中含有的營養成分相對全面和充足,蛋白胨、酵母抽提物等一應俱全,而脫脂乳中有營養組分相對單一和貧乏,只有乳蛋白、乳糖、乳礦物鹽和少量維生素,因此,前者對Leuco 4促生長作用更強,其產糖量也隨著菌株的迅速繁殖而大大增強。
從多糖產量來看,Leuco 4發酵化學合成培養基的多糖為9.5 g/L,而在脫脂乳蔗糖培養基中該產量可高達11.5 g/L,這可能是脫脂乳中的乳蛋白與乳礦物鹽協同發揮了緩沖作用的結果,一定程度緩和了菌株代謝產酸破壞生境的狀況,從而大大提高了菌株的存活率,因此,最終累積的多糖量更高。
3 討論
從上個世紀中期開始,對明串珠菌進行了廣泛的研究,包括化學合成培養基的設計[19]、細菌素的產生[20]、在乳中與乳球菌的共同發酵特性[21]等,這些研究成果為明串珠菌的應用提供了扎實的理論基礎與技術支持。此外,隨著各種高通量篩選模型的出現[22],具有各種功能的明串珠菌相繼被發掘(Leuconostoc mesenteroides CMG713[23],Leuconostoc palmae sp.nov.TMW 2.694T[24],Leuconostoc mesenteroides FT045B[25]等)。
然而,有關提高明串珠菌多糖產量的報道相對較少。C Moulis(2006年)運用分子生物學的方法,利用大腸桿菌來表達Leuconostoc mesenteroides NRRL B-512F的蔗糖酶序列,獲得了穩定、高活性的目標產物[26]。A Majumder則通過響應面法對化學合成培養基中的11種營養組分進行系統分析,發現吐溫、蔗糖和H2PO4是影響Leuconostoc dextranicum NRRL B-1146蔗糖酶產量的關鍵因素[27],在蔗糖5.95%、蛋白胨0.52%、酵母抽提物2.9%的培養基中Leuconostoc dextranicum NRRL B-1146發酵產糖能力最強,為1 063 mg/L[28]。A Singh(2009) 借助紫外線照射的方法來誘導Leuconostoc dextranicum NRRL B-1146突變,最終篩選得到一株多糖產量高于出發菌株5倍的突變株[29]。不難發現,上述報道無一例外地以化學合成培養基為明串珠菌的發酵基料,而用天然食品為基料產糖至今無報道。
本文以一株自主篩選獲得并保藏的腸膜明串株菌Leuco 4為基礎,研究其在脫脂乳蔗糖培養基糖特性,結果表明,在脫脂乳濃度10%(質量分數)、蔗糖濃度5%(w/v)、接種量2%(v/w)、發酵溫度28℃的條件下,180 r/min搖床發酵80 h的脫脂乳蔗糖發酵液中多糖含量可達到11 g/L以上,產糖量高于化學合成培養基,但產糖過程相對緩慢。鑒于這類天然產物來源的多糖在食品安全方面的應用潛力越來越大,有關明串珠菌Leuco 4快速發酵脫脂乳蔗糖培養基產糖的研究值得進一步的展開。
4 結論
采用M17蔗糖瓊脂的方法,從傳統發酵食品中篩選到一株高產多糖的明串菌株Leuco 4,經鑒定為腸膜明串珠菌(CGMCC NO.6432);該菌在脫脂乳濃度10%(質量分數)、蔗糖濃度5%(w/v)、接種量2%(v/ w)、發酵溫度28℃的條件下,180 r/min搖床發酵80 h后,多糖產量可達到11 g/L以上。
[1]AI L Z,ZHANG H,GUO B H,et al.Preparation,partial characterization and bioactivity of exopolysaccharides from Lactobacillus casei LC2W[J].Carbohydr Polym,2008,74(3):353-357
[2]PATEL S,MAJUMDER A,GOYAL A.Potentials of exopolysaccharides from lactic acid bacteria[J].Indian Journal of Microbiology, 2012,52(1):3-12
[3]RUFFING A M,CHEN R R.Transcriptome profiling of a curdlanproducing Agrobacterium reveals conserved regulatory mechanisms of exopolysaccharide biosynthesis[J].Microbial Cell Factories,2012, 11:17
[4]DJORDJEVIC S P,CHEN H,BATLEY M,et al.Nitrogen fixation ability of exopolysaccharide synthesis mutants of Rhizobium sp. strain NGR234 and Rhizobium trifolii is restored by the addition of homologous exopolysaccharides[J].Journal of bacteriology,1987, 169(1):53-60
[5]LEIGH J A,WALKER G C.Exopolysaccharides of Rhizobium:Synthesis,regulationandsymbioticfunction[J].Trends in Genetics,1994, 10(2):63-67
[6]VEDAMUTHU E R.The Dairy Leuconostoc:Use in Dairy Products [J].Journal of Dairy Science,1994,77(9):2725-2737
[7]AI L-Z,GUO B-H,ZHANG H,et al.Isolation and antihypertensive effect of exopolysaccharides from Lactobacillus casei LC2W[J]. Milchwissenschaft-Milk Science International,2008,63(1):3-6
[8]DE VUYST L,DEGEEST B.Heteropolysaccharides from lactic acid bacteria[J].FEMS Microbiology Reviews,1999,23(2):153-177
[9]RUAS-MADIEDO P,HUGENHOLTZ J,ZOON P.An overview of the functionality of exopolysaccharides produced by lactic acid bacteria[J].International Dairy Journal,2002,12(2/3):163-171
[10]AGARWAL K N,BHASIN S K.Feasibility studies to control acute diarrhoea in children by feeding fermented milk preparations Ac-timel and Indian Dahi[J].European Journal of Clinical Nutrition, 2002,56:S56-S59
[11]VON WEYMARN N,HUJANEN M,LEISOLA M.Production of D-mannitol by heterofermentative lactic acid bacteria[J].Process Biochemistry,2002,37(11):1207-1213
[12]SYBESMA W,STARRENBURG M,TIJSSELING L,et al.Effects of cultivation conditions on folate production by lactic acid bacteria [J].Applied and Environmental Microbiology,2003,69(8):4542-4548
[13]HUANG D Q,PREVOST H,DIVIES C.Principal characteristics of alpha-galactosidase from Leuconostoc mesenteroides subsp.mesenteroides[J].Journal of Basic Microbiology,1994,34(2):87-95
[14]STILES M E.Bacteriocins Produced by Leuconostoc Species[J]. Journal of Dairy Science,1994,77(9):2718-2724
[15]HEMME D,FOUCAUD-SCHEUNEMANN C.Leuconostoc,characteristics,use in dairy technology and prospects in functional foods [J].International Dairy Journal,2004,14(6):467-494
[16]LIU S Q,ASMUNDSON R V,HOLLAND R,et al.Acetaldehyde metabolism by Leuconostoc mesenteroides subsp.cremoris under stress conditions[J].International Dairy Journal,1997,7(2/3):175-183
[17]MONCHOIS V,WILLEMOT R-M,MONSAN P.Glucansucrases: Mechanism of action and structure-function relationships[J].FEMS Microbiology Reviews,1999,23(2):131-151
[18]KORAKLI M,VOGEL R F.Structure/function relationship of homopolysaccharide producing glycansucrases and therapeutic potentialoftheirsynthesisedglycans[J].AppliedMicrobiologyandBiotechnology,2006,71(6):790-803
[19]KIM Y J,EOM H-J,SEO E-Y,et al.Development of a chemically defined minimal medium for the exponential growth of Leuconostoc mesenteroides ATCC8293[J].Journal of Microbiology and Biotechnology,2012,22(11):1518-1522
[20]H CHARD Y,D RIJARD B,LETELLIER F,et al.Characterization and purification of mesentericin Y105,an anti-Listeria bacteriocin from Leuconostoc mesenteroides[J].Journal of General Microbiology,1992,138(12):2725-2731
[21]BELLENGIER P,RICHARD J,FOUCAUD C.Associative growth of Lactococcus lactis and Leuconostoc mesenteroides strains in milk [J].Journal of Dairy Science,1997,80(8):1520-1527
[22]BENKERROUM N,MISBAH M,SANDINE W E,et al.Development and use of a selective medium for isolation of Leuconostoc spp. from vegetables and dairy products[J].Applied and environmental microbiology,1993,59(2):607-609
[23]SARWAT F,UL QADER S A,AMAN A,et al.Production&characterization of a unique dextran from an indigenous Leuconostoc mesenteroides CMG713[J].International Journal of Biological Sciences,2008,4(6):379-386
[24]EHRMANN M A,FREIDING S,VOGEL R F.Leuconostoc palmae sp nov.,a novel lactic acid bacterium isolated from palm wine[J].International Journal of Systematic and Evolutionary Microbiology, 2009,59:943-947
[25]PALMUTI BRAGA VETTORI M H,MARTINS FRANCHETTI S M, CONTIERO J.Structural characterization of a new dextran with a low degree of branching produced by Leuconostoc mesenteroides FT045B dextransucrase[J].Carbohydr Polym,2012,88(4):1440-1444
[26]MOULIS C,ARCACHE A,ESCALIER P-C,et al.High-level production and purification of a fully active recombinant dextransucrase from Leuconostoc mesenteroides NRRL B-512F[J].Fems Microbiology Letters,2006,261(2):203-210
[27]MAJUMDER A,GOYAL A.Enhanced production of exocellular glucansucrase from Leuconostoc dextranicum NRRL B-1146 using response surface method[J].Bioresource Technology,2008,99(9): 3685-3691
[28]MAJUMDER A,SINGH A,GOYAL A.Application of response surface methodology for glucan production from Leuconostoc dextranicum and its structural characterization[J].Carbohydr Polym,2009, 75(1):150-156
[29]SINGH A,MAJUMDER A,GOYAL A.Mutagenesis of Leuconostoc dextranicum NRRL B-1146 for higher glucan production[J].Inter J Microbiol,2009,7(1):1-7
Screening,Identification and Polysaccharide Biosynthesis Condition Optimization of Leuconostoc mesenteroides Leuco 4
HAN Jin,WU Zheng-jun,JI Hong,GAO Cai-xia,YOU Chun-ping
(State Key Laboratory of Dairy Biotechnology,Bright Dairy&Foods Co.,Ltd.,Shanghai 200436,China)
A bacterial strain Leuco-4 capable of expressing high yield of exopolysaccharide on M17-sucrose agar was isolated from pickles of Yunnan and was identified as Leuconostoc mesenteroides(CGMCC NO.6432).The optimized conditions for Leuco 4 to biosynthesize polysaccharides was found to be a combination of 10%(w/w)skimmed milk,sucrose concentration of 5%(w/v),inoculation ratio of 2%(v/w),fermentation temperature of 28℃,respectively.After cultivated aerobically at shaker of 180 r/min for 80 hours under the optimized conditions,the polysaccharide in the fermentation broth of L.mesenteroides Leuco-4 reached 11 g/L.
Leuconostoc mesenteroides Leuco 4;skimmed milk-sucrose media;polysaccharide
10.3969/j.issn.1005-6521.2014.19.030
2013-07-01
“十二五”國家科技支撐計劃課題:發酵乳制品乳酸菌菌種與發酵劑的研究與開發(2013BAD18B01);“十二五”國家863項目:優良益生菌高效篩選與應用關鍵技術(2011AA100901)
韓瑨(1980—),男(漢),工程師,碩士,研究方向:乳品科學專業。

