誤差理論和概率論在食品化學分析中的應用
翟卉
(農業部乳品質量監督檢驗測試中心,天津300381)
誤差理論和概率論在食品化學分析中的應用
翟卉
(農業部乳品質量監督檢驗測試中心,天津300381)
食品化學分析中的多次平行測定具有正態分布的概率分布率,測定中7種誤差具有各自特征性應用,在規范的化學分析基礎上得出更高的準確度和精密度。
誤差理論;概率論;食品化學分析
食品化學分析是為了獲得食品成分的真值。就食品化學分析的項目來說,可達成千上萬個,食品成分包括自然界可食用的所有動物、植物和微生物,同時還包括人為加工所添加劑的食品添加劑以及加工過程中發生的成分變化,涉及幾乎有機化學和無機化學學科的所有方面。就食品化學分析的手段來說,除了常規分析化學的重量法、容量法等外,還包括各種光譜、色譜、質譜等儀器分析以及酶聯免疫法(ELISA)、聚合酶鏈反應(PCR)等快速分析,這些分析結果由百分含量直至百億分之一(0.1 μg/kg)。近年來食品化學分析的迅猛發展,要求充分應用數學工具總結、歸納分析中的規律,結合分析方法尋找科學的分析方案,得出準確的分析結果。相對于化學分析技術而言,數學工具仍顯落后,甚至最基礎的數學工具還未普及,致使分析結果具有明顯的隨意性、不可知性,無法解釋分析結果正確與否,無法判斷可疑結果,無法改進分析技術。因此,分析技術必須與數學工具充分結合,才能達到分析目的。
國際上在食品化學分析中應用數學工具和起源于上世紀初,1927年大衛·波羅特提出測定值的誤差分析,首次將誤差分為隨機誤差和系統誤差,解釋分析結果的準確度;1929年萊勞·特·懷特在誤差理論基礎上提出最小二乘法,進一步將標準差運用于分析結果的綜合判斷上;1988年馬西摩·司提出多次化學測定遵循高斯分布規律。并將概率論應用于分析結果[1],奠定了食品化學分析中的應用數學基礎,直至1995年國際理論化學和應用護額學聯合會(IUPAC)發布“分析化學實驗室內部質量控制指南”[2],總結了以往食品化學分析的應用數學,確定了全世界的基本原則和方法。
1 不同誤差在食品化學分析中的應用
測定誤差是食品化學分析中不可避免的,其原因是整個分析中每個步驟的不規范因素,包括分析人員的主觀因素以及試劑、儀器和環境變化等客觀因素。依據其產生機理,可歸納為兩類,即隨機誤差或稱偶然誤差(random errors)和系統誤差(systematic errors)。前者是由分析過程上不確定因素的隨機性造成的誤差。后者是由保持恒定或以可預知方式變化造成的誤差。這兩類誤差具有不同的特點,因而在化學分析中有不同的用途。
隨機誤差的特點是:(1)由于造成的因素不可預計,它在分析過程中隨機出現,因此無法在化學分析前估計單次分析隨機誤差的大小;(2)單次分析的隨機誤差沒規律性,可大可小,可正可負。但多次分析的隨機誤差有抵償性,其平均值趨于零。這一點為人們所利用,找到消除隨機誤差的實驗方法,也就是說,以足夠多的重復分析次數就可使隨機誤差減小到允許的程度。由于化學分析是多次重復測定,因此不能用單次測定來衡量誤差,而用多次測定的綜合性標準差(又稱標準差、標準偏差、標準離差、均方根差 standard deviation)來衡量,標準差以貝塞爾公式為佳,即
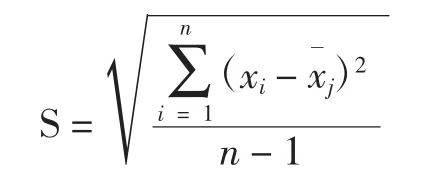
應用標準差就可將重復測定次數與隨機誤差大小聯系起來,這聯系是借助于多次重復測定的化學分析概率分布規律,即正態分布(高斯分布)。
系統誤差的特點是:(1)造成的因素可預計,在測量之前就存在,能估計其大小;(2)具有疊加性,因此它不能靠多次測量的抵償來消除,而只能靠對每個因素的校準來削弱或消除。如量具雖溫度的變化、分析人員讀數的習慣誤差、儀器的響應值誤差等。
2 化學分析測定值的概率分布
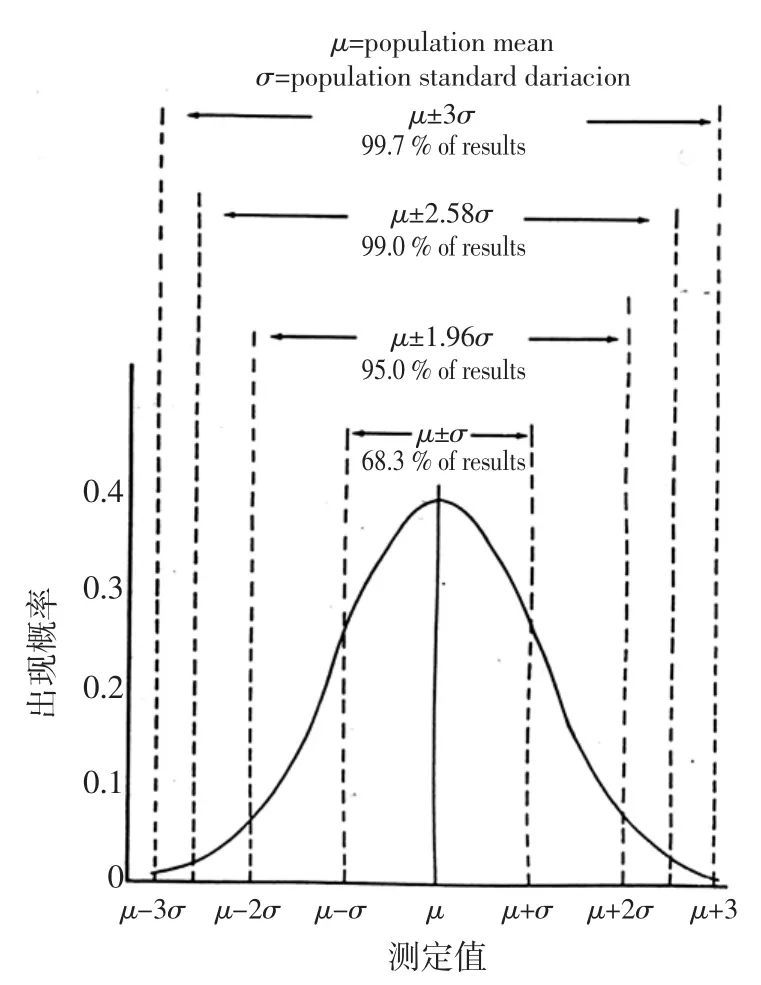
在重復性條件下多次測定的概率分布圖為正態分布圖或稱高斯分布圖,如右圖所示。即以測定值x作橫坐標,出現概率P為縱坐標的分布圖。
其概率可用下式表示:
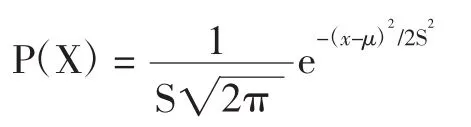
式中:μ為平均值,s為標準差。由圖可知測定值概率具有以下性質:
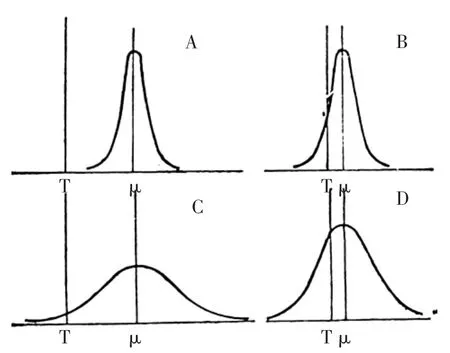
1)高斯分布反映測定值的隨機誤差,具對稱性,抵償性;
3)標準差愈小,曲線愈陡,隨機誤差小,精密度高,反之,曲線緩,隨機誤差大,精密度低;
②應用更精確的測定方法,是每次測定值與多次測定平均值更接近,減小S。例如,用25 mL滴定管時,A級滴定管比B級滴定管更精確,前者的誤差為0.04 mL,而后者為0.08 mL。
,即a至 b范圍內曲線包含的面積。在化學分析中應用以下三種面積:(a)μ±S測定值范圍內出現的概率為68.3%;(b)μ±2S測定值范圍內出現的概率為95.0%(精確地說為μ±1.96S);
(c)μ±3S測定值范圍內出現的概率為99.7%。
其中第二種特別有用,它表示在μ±2S范圍內測定值出現的概率為95%,僅有5%遠離真值(此時以平均值表示)的測定值不在此范圍內,左右各2.5%,因此μ±2S范圍內的測定值,在全世界被認為是可以視為真值的允許范圍(真值為μ,允許范圍為2S)[4]。而μ±S要求太苛刻;μ±3S又太松。
為了使S更小,使測定值更接近真值μ,可采取兩個方法:
3 幾種誤差的特殊用途
3.1 絕對誤差(absolute error),即測定值與真值之差E =R-τ,在化學分析中應用時,反映了以下含義:
1)當R為一次測定值,則E包含隨機誤差及系統誤差;
2)當R為重復性條件下足夠多次測定的平均值時,則E僅為系統誤差。這在制定標準方法和科研中很重要,依此排除隨機誤差,來尋找系統誤差,如干擾物質、化學反應完全程度、消化中被測組份損失等。
3)當進行常規測定時,即具上崗證的分析人員應用國家標準方法、檢定過的儀器和器皿進行測定時,則系統誤差視為零(實際上是在允許范圍之內的數值),這時在重復性條件下足夠多次測定又消除了隨機誤差,所以E=0,μ=τ,即在以上條件下測定的算術平均值μ視為真值。
所謂重復性條件即在相同測量條件下(人、儀器、方法、環境)對同一樣品同一組分連續測定。
3.2 相對誤差(relative error),即絕對誤差對真值的百分率,在化學分析中應用時,除了與絕對誤差的三點含義相同外。它反映的不是量值大小,而是相對百分率,用來比較不同次測定、樣本或本底值等的測定誤差。
3.3 算術平均偏差(arithmetic mean of bias),即i次測定偏差的算術平均數:
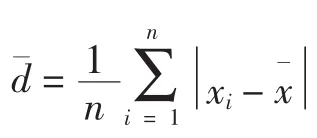
在化學分析中應用時,反映了以下含義:
1)衡量隨機誤差大小,d小,隨機誤差小,如圖A、B所示,在概率分布圖上表現為曲線陡;而d大,隨機誤差大,如圖C、D所示,曲線緩。
3.4 相對標準差(relative standard deviation),又稱變異系數(coefficient of variation)即標準差的平均值
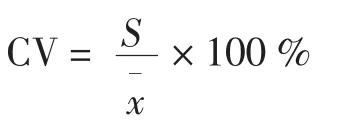
在化學分析中應用時,反映了以下含義:它以相對百分率表示標準差,而不是絕對數值,因此可以比較不同測定平均值的隨機誤差大小,或精密度大小,或高斯分布曲線的陡緩。
3.5 極差R(maximum diffence),即一組測定值中最大值與最小值之差值Xmax—Xmin。在化學分析中用于數據檢驗,如目前世界通用的狄克遜檢驗(Dixon test),還可用于F檢驗。例如,當標定一個標準滴定溶液時,得出10個測定濃度。其=0.101 2,S=0.003 6,R=0.012,單位為mol/mL。在用于滴定(或儀器法作內標)時,必須從樣本的實測值推斷總體的真值。推斷的方法如下:
1)將樣本的算術平均值作為總體平均值μ的估計值,該10個測定值的平均值為0.101 2;
2)選擇1個置信概率,一般γ=0.95,也稱顯著性水平0.05;
3)計算置信區間,從高斯分布圖可知積分計算很麻煩,因此創造了一個t檢驗(雙側檢驗)和F檢驗(單側檢驗)的表格,便于查表計算。
(a)t檢驗計算,由t檢驗表可知n=10,γ=0.95時,0.003 6=(0.101 2±0.002 6)mol/mL=0.098 6 mol/mL~0.103 8 mol/mL。
這說明盡管標定濃度平均值為0.101 2 mol/mL,而根據10次標定的分散性(由S、R反映)標液的真實濃度并不是0.101 2 mol/mL(這僅是一個近似值),而應該是(0.1012±0.0026)mol/mL范圍內(出現的概率為0.95,是可值得信賴,因僅有5%的可能是不在這范圍內)。由這標準滴定溶液的置信限0.002 6 mol/mL可推斷用其滴定(如測定、加標)發生的誤差。
(b)F檢驗計算,由F檢驗表可知n=10,γ=0.95時,f=0.230置信區間x±fR=0.101 2±0.230×0.012=(0.101 2±0.002 8)mol/mL=0.098 4 mol/mL~0.1040 mol/ mL,兩種計算方法結果很一致。
[1]Massimo C,J T Chayes L.Chayes Gaussian fluctuations of Connectivities in the Subcritical Regime of Percolation[J].Probability Theory and Related Fields,1988,1:209-341
[2]IUPAC.Harmonized Guildlines for Internal Quality Control in Analitical Chemistry Laboratory[J].Pure&Appl Chem,1995,67:649-666
Error Theory and Probability Used in Food Chemical Analysis
ZHAI Hui
(Dairy Monitoring Center of Department od Agriculture,Tianjin 300381,China)
Multi-determinations of food chemical analysis are characterized by Gauss Distribution of probability. The involving seven errors of different use in chemical analysis are aimed to improve determination accuracy and precision.
error theory;probability;food chemical analysis
10.3969/j.issn.1005-6521.2014.19.041
2014-06-17
翟卉(1963—),女(漢),工程師,本科,研究方向:食品監督及檢驗。

