溫和條件下水合肼催化分解制氫研究進展
賀雷,黃延強,王愛琴,王曉東,張濤
(中國科學院大連化學物理研究所,遼寧 大連 116023)
溫和條件下水合肼催化分解制氫研究進展
賀雷,黃延強,王愛琴,王曉東,張濤
(中國科學院大連化學物理研究所,遼寧 大連 116023)
水合肼(N2H4·H2O)的氫質量分數高達8.0%,完全分解時副產物僅為N2,且在溫和條件下物理化學性質較為穩定,因此可以作為一種理想的移動氫源,在一些特殊場合為燃料電池提供氫氣。本文概述了溫和條件下水合肼分解制氫反應所使用的催化體系,具體包括金屬納米粒子、復合氧化物及負載型催化劑。簡要介紹了肼分解過程的機理,并分析了影響水合肼分解制氫選擇性的因素,包括催化劑中活性金屬的特性、反應條件及助劑的性質對催化劑選擇性的影響。總結了現階段水合肼分解制氫催化劑的優缺點,為進一步開發高效、高選擇性的水合肼分解制氫催化劑提供借鑒,并為涉及N—H鍵及N—N鍵斷裂的其他反應催化劑設計提供參考。
水合肼;制氫;催化劑;選擇性
能源短缺、環境污染和全球氣候變暖給人類社會的可持續發展帶來了前所未有的挑戰。優化能源結構和開發利用高效轉化技術是解決當前危機的重要途徑。氫氣具有來源廣泛、能量密度高、無毒無害等優點,且燃燒產物僅為水蒸氣,沒有任何溫室氣體的產生,因而被認為是最有希望替代化石能源的新型能源,一直以來受到全世界范圍的廣泛關注[1-4]。特別是隨著燃料電池技術的發展,利用氫氣作為燃料為移動設備提供動力成為可能[5-7]。但是氫氣的運輸和儲存是尚未攻克的技術難題,成為制約氫能利用的瓶頸,因此開發更加高效、安全的儲氫材料仍是全世界科學家努力的方向[8]。根據不同的充放氫方式,儲氫材料可大致分為物理儲氫材料和化學儲氫材料[9]。其中,化學儲氫材料的氫含量遠遠高于物理儲氫材料,有希望成為實現高效存儲氫氣的介質。但是化學儲氫材料性質比較穩定,充放氫過程需要跨越相應的能壘,在溫和條件下不易實現。利用催化轉化的方法能夠有效降低化學儲氫材料充放氫過程所需的活化能,實現氫氣的高效存儲。因此,新型催化劑的開發成為實現化學儲氫的關鍵。
在眾多的化學儲氫材料中,氮氫化合物和硼氫化合物具有氫含量高、副產物少、室溫下易于運輸等優點,近年來受到廣泛的關注[10-11]。肼(N2H4)作為一種重要的氮氫化合物,氫質量分數高達12.5%,完全分解產物為H2和N2,是一種理想的液體氫源[12]。但是肼與金屬催化劑接觸時易發生爆炸,存在一定的安全隱患。水合肼(N2H4·H2O)為肼的水合物,完全分解產物與肼相同,可釋氫質量分數為8.0%,其中的水分子不參與反應,化學性質較為穩定,因而更適合作為液體氫源進行研究。本文將簡要介紹肼分解反應并詳細綜述溫和條件下水合肼分解制氫的研究現狀。
1 肼分解反應簡介
肼,分子式為N2H4,化學性質活潑,響應迅速,在催化劑存在的條件下能夠迅速分解[13],產生大量的氣體并放出大量的熱,實現化學能向動能的轉變,因此可以作為小型姿態控制發動機的推進劑,廣泛應用于航空航天領域[13-16]。針對這樣的應用背景,對催化劑的低溫啟動活性和高溫穩定性提出了很高的要求。在眾多的催化體系中,以Shell 405為代表的貴金屬Ir基催化劑表現出最好的綜合性能[14,17]。但是金屬Ir資源稀少、價格昂貴,為了降低催化劑成本,非貴金屬催化劑的開發也是科學家們一直努力的方向。大量的研究表明,一些過渡金屬的碳化物[18-21]、氮化物[22-24]或磷化物[25-26]能表現出類貴金屬的性質,應用于肼分解反應也取得了很好的效果。
具體來看,肼可以按照式(1)、式(2)兩種途徑進行分解[13]:
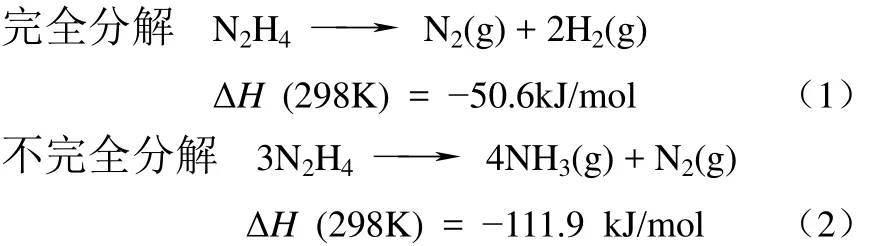
上述兩個反應可以同時進行,但在高溫條件下生成的中間產物NH3能夠進一步分解生成N2和H2,肼也能夠與H2反應生成NH3。因此,肼的分解并不是嚴格按照上述的化學計量式進行,而是受到催化劑種類及反應條件(溫度、壓力)的影響[13]。Zheng 等[27]系統研究了SiO2負載的金屬催化劑在低濃度氣相肼分解反應中的性能。其中,Ru、Co、Rh及 Ir金屬催化劑均能在低溫迅速使肼發生分解,產物主要是N2和NH3;當溫度高于350℃后發生氨分解反應,開始有H2的生成。Ni、Pd、Pt催化劑在30~80℃區間內的分解產物主要為N2和H2,升高溫度后則以N2和NH3為主。上述結果表明,催化劑中的金屬種類以及反應溫度的不同都會影響肼分解的最終產物。
2 溫和條件下水合肼分解制氫催化劑
無水肼的氫質量分數高達12.5%,遠遠高于一般的物理儲氫材料,而且完全分解后的副產物僅為氮氣,無需進一步的回收利用。如果能夠在溫和條件下實現肼的完全分解,則可以在無需外加能源的條件下快速制備氫氣,為燃料電池提供所需的原料,以備不時之需,因此在一些特殊場合具有非常重要的應用價值。但是無水肼(>98%)與金屬催化劑接觸時反應太過劇烈,易發生爆炸,從而帶來安全隱患。
肼的水合物,水合肼(N2H4·H2O),為無色液體,理論氫質量分數為8.0%,仍高于美國能源部(department of energy,DOE)的車載氫源標準(≥5.5%),且化學性質較為穩定,因而更適合作為液體氫源加以利用。水合肼中存在肼分子與水的氫鍵,使其在溫和條件下分解的難度增加;在反應過程中,水的不斷積累也會使催化劑的活性不斷降低[28-29]。此外,要想實現水合肼在溫和條件下的完全分解,需要使得反應完全按照式(1)進行,而阻止式(2)的發生,這對催化劑的選擇性也提出了很高的要求。在前人的工作中,大量關于肼分解催化劑的開發更關注的是催化劑的活性和穩定性,而對催化劑的選擇性并沒有特別強調。一些傳統的高活性肼分解催化劑,如Ir/Al2O3,在100℃以下的溫度區間更容易促進肼分解生成氨而不是生成氫氣[28]。因此,要想在溫和條件下同時實現高效、高選擇性的水合肼分解制氫氣,對催化劑的設計和開發提出了新的挑戰。
目前,水合肼分解制氫使用的催化劑可分為金屬納米粒子、復合氧化物及負載型金屬催化劑。
2.1 金屬納米粒子
隨著納米技術的發展,對金屬納米粒子已經能夠實現可控制備,得到尺寸均一、組分均勻的納米粒子。部分新型金屬納米粒子能夠有效促進水合肼的分解制氫,如表1。
2009年,日本的Xu研究組[30]采用液相還原法制備了一系列金屬納米粒子,并考察了其在室溫下對水合肼分解制氫反應的性能。在眾多的過渡金屬中,Rh納米粒子表現出最高的水合肼分解制氫選擇性(44%),Co、Ru和Ir等金屬納米粒子的H2選擇性僅為7%,Fe、Cu、Ni、Pt及Pd等納米粒子則完全沒有肼分解活性。

表1 不同納米粒子在水合肼分解制氫中的催化性能對比
在單金屬納米粒子研究的基礎上,他們[31-34]考察了不同雙金屬納米粒子在水合肼分解反應中的性能。結果表明,雙金屬納米粒子中兩種金屬的組分、比例以及結構均會對反應的活性和選擇性產生很大影響。首先,不同金屬對水合肼分解表現出不同的催化性能。例如,與Co基和Fe基的雙金屬相比,Ni基雙金屬催化劑(Ni-Rh、Ni-Pt及Ni-Ir)能夠得到高達100%的制氫選擇性[31-33]。其次,兩種金屬的比例會影響納米粒子的選擇性。以Ni-Rh雙金屬納米粒子為例,當Rh/Ni=4∶1時,水合肼完全分解的制氫選擇性可達到100%,而Rh/Ni=1∶4時制氫選擇性僅為71%[31]。此外,納米粒子的結構特征也是影響反應選擇性的關鍵因素,如Ni-Pt合金納米粒子可以高選擇性地促進水合肼分解制氫,而核殼結構的Ni@Pt納米粒子或簡單混合的Ni和Pt納米粒子則無法得到很高的制氫選擇性[32]。Liu等[35]制備了不同形貌的PdIr雙金屬納米粒子,發現在室溫下,PdIr納米籠表現出66%的制氫選擇性,高于PdIr納米花29%的選擇性,說明納米粒子的形貌對其催化性能有重要的影響。
雖然上述納米粒子表現出非常高的制氫選擇性,但所使用的Rh、Ir、Pt等金屬價格昂貴,因此對于非貴金屬納米粒子的研究受到研究者的普遍關注。Xu小組[36]選擇非貴金屬Fe、Co、Ni之間組合的雙金屬納米粒子進行水合肼分解測試。結果發現,在70℃下并加入適量的NaOH助劑后,NiFe合金納米粒子表現出高達100%的制氫選擇性。Tong 等[37-38]采用液相等離子過程制備了無定形Co-B納米球以及蜂窩狀的純相Co-B,在室溫下分別取得21%和30%的制氫選擇性。Manukyan等[39]制備了Fe-Ni/Cu三元納米粒子,并進行了水合肼分解制氫測試,結果表明該粒子的活性和選擇性隨反應溫度的升高而升高,當溫度為70℃時,Fe-Ni/Cu納米粒子的制氫選擇性可達到100%。
金屬納米粒子雖然能夠高選擇性地分解水合肼制氫,但是在制備以及反應過程中都容易發生團聚,催化活性相對較低。雖然在制備過程中加入表面活性劑可以降低金屬的粒徑,但是保護劑同樣會覆蓋金屬活性位,而不能從根本上提高催化劑的活性。此外,保護劑的加入使得催化劑的分離更加困難,影響其循環利用。
2.2 復合氧化物
鈣鈦礦型復合氧化物常用作固體氧化物燃料電池中的陽極材料,Shao等[40]使用溶膠凝膠法(EDTA-檸檬酸共絡合)制備了Ba0.5Sr0.5Co0.8Fe0.2O3-δ(BSCF),將其作為液態肼分解的催化劑。研究發現,BSCF在室溫具有很好的催化液態純肼分解活性,但反應產物以NH3為主。隨著反應溫度的升高,產物生成氫氣的選擇性有所提高,在60℃時達到10%的制氫選擇性。當加入大量的KOH作為助劑時,催化劑的室溫制氫選擇性顯著提高,最高可達到100%,但同時反應速率顯著降低。在此基礎上,他們開發了La0.2Sr0.8CoO3-δ(LSC2)復合氧化物催化劑[41],在加入強堿作助劑時同樣實現了溫和條件下的肼分解制氫,并應用在質子膜燃料電池(PEMFC)中,得到了與純氫氣操作條件下相近的結果。
復合氧化物的優點是常作為燃料電池中的電極材料,因而能夠更好地與實際應用相結合;缺點是強度不高,在操作之后易發生粉化剝離,影響其使用壽命。此外,水合肼具有一定的還原性,復合氧化物中的金屬陽離子在水合肼存在時容易被還原到低價態,因此該材料在反應過程中的穩定性也有待考察。
2.3 負載型金屬催化劑
負載型催化劑是最常用的工業催化劑之一,制備過程較為簡單,可以通過調節活性組分的負載量、載體的種類及結構、助劑的加入量等因素,調變催化劑的活性和選擇性。目前報道的用于水合肼分解制氫的負載型催化劑列于表2。
2.3.1 貴金屬催化劑
貴金屬催化體系中,Ir/Al2O3在傳統肼分解催化劑中表現出最好的綜合性能。Cho等[28-29]采用多次浸漬法制備了高負載量的Ir/Al2O3催化劑,并用于水合肼分解制氫反應。研究發現,在室溫條件下,反應生成的水會不斷降低催化劑的活性,且分解產物以氨為主,只有采用較高的反應溫度(200℃)時,該催化劑才能夠表現出較高的水合肼分解制氫選擇性。在貴金屬與第Ⅷ族過渡金屬(Fe、Co、Ni)復合雙金屬體系中,Ni基催化劑表現出最高的低溫制氫選擇性。張義煌等[54]采用溶膠凝膠法制備了Ni基復合氧化物作為載體,負載活性金屬組分(Pt、Rh、Pd)后得到催化劑,能夠在常溫下催化肼或者水合肼高效分解制取氫氣。與Ni基雙金屬催化劑相比,Co基催化劑的選擇性并不高,Song-Ⅱ等[47]使用NaBH4共還原的方法制備了非晶態的PtCo/CeOx催化劑,在室溫下僅得到60%的制氫選擇性。

表2 不同負載型催化劑在水合肼分解制氫中的催化性能對比
近年來,隨著新型材料的不斷發展,負載型催化劑的載體范圍也擴展到炭材料、金屬有機框架(metal organic framework,MOF)等領域。Wang 等[42]利用石墨烯作為載體制備了RhNi@graphene催化劑,Singh等[43]采用MOF為載體制備了Pt-Ni@MOF雙金屬催化劑,上述兩種催化劑在加入一定量的強堿助劑后,均可以實現低溫下的水合肼分解制氫。張濤研究組[44-45]開發了Ni基雙金屬催化劑,以Ni-Al水滑石前體為載體,分別負載少量Pt和Ir得到NiPtx/Al2O3和NiIrx/Al2O3雙金屬催化劑。這兩種催化劑在30℃下均能夠實現水合肼分解制氫,選擇性高于99%,且無須另外添加堿金屬助劑。Wang等[46]利用NaBH4共還原的方法向Ni-Pt納米粒子中引入Ce2O3,制備的PtNi/Ce2O3非晶催化劑能夠在室溫下催化水合肼完全分解制氫。
2.3.2 非貴金屬催化劑
雖然貴金屬合金催化劑的水合肼制氫選擇性很高,但是價格昂貴,因此非貴金屬催化體系的開發更符合實際應用的需要。在眾多的非貴金屬催化劑中,Ni和Fe基催化劑表現出最好的水合肼分解制氫性能。
單獨的Ni基催化劑對于水合肼分解制氫選擇性較差,但是通過改進制備方法或添加助劑能夠有效提高Ni基催化劑的制氫選擇性。張濤研究組[48]利用Ni-Al水滑石為前體,經過直接高溫還原得到Ni-Al2O3-HT催化劑。該催化劑中Ni的質量分數高達78%,Ni的粒子大小僅有4nm左右,實現了Ni的高度分散。同時,水滑石結構的存在也為還原后的催化劑提供了大量強堿性位,調變了催化劑表面活性金屬Ni的性質。該催化劑在30℃的條件下實現了水合肼的完全轉化,并得到93%的制氫選擇性。隨后,他們將商品化的Raney Ni催化劑用于水合肼分解制氫[49],通過加入一定量的NaOH作為助劑,使得催化劑的制氫選擇性提高到99%以上。由于Raney Ni催化劑具有良好的磁性,催化劑的分離回收非常容易。Zhang等[50]在NiB中摻入定量的Mo 和La得到NiMoB-La(OH)3催化劑,在50℃時能夠實現水合肼完全分解,氫氣選擇性達到100%。
對于Fe基催化劑來講,單獨的Fe催化劑并不能促進水合肼的室溫分解制氫,但是Fe-B粒子表現出較好的催化性能。Tong等[51]制備了單分散的Fe-B納米粒子,并將其負載于多壁碳納米管上作為催化劑,實現了室溫下水合肼分解,得到97%的制氫選擇性。在此基礎上,他們利用NaOH對多壁碳納米管進行處理后負載Fe-B納米粒子,催化劑的制氫選擇性可以提高到99%。
此外,Ni-Fe雙金屬催化體系表現出非常高的水合肼分解制氫選擇性。Tong等[52]在有機溶液中制備了單分散的Ni3Fe合金納米粒子,并將其負載于炭載體上,得到了室溫下100%的制氫選擇性。Gao 等[53]利用水滑石前體制備得到了不同比例的NiFe-alloy/(MgO)催化劑并考察了其在水合肼分解反應中的活性,通過調變組分的比例,發現Ni1.5Fe1.0/(MgO)3.5在室溫條件下能夠實現99%的制氫選擇性。
3 制氫選擇性的影響因素
前文中提到,肼分解可以通過兩種途徑進行,包括完全分解和不完全分解。但是肼的分解并不是嚴格按照化學計量式進行,而是受到催化劑種類及反應條件(溫度、壓力)的影響[13,54]。不同反應途經包括多步基元反應,涉及N2Hx及NHx等多種中間體,要想準確刻畫每一個過程非常困難,因此肼分解機理仍存在很多爭議。概括來講,肼分子中N—N鍵和N—H鍵的斷裂順序是影響最終產物分布的關鍵。而活性金屬與肼分子間作用力的強弱不同會改變N—N鍵及N—H鍵的斷裂順序,進而影響反應進行的方向,最終影響水合肼分解的選擇性。
肼分子中的N—N鍵斷裂所需的鍵能為286 kJ/mol,N—H鍵斷裂需要360kJ/mol,因此肼在熱分解過程中N—N鍵的斷裂更為容易[16]。但是在不同的金屬催化劑表面,肼分子中的斷鍵情況則不盡相同。如在Ir/Al2O3催化劑上[55-56],吸附于催化劑表面的N2H4首先發生N—N鍵斷裂,得到吸附于表面的物種。NH2能夠繼續分解得到吸附態的氮原子和氫原子,但是由于氮原子的復合所需能量很高,在溫和條件下難以實現[57]。因此更容易獲取一個氫原子生成NH3,使得水合肼分解的最終產物為N2和NH3。
如果肼分子中的N—H鍵優先斷裂,而不發生N—N鍵斷裂,則更有利于直接生成N2和H2。Maurel
等[58]通過同位素標記的手段,考察了15N標記的肼分子在氧化鋁負載的金屬催化劑上的分解過程,結果表明,在60~300℃的區間范圍內,Co、Ni、Cu、Ru、Rh、Pd、Ir及Pt等催化劑上分解后生成的N2均來自同一個肼分子。Block等[59]也通過15N同位素標記的手段研究了Fe/MgO催化劑上肼分解反應,發現催化劑表面并沒有形成酰胺、亞酰胺或氮化物的中間體,也表明肼分解在該催化劑上是以N—H鍵優先斷裂的機理發生的。根據以上結果,研究者提出以下機理:肼分子在催化劑上會優先發生N—H鍵斷裂,得到吸附態的N2H3、N2H2、N2H 及H等物種,最終產物中的N2不經過N—N鍵的斷裂,而是通過分子內反應直接脫附形成,來源于同一個肼分子,見圖1。
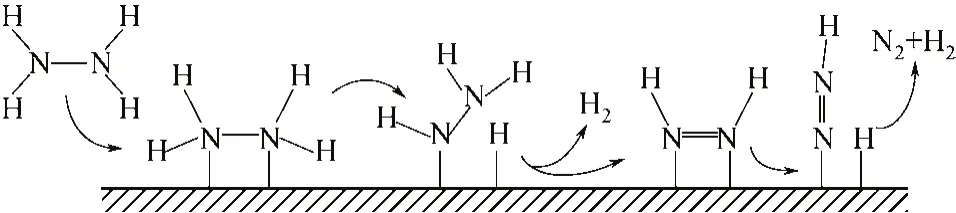
圖1 催化劑表面肼分解制氫示意圖
除了催化劑中活性金屬的種類以及反應條件會對水合肼分解制氫的選擇性有影響之外,助劑的添加也能夠對催化劑性質進行調變,是提高催化劑制氫選擇性的重要方法。在眾多的金屬催化劑中,Ni基催化劑表現出最高的水合肼分解制氫選擇性。但是傳統的單金屬Ni催化劑制氫選擇性僅為60%左右[48],通過添加第二種金屬組分能夠對Ni的電子性質進行有效調變,是提高水合肼分解制氫選擇性的有效手段。例如,與單獨的Ni或Fe催化劑相比,雙金屬Ni-Fe催化劑的制氫選擇性有明顯的提高[52-53],其主要原因為Ni-Fe合金的協同作用。以水滑石為前體制備的Ni-Pt[44]和Ni-Ir[45]雙金屬催化劑中,少量貴金屬的加入與Ni形成了表面合金,有效調變了Ni的性質,改變了催化劑對N—N鍵和N—H鍵的斷裂能力,從而將催化劑選擇性提高到99%以上。同時由于合金的形成,產物H2和中間物種在催化劑表面的吸附變弱,從而使得Ni催化劑的活性和穩定性有顯著的提高。
此外,強堿性助劑在水合肼分解制氫反應中也表現出顯著的促進作用。由于水合肼不完全分解的產物為NH3,添加強堿助劑后會使得副反應的活化能升高[49],有效抑制副反應的發生,因此大量文獻中報道的水合肼分解反應均需添加適量的強堿性助劑,如NaOH或KOH[40-43,46]。催化劑載體中強堿性位的存在也能夠起到提高水合肼分解制氫選擇性的作用。例如,利用水滑石前體制備的Ni-Al2O3-HT催化劑中存在大量的強堿性位,NiMoB-La(OH)3催化劑[50]中的La(OH)3及Ni1.5Fe1.0/(MgO)3.5催化劑[53]中的MgO也提供了大量的強堿性位。這些強堿性位的存在也調變了催化劑表面的電子性能,改變了反應進行的方向,從而有效提高了催化劑的制氫選擇性。
綜上所述,溫和條件下水合肼在不同的金屬催化劑表面可按照不同的機理進行分解,但N—N鍵或N—H鍵的斷裂順序是影響催化劑制氫選擇性的關鍵。通過添加第二種金屬或強堿性助劑的方法對催化劑表面性質進行調變,可以有效調控肼分解的反應路徑,提高催化劑的制氫選擇性。
4 結語與展望
水合肼作為一種液體氫源,受到越來越廣泛的關注。在溫和條件下,通過催化轉化的方式能夠實現水合肼的完全分解,快速生產大量的氫氣,副產物僅為氮氣,因而水合肼能夠作為應急氫源發揮獨特的作用。目前,能夠有效促進水合肼分解制氫的催化劑可分為金屬納米粒子、復合氧化物及負載型催化劑。其中,負載型Ni基催化劑表現出最高的制氫選擇性,通過添加第二種金屬或添加強堿性助劑的方式,能夠進一步提高催化劑在溫和條件下的制氫選擇性,最高可達到100%。同時,Ni催化劑具有較好的磁性,容易進行分離回收,因而是最有希望實現工業化的催化劑。
盡管負載型Ni基催化劑表現出較高的水合肼分解制氫選擇性和活性,但要想真正實現工業化應用還需解決以下兩方面的問題:一方面,Ni基催化劑易被氧化而失活,通過添加助劑進一步提高催化劑的抗氧化能力,能夠有效延長催化劑的使用壽命;另一方面,水合肼分解是放熱反應,現有的催化劑隨著反應溫度升高其制氫選擇性會下降,通過添加第二組分金屬等手段對催化劑性能進行調變,可能會進一步拓寬反應的溫度區間,使其更具有應用前景。此外,肼分解過程的機理研究仍存在諸多爭議,隨著實驗技術的提高和理論計算的發展,如果對肼分解制氫過程的機理進行更深入的認識,能夠對N—N鍵和N—H鍵的斷裂過程進行更加系統性的描述,那么不僅對于肼分解反應,對于氨分解等其他涉及N—H鍵和N—N鍵斷裂的反應催化劑設計和研發都具有重要的指導意義。
[1] Blagojevi? V A,Mini? D M,Mini? D G. et al. Hydrogen Economy:Modern Concepts,Challenges and Perspectives [M]. New York:Intech.,2012.
[2] Chu S,Majumdar A. Opportunities and challenges for a sustainable energy future[J].Nature,2012,488(7411):294-303.
[3] Mazloomi K,Gomes C. Hydrogen as an energy carrier:Prospects and challenges[J].Renewable and Sustainable Energy Reviews,2012,16 (5):3024-3033.
[4] Wells S A,Sartbaeva A,Kuznetsov V L,et al. Hydrogen Economy:Encyclopedia of Inorganic and Bioinorganic Chemistry[M]. New York:John Wiley & Sons,Ltd.,2011.
[5] Schlapbach L,Zuttel A. Hydrogen-storage materials for mobile applications[J].Nature,2001,414(6861):353-358.
[6] Von Helmolt R,Eberle U. Fuel cell vehicles:Status 2007[J].Journal of Power Sources,2007,165(2):833-843.
[7] Fayaz H,Saidur R,Razali N,et al. An overview of hydrogen as a vehicle fuel[J].Renewable and Sustainable Energy Reviews,2012,16(8):5511-5528.
[8] Züttel A,Hirscher M,Panella B,et al. Hydrogen as a Future Energy Carrier[M]. Hydrogen Storage. Weinheim:Wiley-VCH Verlag GmbH & Co. KGaA.,2008.
[9] Eberle U,Felderhoff M,Schüth F. Chemical and physical solutions for hydrogen storage[J].Angewandte Chemie International Edition,2009,48(36):6608-6630.
[10] Yadav M,Xu Q. Liquid-phase chemical hydrogen storage materials[J].Energy & Environmental Science,2012,5(12):9698-9725.
[11] 王玉曉. 硼氫化鈉制氫技術在質子交換膜燃料電池中的研究進展[J]. 化工進展,2009,28(12):2122-2128.
[12] Singh S K,Xu Q. Nanocatalysts for hydrogen generation from hydrazine[J].Catalysis Science & Technology,2013,3(8):1889-1900.
[13] Schmidt E W. Hydrazine and Its Derivatives:Preparation,Properties,Applications[M]. 2nd ed. New York:John Wiley & Sons,2001.
[14] Armstrong W E,Ryland L B,Voge H H. Catalyst comprising Ir or Ir and Ru for hydrazine decomposition:US,4124538[P]. 1978-11-07.
[15] 李令成,藍蘊基. 肼分解催化劑進展[J] 工業催化,1994(1):3-7.
[16] Batonneau Y,Kappenstein C J,Keim W. Handbook of Heterogeneous Catalysis. Catalytic decomposition of energetic compounds:Gas generators and propulsion[M]. Weinheim:Wiley-VCH Verlag GmbH & Co. KGaA,2008.
[17] Neto T G S,Cobo A J G,Cruz G M. Textural properties evolution of Ir and Ru supported on alumina catalysts during hydrazine decomposition in satellite thruster[J].Applied Catalysis A:General,2003,250(2):331-340.
[18] Chen X,Zhang T,Zheng M,et al. Catalytic decomposition of hydrazine over α-Mo2C/γ-Al2O3Catalysts[J].Industrial & Engineering Chemistry Research,2004,43(19):6040-6047.
[19] Sun J,Zheng M. Y,Wang X D,et al. Catalytic performance of activated carbon supported tungsten carbide for hydrazine decomposition[J].Catalysis Letters,2008,123(1-2):150-155.
[20] Liang C,Ding L,Wang A,et al. Microwave-assisted preparation and hydrazine decomposition properties of nanostructured tungstencarbides on carbon nanotubes[J].Industrial & Engineering Chemistry Research,2009,48(6):3244-3248.
[21] Wang H,Zhang H,Wang A Q,et al. Preparation of metal carbide imbedded ordered mesoporous carbon and its catalytic properties for N2H4decomposition[J].Chinese Journal of Catalysis,2010,31(9):1172-1176.
[22] Chen X,Zhang T,Xia L,et al. Catalytic decomposition of hydrazine over supported molybdenum nitride catalysts in a monopropellant thruster[J].Catalysis Letters,2002,79(1-4):21-25.
[23] Chen X,Zhang T,Zheng M,et al. The reaction route and active site of catalytic decomposition of hydrazine over molybdenum nitride catalyst[J].Journal of Catalysis,2004,224(2):473-478.
[24] 鄭明遠. 程序升溫反應法制備氮化鐵及催化肼分解研究[D]. 大連:中國科學院大連化學物理研究所,2005.
[25] Cheng R,Shu Y,Zheng M,et al. Molybdenum phosphide,a new hydrazine decomposition catalyst:Microcalorimetry and FTIR studies[J].Journal of Catalysis,2007,249(2):397-400.
[26] Ding L N,Shu Y Y,Wang A. Q,et al. Preparation and catalytic performances of ternary phosphides NiCoP for hydrazine decomposition[J].Applied Catalysis A:General,2010,385(1-2):232-237.
[27] Zheng M,Cheng R,Chen X,et al. A novel approach for CO-free H productionviacatalytic decomposition of hydrazine[J].International Journal of Hydrogen Energy,2005,30(10):1081-1089.
[28] Cho S,Lee J,Lee Y,et al. Characterization of iridium catalyst for decomposition of hydrazine hydrate for hydrogen generation[J].Catalysis Letters,2006,109(3-4):181-186.
[29] Jang Y B,Kim T H,Sun M H,et al. Preparation of iridium catalyst and its catalytic activity over hydrazine hydrate decomposition for hydrogen production and storage[J].Catalysis Today,2009,146 (1–2):196-201.
[30] Singh S K,Zhang X B,Xu Q. Room-temperature hydrogen generation from hydrous hydrazine for chemical hydrogen storage[J].Journal of the American Chemical Society,2009,131(29):9894-9895.
[31] Singh S K,Xu Q. Complete conversion of hydrous hydrazine to hydrogen at room temperature for chemical hydrogen storage[J].Journal of the American Chemical Society,2009,131(50):18032-18033.
[32] Singh S K,Xu Q. Bimetallic Ni-Pt nanocatalysts for selective decomposition of hydrazine in aqueous solution to hydrogen at room temperature for chemical hydrogen storage[J].Inorganic Chemistry,2010,49(13):6148-6152.
[33] Singh S K,Xu Q A. Bimetallic nickel-iridium nanocatalysts for hydrogen generation by decomposition of hydrous hydrazine[J].Chemical Communications,2010,46(35):6545-6547.
[34] Singh S K,Iizuka Y,Xu Q. Nickel-palladium nanoparticle catalyzed hydrogen generation from hydrous hydrazine for chemical hydrogen storage[J].International Journal of Hydrogen Energy,2011,36(18):11794-11801.
[35] Liu M,Zheng Y,Xie S,et al. Facile synthesis of Pd-Ir bimetallic octapods and nanocages through galvanic replacement andco-reduction,and their use for hydrazine decomposition[J].Physical Chemistry Chemical Physics,2013,15(28):11822-11829.
[36] Singh S K,Singh A K,Aranishi K,et al. Noble-metal-free bimetallic nanoparticle-catalyzed selective hydrogen generation from hydrous hydrazine for chemical hydrogen storage[J].Journal of the American Chemical Society,2011,133(49):19638-19641.
[37] Tong D G,Zeng X L,Chu W,et al. Preparation of monodispersed cobalt–boron spherical nanoparticles and their behavior during the catalytic decomposition of hydrous hydrazine[J].Materials Research Bulletin,2010,45(4):442-447.
[38] Tong D G,Chu W,Wu P,et al. Honeycomb-like Co-B amorphous alloy catalysts assembled by a solution plasma process show enhanced catalytic hydrolysis activity for hydrogen generation[J].RSCAdvances,2012,2(6):2369-2376.
[39] Manukyan K V,Cross A,Rouvimov S,et al. Low temperature decomposition of hydrous hydrazine over FeNi/Cu nanoparticles[J].Applied Catalysis A:General,2014,476:47-53.
[40] Song J,Ran R,Shao Z. Hydrazine as efficient fuel for low-temperature SOFC throughex-situcatalytic decomposition with high selectivity toward hydrogen[J].International Journal of Hydrogen Energy,2010,35(15):7919-7924.
[41] Zhao B,Song J,Ran R,et al. Catalytic decomposition of hydrous hydrazine to hydrogen over oxide catalysts at ambient conditions for PEMFCs[J].International Journal of Hydrogen Energy,2012,37 (1):1133-1139.
[42] Wang J,Zhang X B,Wang Z L,et al. Rhodium-nickel nanoparticles grown on graphene as highly efficient catalyst for complete decomposition of hydrous hydrazine at room temperature for chemical hydrogen storage[J].Energy & Environmental Science,2012,5(5):6885-6888.
[43] Singh A K,Xu Q. Metal-organic framework supported bimetallic Ni-Pt nanoparticles as high-performance catalysts for hydrogen generation from hydrazine in aqueous solution[J].Chem. Cat. Chem.,2013,5(10):3000-3004.
[44] He L,Huang Y,Wang A,et al. Surface modification of Ni/Al2O3with Pt:Highly efficient catalysts for H2generationviaselective decomposition of hydrous hydrazine[J].Journal of Catalysis,2013,298:1-9.
[45] He L,Huang Y,Liu X Y,et al. Structural and catalytic properties of supported Ni–Ir alloy catalysts for H2generationviahydrous hydrazine decomposition[J].Applied Catalysis B:Environmental,2014,147:779-788.
[46] Wang H L,Yan J M,Wang Z L,et al. Highly efficient hydrogen generation from hydrous hydrazine over amorphous Ni0.9Pt0.1/Ce2O3nanocatalyst at room temperature[J].Journal of Materials Chemistry A,2013,1(47):14957-14962.
[47] Song-Il O,Yan J M,Wang H L,et al. High catalytic kinetic performance of amorphous CoPt NPs induced on CeOxfor H2generation from hydrous hydrazine[J].International Journal of Hydrogen Energy,2014,39(8):3755-3761.
[48] He L,Huang Y,Wang A,et al. A noble-metal-free catalyst derived from Ni-Al hydrotalcite for hydrogen generation from N2H4·H2O decomposition[J].Angewandte Chemie International Edition,2012,51(25):6191-6194.
[49] He L,Huang Y,Wang A,et al. H2production by selective decomposition of hydrous hydrazine over Raney Ni catalyst under ambient conditions[J].AIChE Journal,2013,59(11):4297-4302.
[50] Zhang J,Kang Q,Yang Z,et al. A cost-effective NiMoB-La(OH)3catalyst for hydrogen generation from decomposition of alkaline hydrous hydrazine solution[J].Journal of Materials Chemistry A,2013,1(38):11623-11628.
[51] Tong D G,Chu W,Wu P,et al. Mesoporous multiwalled carbon nanotubes as supports for monodispersed iron-boron catalysts:Improved hydrogen generation from hydrous hydrazine decomposition[J].Journal of Materials Chemistry A,2013,1(2):358-366.
[52] Tong D G,Tang D M,Chu W,et al. Monodisperse Ni3Fe single-crystalline nanospheres as a highly efficient catalyst for the complete conversion of hydrous hydrazine to hydrogen at room temperature[J].Journal of Materials Chemistry A,2013,1(21):6425-6432.
[53] Gao W,Li C,Chen H,et al. Supported nickel–iron nanocomposites as a bifunctional catalyst towards hydrogen generation from N2H4·H2O[J].Green Chemistry,2014,16(3):1560.
[54] 張義煌,董輝,田丙倫,等. 一種用于肼分解催化劑制備及應用:中國,1348835A[P]. 2002-05-15.
[55] Zhang P X,Wang Y G,Huang Y Q,et al. Density functional theory investigations on the catalytic mechanisms of hydrazine decompositions on Ir(111)[J].Catalysis Today,2011,165(1):80-88.
[56] Falconer J L,Wise H. Temperature programmed desorption spectroscopy of N2H4decomposition on Al2O3-supported Ir catalyst[J].Journal of Catalysis,1976,43(1-3):220-233.
[57] 倪平,儲偉,王立楠,等. 氨催化分解制備無COx的氫氣催化劑研究進展[J]. 化工進展,2006,25(7):739-743.
[58] Maurel R,Menezo J C. Catalytic decomposition of15N-labeled hydrazine on alumina-supported metals[J].Journal of Catalysis,1978,51(2):293-295.
[59] Block J,Schulz-Ekloff G. The catalytic decomposition of nitrogen-15-labeled hydrazine on MgO-supported iron[J].Journal of Catalysis,1973,30(2):327-329.
Progress in the catalytic decomposition of hydrous hydrazine for hydrogen production at mild conditions
HE Lei,HUANG Yanqiang,WANG Aiqin,WANG Xiaodong,ZHANG Tao
(Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,Liaoning,China)
:Hydrous hydrazine,N2H4·H2O,could be a promising hydrogen storage material due to its high hydrogen content (8.0wt%) and safe handling at mild conditions,with N2as the only by-product. In this paper,the development of catalytic systems in hydrous hydrazine decomposition for H2production was reviewed,including metallic nanoparticles,complex oxides,and supported catalysts. The mechanism of hydrazine decomposition was briefly introduced. The influencing factors for promoting H2selectivity were discussed,including metal property,reaction conditions,and promoters. Also,the advantages and disadvantages of the reported catalysts were summarized,and performance development in hydrous hydrazine decomposition and other related reactions was also included.
hydrous hydrazine;hydrogen production;catalyst;selectivity
TQ 246
A
1000-6613(2014)11-2956-08
10.3969/j.issn.1000-6613.2014.11.022
2014-04-25;修改稿日期:2014-06-03。
國家自然科學基金(21103173)及大連化學物理研究所潔凈能源基礎研究專項基金(DICP M201307)項目。
賀雷(1986—),女,博士聯系人:黃延強,副研究員。E-mail yqhuang@dicp.ac.cn。

