微型化學實驗教學淺談
●張正超
所謂微型化學實驗,就是以盡可能少的化學試劑來獲取所需化學信息的實驗方法與技術,它具備兩個突出的特點:微型化學實驗中所需藥品用量較少;在微型化的儀器裝置中進行化學實驗。微型化學實驗對化學課堂教學有如下特點:
一、微型化學實驗操作簡便,安全
高中常規實驗比較多,有毒的實驗過半。固體有毒殘留物較好處理。氣體有毒殘留物不便于回收,故很多學校就配了通風櫥,把有毒氣體抽到大氣中,僅僅是轉移了污染物,采用微型實驗可將污染降低到最低限度。 氯氣的制備及其化學性質的實驗使用標準儀器就能很好地進行演示,儀器裝置十分龐大,實驗步驟相當繁瑣,而且不便于學生操作,并且實驗用藥劑量大,并在開放的環境里做,造成氯氣外逸危害師生的健康。因此,讓學生利用微型實驗裝置來做氯氣的制備和性質實驗,速度快、試劑用量少、現象明顯、而且污染小。
二、微型化學實驗取材廣泛,制作方便
通過氯氣微型實驗的啟發,班上的同學,運用生活中廢棄的塑料杯和醫用橡膠管組合成一套簡易的微型實驗儀器來制備并探究氯氣的化學性質,具體如下:
按圖1 連接好裝置。向六個小杯子中分別加入:
1 號杯:加入少量的高錳酸鉀固體(墊上錫箔防腐蝕);
2 號杯:加入少量的濃硫酸;
3 號杯:放入一片干燥的紅紙片;
4 號杯:放入一片濕潤的紅紙片;
5 號杯:放入一片濕潤的碘化鉀淀粉試紙;
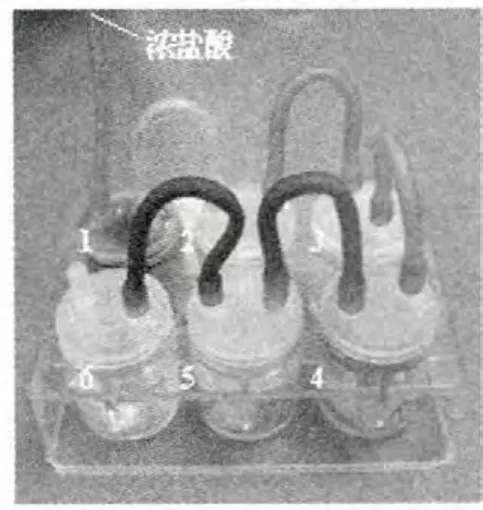
圖1
6 號杯:加入適量的氫氧化鈉溶液。
最后向1 號杯滴入幾滴濃鹽酸,觀察所發生的現象。
基于氯氣實驗的思考,教師積極引導學生對SO2的綜合實驗進行思考,提出改進方案,學生根據微型實驗設計出實驗裝置。
(一)該裝置的優點
1.用量少,污染小。 SO2是有刺激性氣味的有毒氣體,常規實驗試管口是敞開的,逸散出來,污染空氣;
2.現象明顯,直觀,實驗周期短。
(二)該裝置的不足之處
不能很好的證明SO2對品紅溶液漂白的暫時性和可逆性。 鑒于此,師生提出以下實驗:
1.準備階段
如圖2 裝置A,連接裝置,錐形瓶中加入20mL被SO2漂白后的品紅溶液,用注射器a 預先吸入2mL滴有酚酞的紅色的氫氧化鈉稀溶液,用針尖扎在膠塞上,最后將帶有注射器和玻璃導管的膠塞塞緊錐形瓶口,保證氣密性完好后備用。

圖2
2.操作步驟及現象
(1)SO2的暫時性漂白實驗
用酒精燈火焰加熱錐形瓶中的無色溶液,可以看到瓶內有氣泡產生,溶液顏色逐漸變紅。產生的氣體充滿整個錐形瓶內,隨著氣體產生量的增多,瓶內壓強不斷增大,對瓶內的溶液產生壓力,進而將瓶中的溶液通過導管壓入注射器b 中,同時推動注射器b 的活塞移動。 直到錐形瓶中的溶液全部進入注射器時(如圖2B 所示)停止加熱。
(2)SO2使品紅溶液褪色實驗
圖2B 裝置靜置冷卻一段時間后, 將注射器b的活塞往里推,讓b 中液體進入錐形瓶中,并與瓶內SO2反應,反復推拉幾次,直到溶液顏色褪去(如圖2A 所示)。 這樣又可以重復操作(1)。
(3)驗證產生的氣體是SO2
重復操作(1)后,這時裝置處于圖B 狀態,把注射器a 的針尖刺穿膠塞,抽取錐形瓶中的氣體,直至注射器a 中紅色的氫氧化鈉溶液變為無色(如圖2C所示)。
3.實驗反思
(1)探究干燥的SO2氣體本身是否能漂白品紅
【操作及現象】:按圖3 裝置進行實驗,實驗中控制SO2的速度,以每秒鐘3 個氣泡為宜通入品紅的酒精溶液,半小時后,品紅酒精溶液不褪色,說明二氧化硫本身與氯氣一樣,不能直接用于漂白。
(2)探究濕潤的SO2氣體能否漂白品紅

圖3
【操作及現象】:實驗中控制SO2的速度,以每秒鐘3 個氣泡為宜通入品紅的水溶液,半小時后,品紅溶液褪色,說明濕潤二氧化硫能直接用于漂白。
(3)探究SO2能使品紅溶液褪色的微粒是H2SO3,中的哪一種。
【學生實驗】取等體積、相同濃度的品紅水溶液于兩支試管中,分別加入少量亞硫酸鈉固體和亞硫酸氫鈉固體,兩支試管中的品紅都褪色,由此,兩組同學得出結論:使品紅褪色的微粒是不是H2SO3。
【學生實驗結果分析】
兩組同學分別采用單一變量法進行探究,可是兩組同學均忽略了兩種鹽的水解問題,在兩種鹽溶液中均有只是量的相對多少而已。
【師生共同設計探究實驗】
師生做了進一步探究,具體做法如下:分別取相同濃度的品紅水溶液各20mL 于兩只小燒杯中,兩只燒杯中同時一次性各加入20mL 0.1mol/L 的亞硫酸鈉溶液和20mL 0.1mol/L 的亞硫酸氫鈉溶液,發現加入亞硫酸鈉溶液的品紅褪色較快。
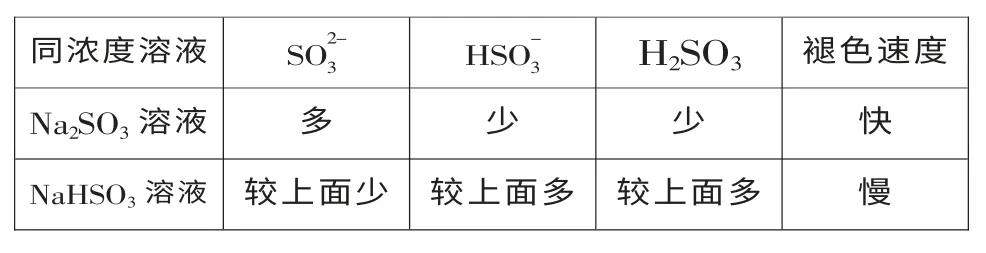
微粒濃度(多少)與褪色快慢的關系如下表所示
三、微型化學實驗助推教師專業發展
教師可以在探索的微型實驗過程中,加深對實驗的綜合理解,豐富自我的經驗。 教師研制一套微型裝置,來反應制取乙烯,用乙烯利溶液為原料制備乙烯。
乙烯利,易溶于水,甲醇,微溶于甲苯,不溶于石油醚。 乙烯利化學名稱為2-氯乙基膦酸,在pH 小于3 的酸性溶液中穩定存在,在pH 大于3.5 以及堿性溶液中分解放出乙烯。 乙烯利水解反應方程式為:
【實驗結論】
乙烯既能被高錳酸鉀氧化,又能與溴發生加成反應,說明乙烯分子中含有不飽和鍵。
【實驗反思】
能使溴水褪色, 一定就能說明乙烯與溴水發生了加成反應嗎? 難道沒有發生取代反應的可能嗎?
【設計思考】比較乙烯和Br2反應的兩種反應類型的方程式
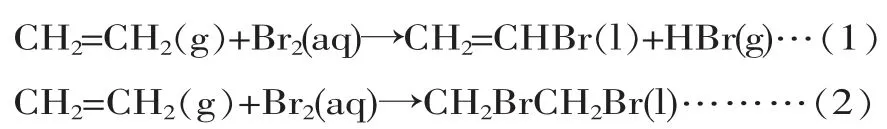
對比結果:
方程式(1)取代反應后溶液呈酸性;反應前后無壓強差。 方程式(2)加成反應后溶液接近中性;且反應后有壓強差的存在。
【實驗設計】
根據反應后溶液的酸堿性不同進行設計。
(1)操作:將干燥的PH 試紙放于表面皿的上,用潔凈干燥的玻璃棒蘸取反應后的溶液,點在PH試紙的中央,迅速與標準比色卡對照,觀察PH 試紙顏色對應的溶液酸堿性。
(2)現象及結論:PH 呈現出淺綠色;證明溶液接近中性。
(3)實驗反思:該實驗中如果Br2如果有大量剩余,那必然會干擾溶液酸堿性的檢測,所以實驗過程中盡量確保Br2盡可能反應充分。 此外,證明溶液顯酸性的方法很多,只要言之有理,行之有效均可。

