甲氨蝶呤/層狀雙金屬氫氧化物的性能調(diào)控及細(xì)胞生物實(shí)驗(yàn)研究
霍曉磊 柳素青 李淑萍
(江蘇省生物醫(yī)藥功能材料協(xié)同創(chuàng)新中心,江蘇省生物功能材料重點(diǎn)實(shí)驗(yàn)室,南京師范大學(xué)化學(xué)與材料科學(xué)學(xué)院,南京210097)
0 引 言
層狀雙金屬氫氧化物(Layered Double Hydroxide,LDH),也稱類水滑石 (hydrotalcite like compounds),是一類由帶正電荷的金屬氫氧化物層和層間充斥的可交換陰離子所構(gòu)成的層狀化合物,化學(xué)通式可表示為:[M2+1-xM3+x(OH)2]x+[An-]x/n·mH2O,其中 M2+表示+2價(jià)金屬離子,M3+表示+3價(jià)金屬離子,An-表示層間陰離子,x為每摩爾LDH中M3+的摩爾數(shù);m是每摩爾LDH中結(jié)晶水的摩爾數(shù)[1-4]。由于LDH具有層間陰離子的可交換性和層間空間的可調(diào)性,因此,可以將某些無機(jī)、有機(jī)、配合物陰離子以及一些生物藥物分子等插入其層間,且LDH獨(dú)特的層板結(jié)構(gòu),能夠有效地保護(hù)插入其中的分子或離子[5-8]。LDH為藥物載體不僅可以提高藥物的安全性、有效性,還可以提高藥物的穩(wěn)定性和溶解度,控制藥物的釋放速率,因而具有廣泛的應(yīng)用價(jià)值,是近年來新發(fā)展的一個(gè)非常活躍的領(lǐng)域[9-12]。
甲氨蝶呤(Methotrexatum,簡(jiǎn)稱MTX)是一類抗葉酸類抗腫瘤藥,主要通過對(duì)二氫葉酸還原酶的抑制而達(dá)到阻礙腫瘤細(xì)胞DNA的合成,從而抑制腫瘤細(xì)胞的生長(zhǎng)與繁殖,主要適用于急性白血病、乳腺癌、絨毛膜上皮癌及惡性葡萄胎、頭頸部腫瘤、骨腫瘤、白血病腦膜脊髓浸潤(rùn)、肺癌、生殖系統(tǒng)腫瘤、肝癌、頑固性普通牛皮癬、系統(tǒng)性紅斑狼瘡、皮肌炎等自身免疫病[13]。MTX價(jià)格便宜、藥效顯著,但它具有不良反應(yīng)嚴(yán)重、體內(nèi)半衰期短、組織分布廣泛、器官靶向性差等缺點(diǎn)[14-15]。因此,減少M(fèi)TX的不良反應(yīng),提高其生物利用度,成為醫(yī)藥界和科學(xué)界的研究熱點(diǎn)。研究表明,甲氨蝶呤(MTX)嵌入LDH層間后,因靜電相互作用而使其穩(wěn)定性大為增加;相同藥物濃度下,MTX/LDH復(fù)合物的藥效約為MTX本身的5 000倍[16]。Choy等[16-17]以LDH為載體,采用共沉淀法成功合成了MTX/LDH納米復(fù)合物,并分別將MTX和MTX/LDH作用于人類骨肉瘤細(xì)胞(SaOS-2)中,研究發(fā)現(xiàn)MTX/LDH抑制腫瘤細(xì)胞生長(zhǎng)的效率遠(yuǎn)遠(yuǎn)高于純MTX的,且體內(nèi)釋放半衰期延長(zhǎng),器官靶向性增強(qiáng)。
制備MTX/LDH納米復(fù)合物最常用的方法是共沉淀法。共沉淀法具有操作簡(jiǎn)單、條件容易控制等優(yōu)點(diǎn),但同時(shí)存在著粒徑分布難以控制、易團(tuán)聚、單分散性差等缺點(diǎn)[18],對(duì)實(shí)際應(yīng)用造成了很大的影響。我們課題組采用了改進(jìn)的共沉淀法[19-20]成功制備出了單分散性好,粒徑分布均一的MTX/LDH復(fù)合物。從應(yīng)用層面上看,一種新型的載藥系統(tǒng)無論其具有多么優(yōu)良的理化及藥劑學(xué)特性,最終均應(yīng)以生物效應(yīng)來評(píng)價(jià)其實(shí)際應(yīng)用。本文采用了改進(jìn)的共沉淀法,并通過控制水熱處理時(shí)間的方式來調(diào)控MTX/LDH納米復(fù)合物的性能,重點(diǎn)研究了MTX/LDH納米復(fù)合物對(duì)肺癌細(xì)胞A549的抑制作用。我們的研究結(jié)果發(fā)現(xiàn)MTX/LDH納米復(fù)合物的物化性能與抗癌效果之間存在著某種密切的關(guān)系,我們首次利用分散系數(shù)ε對(duì)此進(jìn)行了量化,這為MTX/LDH納米復(fù)合物的結(jié)構(gòu)-藥效相關(guān)性的研究打下了堅(jiān)實(shí)的基礎(chǔ)。
1 實(shí)驗(yàn)部分
1.1 儀器與試劑
儀器:用D/max-2500PC型XRD儀測(cè)定樣品的相結(jié)構(gòu),靶壓200 kV,靶流 100 mA,Cu Kα射線源為光源,λ=0.154 06 nm,用石墨單色器濾波;H-7650-HITACHI型TEM儀觀察粒子的大小和形貌,工作電壓為200 KV;Bruker Tensor 27型FT-IR光譜儀,樣品與KBr質(zhì)量比為1∶100;Cary50型紫外可見分光光度計(jì),單波長(zhǎng)測(cè)量,波長(zhǎng)為306 nm,5%CO2培養(yǎng)箱,超凈工作臺(tái);TCL-16C離心機(jī)。
試劑:Mg(NO3)2·6H2O(固含量不少于 99%),分析純,廣東汕頭市西隴化工廠有限公司;Al(NO3)3·9H2O(固含量不少于99%),分析純,上海新寶精細(xì)化工廠;NaOH(固含量不少于96%),分析純,天津市化學(xué)試劑三廠;甲氨蝶呤(MTX),浙江省湖州展望藥業(yè)有限公司;乙醇(含量不少于 99.7%),分析純,上海國(guó)藥集團(tuán)化學(xué)試劑有限公司;二甲亞砜(DMSO),分析純,上海生物工程有限公司;小牛血清(BB001),上海生物工程有限公司;DMEM(編號(hào)PB0680)培養(yǎng)基,上海生物工程有限公司;MTT(Sigma編號(hào)T0793),上海生物工程有限公司;胰蛋白酶(PB0680),上海生物工程有限公司;酶標(biāo)儀(Thermo MK4,USA);實(shí)驗(yàn)用水均為去離子水。
1.2 共沉淀法合成MTX/LDH
稱取 0.769 2 g Mg(NO3)2·6H2O、0.562 7 g Al(NO3)3·9H2O溶于乙醇與水體積比為1∶3的混合溶液中,并轉(zhuǎn)移至三頸燒瓶中,在恒定溫度為60℃的條件下磁力攪拌,并通以氮?dú)狻?.340 8 g的MTX溶于20 mL乙醇與2 mL 5%的氨水混合液中,迅速倒入三頸燒瓶中,用10%的氨水作為沉淀劑,控制沉淀劑以0.1 mL·s-1的滴加速率滴加到上述混合溶液中,調(diào)節(jié)溶液的pH值至9.5,恒溫繼續(xù)攪拌,保溫1小時(shí)。待反應(yīng)結(jié)束后,在4 000 r·min-1轉(zhuǎn)速下將所得產(chǎn)物用無水乙醇離心洗滌2遍,并用去離子水離心洗滌3遍,每次離心時(shí)間為3 min,以清除吸附在表面的MTX。將沉淀分散于25 mL水中,轉(zhuǎn)移至50 mL反應(yīng)釜(內(nèi)襯為聚四氟乙烯)內(nèi),80℃條件下水熱處理6~48 h。水熱處理完畢之后,干燥得到產(chǎn)物。
1.3 緩釋性能研究
根據(jù)測(cè)出的載藥量計(jì)算出做緩釋性能實(shí)驗(yàn)所需的MTX/LDH的量,將稱量好的MTX/LDH納米復(fù)合物置于pH值為7.4(500 mL)的磷酸緩沖液(按照中國(guó)藥典2005年版第二部附錄XIVE方法配置)中,在(37±0.5)℃下恒溫?cái)嚢瑁欢ǖ臅r(shí)間間隔內(nèi),取3 mL溶液10 000 r·min-1下離心30 s后取其上清液,用紫外-可見分光光度計(jì)在306 nm處測(cè)其吸光度,并根據(jù)標(biāo)準(zhǔn)曲線 A=0.051 85c+0.000 62(r=0.999 99,n=7)計(jì)算 MTX 的累積釋放量。
1.4 MTT細(xì)胞生物實(shí)驗(yàn)
人肺癌A549細(xì)胞接種于100 mL的培養(yǎng)中,培養(yǎng)基為含有10%小牛血清的DMEM,置于37℃,5%CO2恒溫培養(yǎng)箱內(nèi)培養(yǎng)箱孵育,用顯微鏡觀測(cè)待細(xì)胞長(zhǎng)滿培養(yǎng)瓶的80%~90%,用0.25%的胰蛋白酶消化,傳代。用10%DMEM將懸浮的細(xì)胞接種到96孔板,每孔體積100 μL,正常培養(yǎng)24 h后吸走廢液,加入不同濃度的 MTX和MTX/LDH,如 20、40、60、80、120 μg·mL-1(用 DMEM 稀釋),每組設(shè) 6 孔重復(fù),對(duì)照組加 100 μL DMEM(無血清),分別培養(yǎng) 24 h后棄除96孔板中的殘藥和DMEM,每孔加入新鮮DMEM(無血清)90 μL,10 μL MTT(5 mg·mL-1,pH=7.4的 PBS配制),繼續(xù)培養(yǎng)4 h后,終止培養(yǎng),小心吸棄孔內(nèi)培養(yǎng)上清液,每孔加100 μL DMSO,震蕩5 min,用酶標(biāo)儀檢測(cè)。
2 結(jié)果與討論
2.1 XRD分析
圖1為不同水熱處理時(shí)間下制備的MTX/LDH的XRD圖,考察了100℃下水熱處理時(shí)間分別為6、12、24、36 和 48 h 下得到的 MTX/LDH 納米復(fù)合物的性能。從圖中可以看出水熱處理時(shí)間較短(6 h)時(shí),所得產(chǎn)物的XRD特征衍射峰峰值較低。12~48 h下制備的MTX/LDH納米復(fù)合物都具有尖銳的(003)、(006)面特征衍射峰,基線低且平穩(wěn),衍射峰峰型窄且尖,表明制備的MTX/LDH納米復(fù)合物晶相單一,晶體結(jié)構(gòu)一致,晶面生長(zhǎng)的有序程度高,結(jié)晶度好。分析XRD圖可知,水熱處理6 h后得到的樣品,其衍射峰強(qiáng)度最低,結(jié)晶度最差,水熱處理12 h后的樣品衍射峰強(qiáng)度最高,峰形最好,這說明水熱處理12 h后得到的MTX/LDH納米復(fù)合物的晶型發(fā)育最完整。
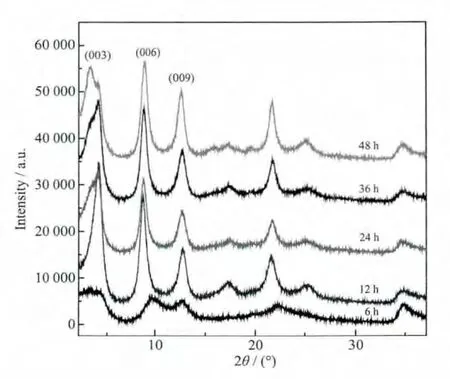
圖1 不同水熱處理時(shí)間下制得的MTX/LDH納米復(fù)合物的XRD圖Fig.1 XRD patterns of MTX/LDH nanohybrids obtained at different hydrothermal treatment time
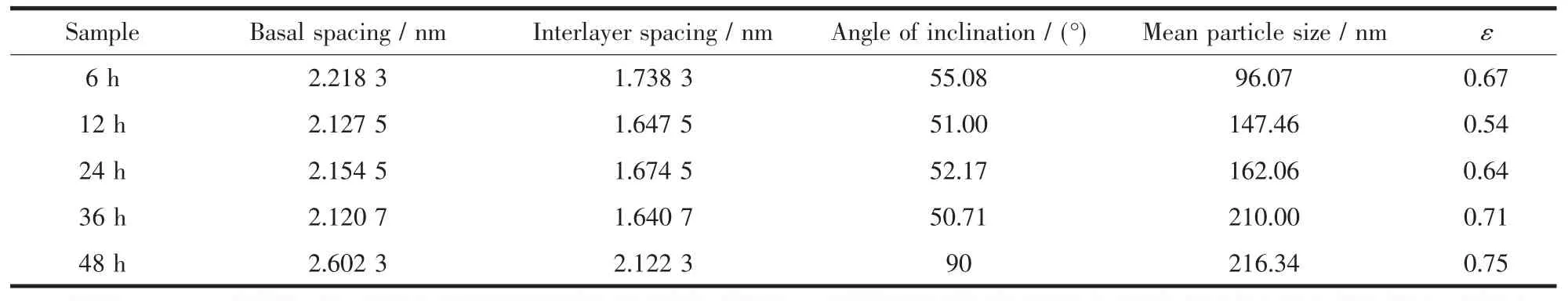
表1 不同水熱處理時(shí)間下制備的MTX/LDH的晶體結(jié)構(gòu)數(shù)據(jù)Table 1 Characteristic data of MTX/LDH nanohybrids obtained at different hydrothermal treatment time
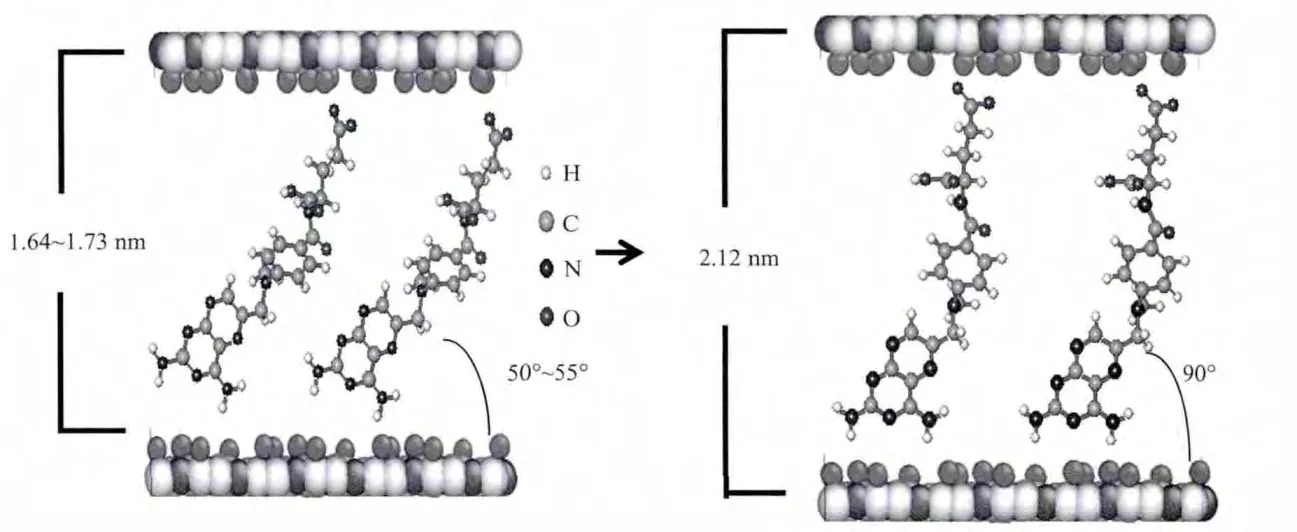
圖2 不同水熱處理時(shí)間下得到的MTX/LDH納米復(fù)合物的排列方式示意圖(左)6~36 h;(右)48 hFig.2 Scheme of the arrangement of MTX/LDH nanohybrids obtained at different hydrothermal treatment time(left)6~36 h;(right)48 h
表1為不同水熱處理時(shí)間下得到的MTX/LDH納米復(fù)合物的特征數(shù)據(jù)及平均粒徑。根據(jù)布拉格公式可以計(jì)算出MTX/LDH的層間距,由于LDH層板厚度為0.48 nm[21],可以得到樣品的通道高度隨著水熱處理時(shí)間的延長(zhǎng)分別為 1.738 3、1.647 5、1.674 5、1.640 7 和 2.122 3 nm。甲氨蝶呤分子的長(zhǎng)度為2.12 nm[22],據(jù)此我們模擬了不同水熱處理時(shí)間下制得的MTX/LDH納米復(fù)合物空間排列示意圖,如圖2所示:隨著水熱處理時(shí)間的增加,MTX在LDH層間從單分子傾斜排列變化到垂直單分子排列。平均粒徑是通過測(cè)定多張(>50,保證200個(gè)粒子以上)TEM圖中粒子的粒徑得到的,也列于表1。從中可以看出:不同的處理時(shí)間對(duì)產(chǎn)物的層間距有非常大的影響,當(dāng)水熱處理時(shí)間較短時(shí)(6~36 h),MTX以單層傾斜的方式排列,當(dāng)時(shí)間增加到48 h時(shí),層間距急劇增大,MTX以單層垂直的方式排列。
2.2 FT-IR分析
圖3顯示了不同水熱處理時(shí)間下得到的MTX/LDH納米復(fù)合物的FT-IR光譜圖。從圖3可以看出,3 400 cm-1處的寬峰對(duì)應(yīng)于LDH層板上和層間水分子的OH伸縮峰[23]。1 614 cm-1和1 456 cm-1處的吸收峰對(duì)應(yīng)于MTX中芳香環(huán)的C=C伸縮振動(dòng)峰[21],這些峰的出現(xiàn)表明MTX已經(jīng)成功插層到LDH層間。1 207 cm-1處的吸收峰為MTX的C-N鍵。在低頻振動(dòng)區(qū)間,出現(xiàn)的吸收峰對(duì)應(yīng)著點(diǎn)陣振動(dòng)模式(Al-O,Mg-O,Al-O-Mg 等)。
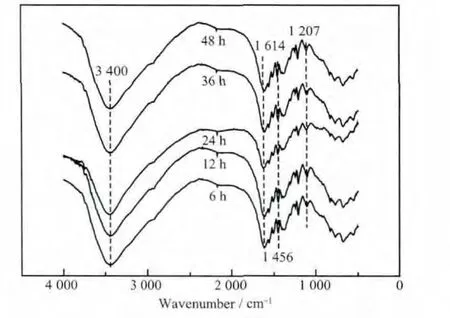
圖3 不同水熱處理時(shí)間下得到的MTX/LDH納米復(fù)合物的FT-IR光譜Fig.3 FT-IR spectra of MTX/LDH nanohybrids obtained at different hydrothermal treatment time
2.3 TEM圖分析
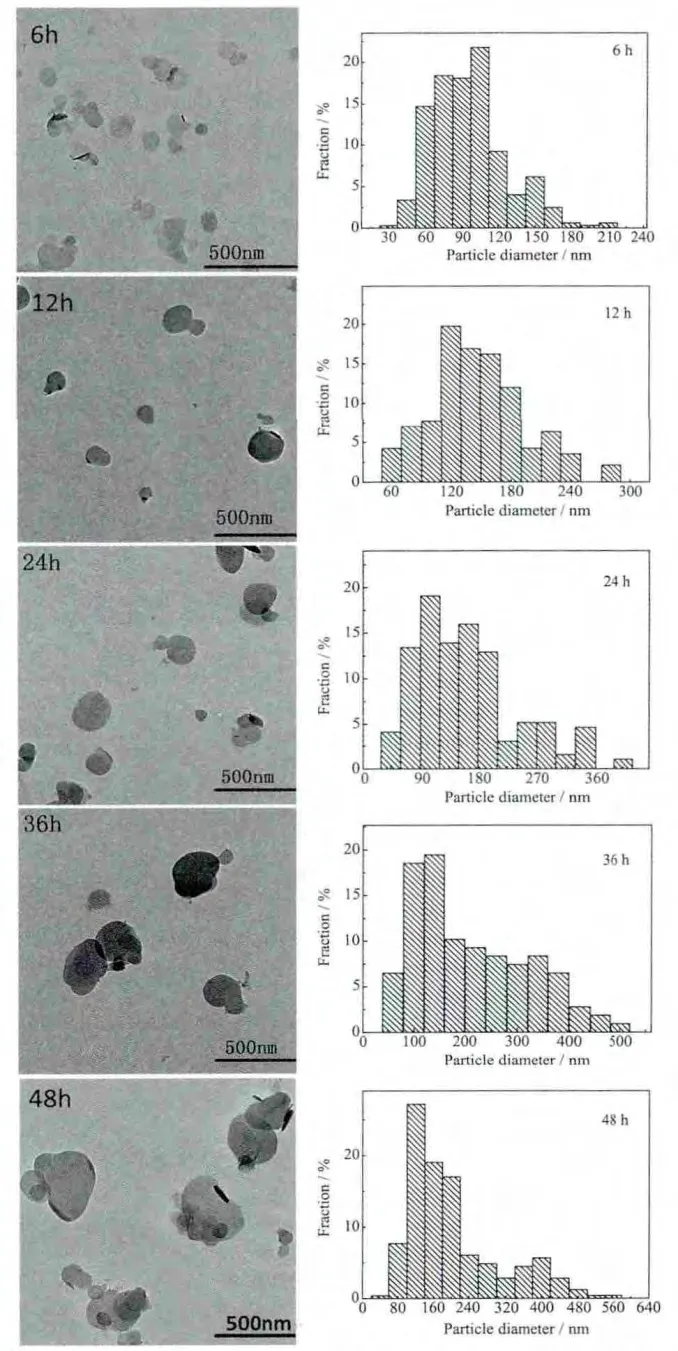
圖4 不同水熱處理時(shí)間下制備的MTX/LDH納米復(fù)合物的TEM圖和粒徑分布圖Fig.4 TEM images and distribution of particle size of MTX/LDH nanohybrids obtained at different hydrothermal treatment time
圖4為不同水熱處理時(shí)間下制備的MTX/LDH納米復(fù)合物的形貌及相應(yīng)的粒徑分布圖。從TEM圖中可以觀察到不同水熱處理時(shí)間下制備的MTX/LDH納米復(fù)合物基本呈圓形,水熱處理時(shí)間的不同導(dǎo)致了粒子粒徑發(fā)生變化。隨著水熱處理時(shí)間的延長(zhǎng),粒子粒徑逐漸變大。但水熱處理時(shí)間過短或過長(zhǎng)則會(huì)導(dǎo)致單分散性降低、形貌不規(guī)則程度的加劇。不同水熱處理時(shí)間下得到的MTX/LDH納米復(fù)合物的平均粒徑列于表1中。從表中可以看出,隨著水熱處理時(shí)間的延長(zhǎng),MTX/LDH粒子的平均粒徑逐漸增大,增加速率先快后慢。48 h時(shí)粒徑最大。從TEM圖中可看出處理時(shí)間為6 h或超過24 h后,粒子單分散性變差,粒徑均勻度變差。12 h和24 h得到的粒子單分散性好且粒子形狀均勻。綜上所述,從粒子形貌、單分散性、結(jié)晶度等角度來分析,12 h樣品的物化性能最為優(yōu)良。
2.4 緩釋性能研究
首先對(duì)不同水熱處理時(shí)間得到的5種樣品進(jìn)行了載藥量的測(cè)定,6~48 h樣品的載藥量分別為42.6%、52.3%、47.6%、52.7%和 51.5%,據(jù)此可以看出,LDH是一類載藥能力很強(qiáng)的載體,復(fù)合物的平均粒徑與其載藥量之間并無直接關(guān)系。圖5為這5種樣品的緩釋曲線圖。從圖中可以看出,5種樣品均呈現(xiàn)出良好的緩釋性能,釋放速率先快后慢,前150 min是一個(gè)較為快速的釋放過程,而以后的150~500 min釋放速率緩慢,整個(gè)過程中未出現(xiàn)突釋現(xiàn)象。這種釋放模式非常適合臨床應(yīng)用,開始時(shí)的快速釋放能滿足最初的治療目的,而后來的控釋-緩釋模式則能保持體內(nèi)藥物濃度的穩(wěn)定,從而達(dá)到最佳的治療。其中48 h樣品釋放速率最慢,從表1可以看出,48 h樣品與36 h樣品粒徑相近,分別為216.34 nm 和 210.00 nm,而 MTX 在 LDH 層間排列方式有較大差異,36 h樣品中MTX在LDH層間的傾斜角度為50.71,48 h樣品MTX在LDH層間以單層垂直方式排列。從圖5中可以看出36 h樣品的釋放速率遠(yuǎn)遠(yuǎn)大于48 h樣品的釋放速率:100 min時(shí),36 h的釋放達(dá)到63%,而48 h樣品僅為54%,500 min時(shí),36 h最終釋放率為75%,48 h樣品僅達(dá)到66%。這說明了層間排列方式的不同導(dǎo)致了其釋放速率不同,層間傾斜角度越大,釋放速率越慢,與段雪等人的結(jié)論一致[24],段雪的研究表明層間陰離子在層間的不同排布方式會(huì)極大地影響其釋放速率。
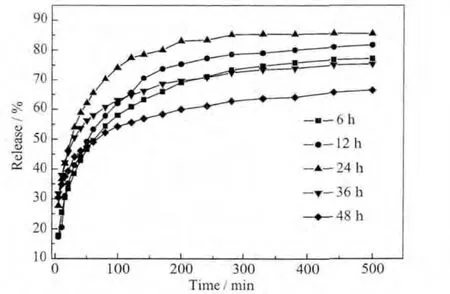
圖5 不同水熱處理時(shí)間制得的MTX/LDH納米復(fù)合物的釋放曲線圖Fig.5 Release profiles of MTX/LDH nanohybrids obtained at different hydrothermal treatment time
2.5 動(dòng)力學(xué)模擬
一般來講,生物藥物/LDH納米復(fù)合物的釋藥機(jī)制主要有兩種:離子交換機(jī)理和LDH片層的溶蝕[25]。為了探索MTX/LDH納米復(fù)合物的釋藥機(jī)理,通常采用以下4種常用的數(shù)學(xué)模型對(duì)MTX/LDH的釋放過程進(jìn)行擬合[26-27]。
(1)一級(jí)方程:ln(1-Mt/M∞)=-kt,多用于描述釋放基質(zhì)溶解所引發(fā)的藥物釋放行為和離子交換過程;
(2)Higuchi方程:Mt/M∞=kt0.5,它是以 Fickian 擴(kuò)散定律為基礎(chǔ)提出的動(dòng)力學(xué)方程,適用于遵循擴(kuò)散控釋機(jī)理的釋藥過程;
(3)Bhaskar方程:ln(1-Mt/M∞)=-kt0.65,用于描述不規(guī)則擴(kuò)散或者粒內(nèi)擴(kuò)散機(jī)理;
(4)Ritger-Peppas方程:Mt/M∞=ktn,其中 n 為表征釋放機(jī)制的特征參數(shù)。當(dāng) 0.45<n<0.89 時(shí),藥物的釋放機(jī)制為non-Fickian擴(kuò)散,即擴(kuò)散與溶蝕并存;當(dāng) n<0.45 時(shí),為 Fickian 擴(kuò)散;當(dāng) n>0.89 時(shí),為骨架溶蝕機(jī)制;
以上4個(gè)方程中,其中Mt為t時(shí)間的累積釋放量,M∞為∞時(shí)累積釋放量,Mt/M∞為t時(shí)累積釋放率,k為釋放常數(shù)。
采用這4種常用的數(shù)學(xué)模型對(duì)MTX/LDH的體外釋放數(shù)據(jù)進(jìn)行動(dòng)力學(xué)擬合,其結(jié)果示于圖6,擬合數(shù)據(jù)列于表2。由擬合結(jié)果可知,采用First-order方程擬合得到的擬合因子R均較小,從圖6中可看出其擬合數(shù)據(jù)點(diǎn)離散嚴(yán)重,說明MTX/LDH納米復(fù)合物的釋藥機(jī)制不符合First-order方程。相對(duì)于Firstorder方程,采用Bhaskar方程擬合得到的擬合因子相對(duì)較高(僅 24 h 樣品的 R<0.95),初步判斷 MTX/LDH納米復(fù)合物在pH=7.4的磷酸緩沖液中釋放出MTX分子的機(jī)制屬于擴(kuò)散機(jī)制。進(jìn)一步采用Ritger-Peppas方程,從擬合結(jié)果 R>0.96 及 n<0.45 可判定,MTX/LDH納米復(fù)合物的釋藥機(jī)制屬于離子交換機(jī)理,且釋放過程為擴(kuò)散控制過程。最后采用parabolic-diffusion模型擬合得到了最高的擬合因子(R>0.98),說明MTX/LDH納米復(fù)合物的釋藥機(jī)制為粒內(nèi)擴(kuò)散或表面擴(kuò)散所引起的擴(kuò)散控制過程;也就是說,MTX/LDH納米復(fù)合物在釋放過程中主要是介質(zhì)中的HPO42-、H2PO4-將LDH層間的MTX陰離子置換出來,使得層間的MTX陰離子進(jìn)入到緩釋介質(zhì)中。綜上,MTX/LDH在模擬體液中釋放出MTX的機(jī)理為基于離子交換的多相擴(kuò)散過程,parabolicdiffusion模型能很好地闡述其釋放機(jī)理。
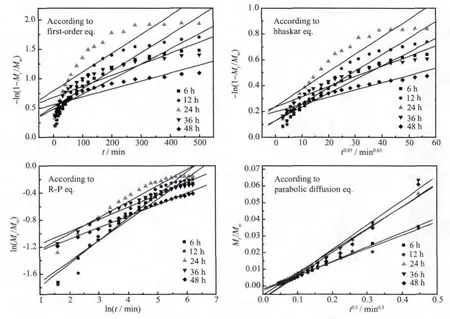
圖6 不同水熱處理時(shí)間下得到的MTX/LDH納米復(fù)合物釋放過程的動(dòng)力學(xué)擬合直線Fig.6 Plots of different kinetic models for the release of MTX from the MTX/LDH nanohybrids obtained at different hydrothermal treatment time
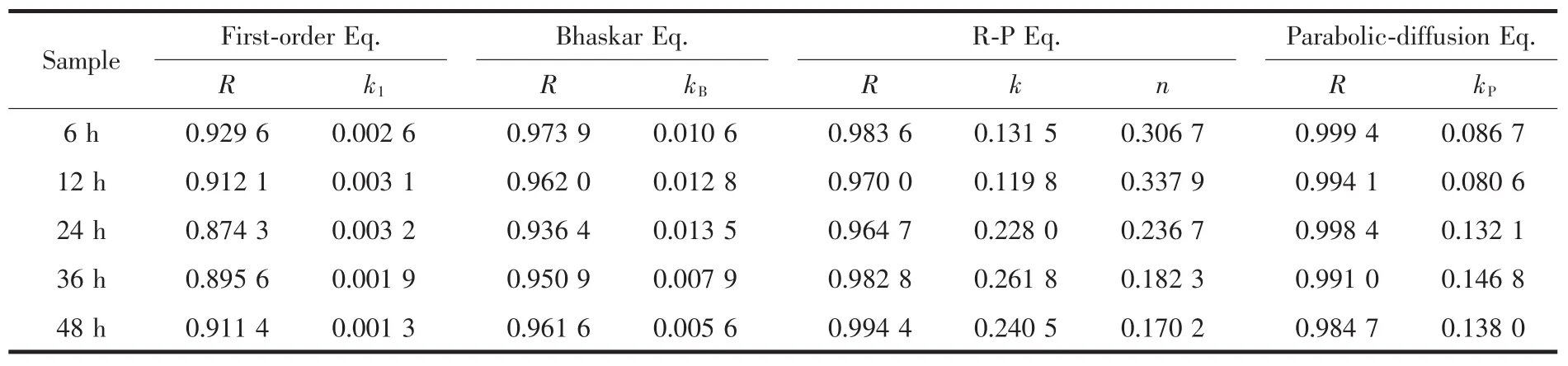
表2 不同水熱處理時(shí)間下制得的MTX/LDH納米復(fù)合物釋放過程的動(dòng)力學(xué)擬合數(shù)據(jù)Table 2 Fitting parameters of different kinetic models for the release of MTX from the MTX/LDH nanohybrids obtained at different hydrothermal treatment time
2.6 細(xì)胞生物實(shí)驗(yàn)探索
MTX/LDH納米復(fù)合物對(duì)某些癌細(xì)胞有非常明顯的抑制效果,關(guān)于MTX/LDH納米復(fù)合物抗癌-抑癌作用的研究,韓國(guó)科學(xué)家Choy等作出了大量的工作,他的研究結(jié)果表明,LDH母體即使在很高的濃度下對(duì)人體也是無害的,MTX/LDH納米復(fù)合物的抗癌效果隨著作用時(shí)間的延長(zhǎng)而增加,隨著復(fù)合物濃度的增加而增強(qiáng);粒徑在100~300 nm之間的復(fù)合物對(duì)癌細(xì)胞的攝入和治療效果最佳[16-17,28]。但是影響復(fù)合物抗癌-抑癌效果的關(guān)鍵因素目前還未有相關(guān)的報(bào)道,我們?cè)噲D進(jìn)行這方面的探索性研究。因而我們引入了一個(gè)新的參數(shù):分散系數(shù)ε,ε與粒子的粒徑和單分散性有關(guān)。ε值的提出鑒于這樣的出發(fā)點(diǎn):合成的復(fù)合物粒子粒徑越均勻,它對(duì)癌細(xì)胞的抑制作用越均勻與穩(wěn)定;粒徑越小,因表面效應(yīng)而產(chǎn)生的抑癌效果越明顯。其定義式如下:

其中D是平均粒徑,D為所測(cè)粒子的半徑,n為所測(cè)粒子的數(shù)目,δ為標(biāo)準(zhǔn)偏差,ε值越小表明該體系的分散性越好。不同水熱處理時(shí)間下得到復(fù)合物的ε值列于表1,同時(shí)復(fù)合物對(duì)肺癌細(xì)胞A549的抑制效果與ε的關(guān)系見圖7。從圖7可以看出,復(fù)合物的抗癌效果與ε值密切相關(guān),ε值越小,復(fù)合物的抑癌-抗癌效果越明顯;而復(fù)合物的平均粒徑與其抗癌效果之間并無直接關(guān)系。從我們的研究結(jié)果還可以看出抗癌效果最好的12 h樣品,其粒子形貌最規(guī)則、單分散性最好、晶型發(fā)育最完整、載藥量也很高。這說明MTX/LDH納米復(fù)合物的物化性能與抗癌效果之間存在著某種密切的關(guān)系。而這種關(guān)系我們首次利用分散系數(shù)ε進(jìn)行了量化處理。我們?cè)噲D通過這個(gè)參數(shù)來量化構(gòu)建MTX/LDH納米復(fù)合物的結(jié)構(gòu)-藥效相關(guān)性,當(dāng)然其科學(xué)性和準(zhǔn)確性還需進(jìn)一步的研究確認(rèn)。
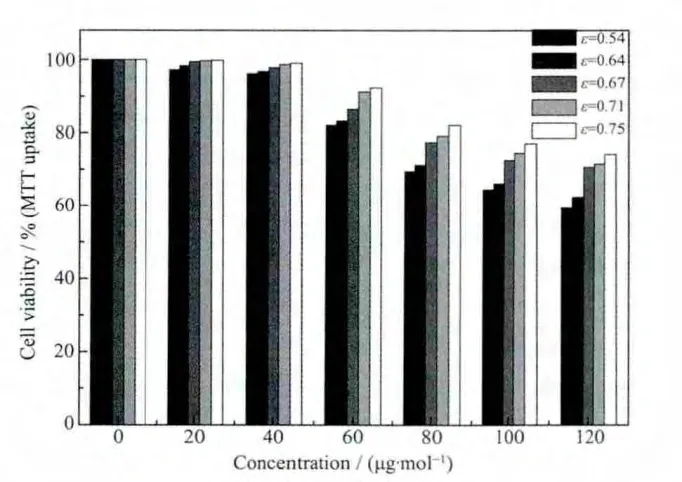
圖7 MTX/LDH納米復(fù)合物的抗癌效果與ε值的關(guān)系Fig.7 Comparison of Cell viability tests for MTX/LDH nanohybrids with different ε values
3 結(jié) 論
通過改變水熱處理時(shí)間來調(diào)控MTX/LDH納米復(fù)合物的粒徑以及單分散性,研究表明水熱處理時(shí)間的不同會(huì)導(dǎo)致復(fù)合物的粒徑、單分散性以及結(jié)晶度的不同,據(jù)此在宏觀上可以通過控制水熱處理時(shí)間來制備不同性質(zhì)的MTX/LDH納米復(fù)合物。將得到的5種MTX/LDH納米復(fù)合物作用于肺癌細(xì)胞A549進(jìn)行細(xì)胞生物實(shí)驗(yàn),對(duì)實(shí)驗(yàn)結(jié)果首次采用分散系數(shù)ε構(gòu)建MTX/LDH納米復(fù)合物的結(jié)構(gòu)-藥效相關(guān)性。研究表明,ε值越小,該復(fù)合物體系的分散性越好,相應(yīng)地對(duì)肺癌細(xì)胞A549的抑制效果越明顯。
[1]Iyi N,Sasaki T.Appl.Clay Sci.,2008,42:246-251
[2]Kang H L,Huang G L,Ma S L,et al.J.Phys.Chem.C,2009,113:9157-9163
[3]Zhao M Q,Zhang Q,Jia X L,et al.Adv.Funct.Mater.,2010,20:677-685
[4]Oh J M,Biswick T T,Choy J H.J.Mater.Chem.,2009,19:2553-2563
[5]JIA Chun-Xiao(賈春曉),ZHANG Xiao-Qing(張曉晴),LI Shu-Ping(李淑萍).Chinese J.Chem.(中國(guó)化學(xué)),2012,30:277-282
[6]Bubniak G A,Schreiner W H,Mattoso N,et al.Langmiur,2002,18:5967-5970
[7]Wei M,Shi S,Duan X,et al.J.Solid State Chem.,2004,177:2534-2541
[8]Leroux F,Besse J P.Chem.Mater.,2001,13:3507-3515
[9]Choy J H,Kwak S Y,Jeong Y J,et al.Angew.Chem.Int.Ed.,2000,39:4041-4045
[10]Yang J H,Han Y S,Park M,et al.Chem.Mater.,2007,19:2679-2685
[11]Katherine M T,Scott S R,Emmanuel G P.J.Controlled Release,2004,95:501-507
[12]Kwak S Y,Kriven W M,Wallig M A,et al.Biomaterials,2004,25:5995-6001
[13]Edward W B,Jeffes III,Jerry L,et al.J.Invest.Dermatol.,1995,104:183-188
[14]Chow M,Koo J,Ng P,et al.Mutat.Res.,1998,413:251-264
[15]Seitz M.Curr.Opin.Rheumatol.,1999,11:226-232
[16]Oh J M,Park M,Kim S T,et al.J.Phys.Chem.Solids,2006,67:1024-1027
[17]Oh J H,Choi S J,Kim S T,et al.Bioconjugate Chem.,2006,17:1411-1417
[18]DU Xue-Yan(杜雪巖),CHEN,Yin-Ze(陳尹澤),MA Y-X(馬應(yīng)霞),et al.Appl.Chem.Ind.(應(yīng)用化工),2008,37:1449-1452
[19]QI Feng-Lin(齊鳳林),LI Shu-Ping(李淑萍),ZHANG Xiao-Qing(張曉晴).Acta Chim.Sinica(化學(xué)學(xué)報(bào)),2012,70:2162-2168
[20]WANG Ji-Qin(王繼芹),LI Xin(李鑫),LI Shu-Ping(李淑萍),et al.Acta Chim.Sinica(化學(xué)學(xué)報(bào)),2011,69:137-144
[21]Aisawa S,Takahashi S,Ogasawara W,et al.J.Solid State Chem.,2001,162:52-62
[22]Choy J H,Jung J S,Oh J M,et al.Biomaterials,2004,25:3059-3064
[23]Li B X,He J,David G,et al.Appl.Clay Sci.,2004,27:199-207
[24]MENG Jin-Hong(孟錦宏),ZHANG Hui(張慧),DUAN Xue(段雪),et al.Chinese Sci.Bull.(科學(xué)通報(bào)),2005.50:208-214
[25]Xu Z P,Lu G Q.Pure Appl.Chem.,2006,78:1771-1779
[26]Zhang H,Pan D K,Duan X.J.Phys.Chem.C.,2009,113:12140-12148
[27]Li F S,Jin L,Han J B,et al.Ind.Eng.Chem.Res.,2009,48:5590-5597
[28]Choi G,Kim S Y,Oh J M,et al.J.Am.Ceram.Soc.,2012,95:2758-2765
 無機(jī)化學(xué)學(xué)報(bào)2014年6期
無機(jī)化學(xué)學(xué)報(bào)2014年6期
- 無機(jī)化學(xué)學(xué)報(bào)的其它文章
- 兩個(gè)三環(huán)己基錫芳香羧酸酯的合成、結(jié)構(gòu)、熱穩(wěn)定性及體外抗癌活性研究
- 以1,4-二硝基苯甲酸及鄰菲咯啉為配位的鑭系金屬配位聚合物的合成、結(jié)構(gòu)及性質(zhì)研究
- 8-喹啉氧基乙酸鉛(Ⅱ)一維配位聚合物的合成、晶體結(jié)構(gòu)和性質(zhì)
- Cu(Ⅱ),Ni(Ⅱ),Co(Ⅱ),Mn(Ⅱ),Zn(Ⅱ)和Cd(Ⅱ)的乙基3-(2-氨硫化亞肼基)-2-(羥胺基)丁烯酸酯配合物:合成、表征和細(xì)胞毒性
- 基于不同還原劑體系銀粉的可控制備
- Mo-V-Nb多組元氧化物催化乳酸氧化脫氫反應(yīng)制備丙酮酸
