硅質體作為新型藥物載體的研究進展
康傳哲,何 伊,馬滿玲
硅質體作為新型藥物載體的研究進展
康傳哲,何 伊,馬滿玲
硅質體;藥物載體;研究進展
脂質體(liposome)是磷脂分散在水中時形成的脂質雙分子層,又稱為人工生物膜。自1971年首次作為藥物載體應用以來,由于其良好的生物相容性、靶向性及緩釋特性,使其成為世界上生物醫藥領域最熱門的靶向給藥技術[1]。但由膽固醇和磷脂構成的傳統脂質體存在體內外穩定性差、靶向性不理想等缺點,因而限制了脂質體的臨床應用和工業化生產[2]。20世紀80年代開發出了穩定的肽脂質,肽脂質分子在水溶液中通過自組裝形成脂質體,分子間酰胺鍵形成的氫鍵帶大大提高了脂質體的穩定性。Katagiri等[3]在肽脂質結構的基礎上,設計合成了一種帶有三乙氧基硅烷頭部的有機-無機復合脂質分子,該分子在水中通過溶膠-凝膠和自組裝過程形成類脂質體囊泡,稱為硅質體。硅質體是一種類似于脂質體的有機-無機復合創新材料,以表層的硅氧烷網絡大幅提高穩定性而彌補了脂質體的不足,同時具有良好的生物相容性和緩釋特性[4-5]。
1 硅質體概述
硅質體(cerasome)是20世紀90年代末開發出來的一種新型類脂質體囊泡。Katagiri等[3]設計合成了一種新的有機-無機復合脂質分子,并將其制備成內部具有脂質雙分子層結構和表面具有無機聚硅氧烷網狀結構的囊泡(圖1)。硅質體的前體有機-無機復合脂質分子是一種新型的有機-無機納米復合材料,這種材料與通常的聚合物/無機填料體系不同,并不是無機相與有機相的簡單加和,而是由無機相與有機相在納米至亞微米范圍內通過較強或較弱化學鍵(范德華力、氫鍵)結合而成,兼具有機聚合物和無機材料的優異性能[6]。硅質體類似于脂質體的結構,可以包埋各種水溶液和脂溶性藥物,并且通過調控硅氧聚合表面的縮合度和空隙可以控制藥物的體內外釋放。此外,由于硅氧聚合表面的羥基具有很好的化學活性,通過表面修飾,可以將各種靶向分子連接到硅氧聚合物表面,使其能向病灶組織有效地送遞和釋放藥物[7]。因而,作為一種藥物載體,硅質體不僅具有開發控釋制劑的優越性能,而且具有開發靶向藥物的潛力。
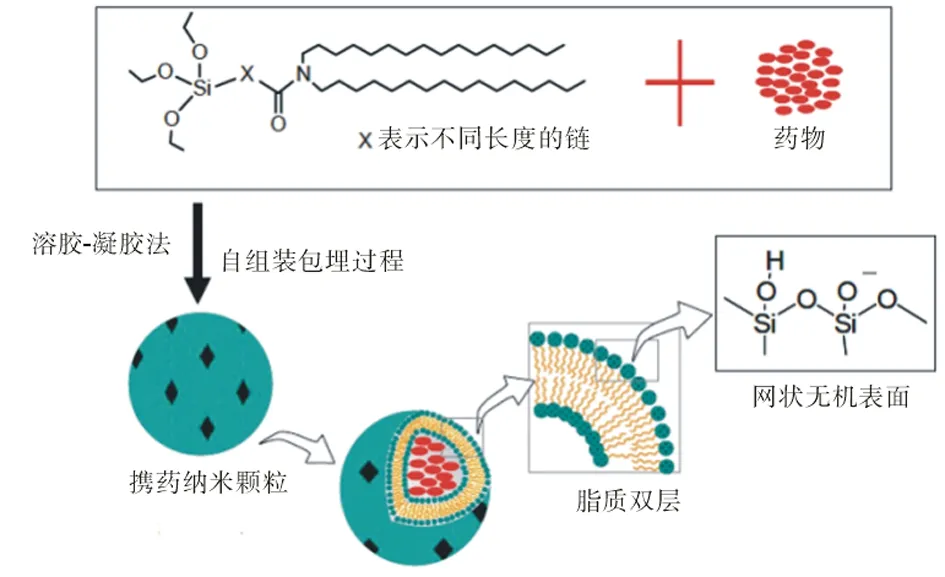
圖1 硅質體結構示意圖
2 硅質體作為藥物載體的特點
作為一種新型的藥物傳遞系統,硅質體在許多方面具有優勢:(1)與傳統的脂質體相比,硅烷表面大大增加了硅質體的力學穩定性和熱穩定性。硅質體納米粒子能夠在干燥狀態下組裝到固體基片表面,形成三維多細胞結構,這對傳統囊泡來說是不可能的[8]。(2)聚硅烷表面能夠確保硅質體在弱堿性pH值或者強鹽離子濃度環境下穩定存在。(3)與二氧化硅納米粒子相比,脂質雙層結構的存在降低了硅質體粒子整體的剛性和密度,增強了這種粒子在液相環境中的穩定性,防止聚集的發生。(4)硅質體單體分子中含有Si-C鍵,這樣的化學組成使其可以被生物降解。(5)硅質體粒子可以裝載親水、疏水或者兩親性藥物分子,通過硅氧聚合表面的縮合度和空隙可以控制藥物的體內外釋放,同時不破壞它們的形態學穩定性。(6)硅質體外表面的硅醇基團具有很好的化學活性,容易被功能化,通過硅烷耦聯化學反應能夠很容易地將一些生物分子(抗體)連接到表面,使其能向腫瘤組織有效地輸送和釋放藥物。正是由于硅質體具有以上諸多優勢,使其在生物醫學領域具有廣泛的應用前景,可以作為基因載體、藥物運輸載體等。
3 硅質體作為藥物載體的應用
3.1 烷烴硅質體 烷烴硅質體的疏水尾部為烷烴雙鏈,烷烴硅質體具有和脂質體類似的雙分子層結構,有雙鏈烷烴作為其疏水的尾部,表面覆蓋無機硅酸鹽的網絡結構,其中硅元素占整個載體的質量不到4%,在大大提高硅質體穩定性的同時,并沒有增加載體的質量密度。且有良好的生物相容性,能裝載親水、疏水和兩親性藥物,具備作為藥物載體的特性。Zhong等[9]首次將烷烴硅質體作為抗癌藥物的載體用于藥物轉運,制備了紫杉醇和鹽酸阿霉素硅質體,并對紫杉醇硅質體的體外穩定性進行了系統的研究。與傳統的脂質體相比,裝載紫杉醇藥物的硅質體具有很高的化學穩定性和貯存穩定性,并且有很好的生物相容性和緩釋特性。采用薄膜水化超聲法成功制備摻雜磷脂的紫杉醇的混合硅質體,混合硅質體與傳統脂質體相比確實有效減緩了藥物的釋放速率,可通過調節磷脂的比例來控制藥物釋放速度[10]。該實驗結果提供了一種控制藥物釋放新的思路,為臨床應用研究提供了前期的理論和實驗基礎。Yushen等[11]對鹽酸阿霉素硅質體的體外穩定性研究表明,其具有長期儲存穩定性及良好的控制釋放性能。
3.2 膽固醇硅質體 烷烴硅質體作為藥物載體,雖然在生物醫學領域得到了廣泛的應用,但是,烷烴硅質體疏水的尾部為烷烴雙鏈,這樣的結構使其具有較低的相變溫度,作為藥物載體在體內運輸過程中,容易導致藥物的提前泄露,在到達靶位點之前大量藥物被釋放出來,從而對機體產生嚴重的毒副作用,藥物的療效降低。傳統的藥物載體本身無治療作用,大量載體隨著藥物進入到了人體,增加了機體的負擔。因此,研制本身具有治療效果的“活性”載體具有重要意義。Yan等[12]設計合成了一種疏水鏈為膽固醇的新型有機-無機復合脂質,并以此為原料制備了膽固醇硅質體。研究發現,在不攜帶任何藥物時,這種硅質體本身能選擇性地殺死白血病細胞,而對正常血液細胞沒有毒性;而且,在攜帶化療藥物阿霉素時,可顯著增強阿霉素對白血病細胞的殺傷力。由于它既能降低化療藥物的使用量,減少化療引起的毒副作用,又能降低載體的使用量,減少人體的負擔,因此在白血病治療方面具有重要的應用前景,并為研制新型藥物載體提供了新的理念。與烷烴硅質體相比,膽固醇硅質體不僅提高了相變溫度增加了硅質體的穩定性,而且大大提高了其生物相容性[13]。
3.3 功能化硅質體 硅質體硅氧聚合表面的羥基具有很好的化學活性,通過表面修飾,可以將各種靶向分子連接到硅氧聚合物表面,使其能向病灶組織有效地送遞和釋放藥物。曹眾[14]以烷烴硅質體脂質為基礎,制備的Fe3O4磁性鹽酸阿霉素硅質體顯示了很好的磁靶向功能和脂質體的所有特性。與脂質體相比還具有更高的穩定性,解決了脂質體穩定性和緩釋性差的缺點,這種集示蹤、靶向和可控釋放的多功能藥物傳輸載體將具有重要的臨床實際意義。Xiaolong等[15]開發出了一種含偶氮基團的新型復合脂質,并制備成了硅質體,該硅質體具有兩個方面的特點,一方面其分子結構中含有-Si(OEt)3或-Si(OCH3)3基團,通過水解縮合可形成穩定的Si-O-Si網絡結構,共價鍵連覆蓋于硅質體的表面,從而極大地增強其穩定性;另一方面,由于含有偶氮苯基團,通過光控方法可以方便地改變脂質雙層的滲透性,從而實現對藥物的可控釋放(圖2)。Yan 等[16]以膽固醇復合脂質為基礎,制備了一種多功能硅質體復合物,即金殼修飾的硅質體復合物,同時裝載了阿霉素以及四氧化三鐵磁性納米粒子,這種復合物既具有磁共振成像、磁靶向的藥物運輸,又具有光引發的藥物釋放以及光熱治療等多種功能。克服了傳統藥物載體靶向性差、功能單一的缺點。這種多功能的納米復合物藥物運輸系統,在腫瘤的聯合治療中具有重要的應用前景。
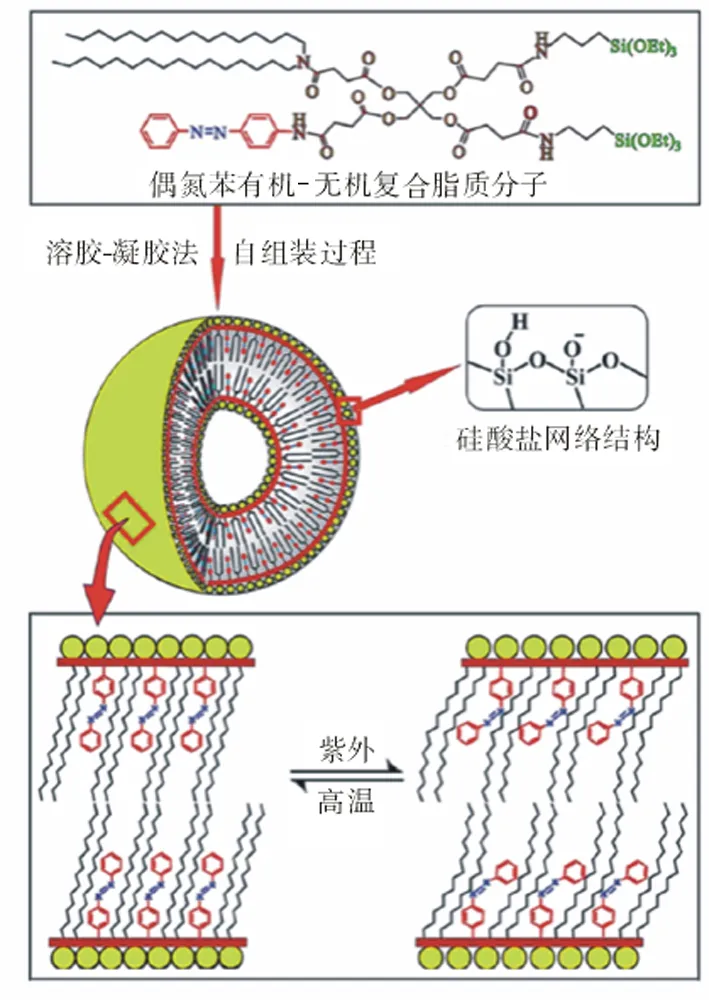
圖2 偶氮苯硅質體形成和光控改變其脂質雙層滲透性示意圖
4 結語
硅質體是一種新型的納米藥物載體,由于其自身的諸多優勢,使其在生物醫學領域得到了廣泛的應用。近年來對硅質體的研究也越來越深入,設計并制備出了一些具有特殊功能的硅質體。但是硅質體體內釋藥行為、靶向性及代謝途徑等還缺乏深入的研究。硅質體是具有我國自主知識產權的新型藥物載體,無需采用特殊方法便可實現極高的物理化學穩定性,制備工藝簡單,便于工業化生產,將為我國藥物制劑的研究、開發、應用和推廣提供一個全新的開放式技術平臺。
[1] Abolfazl Akbarzadeh,Rogaie Rezaei-Sadabady,Soodabeh Davaran,et al.Liposome:classification,preparation,and applications[J].Nanoscale Res Lett,2013,8(1):102.
[2] Andreas Wagner,Karola Vorauer-Uhl.Liposome technology for industrial purposes[J].Journal of Drug Delivery,2011,2011:1-9.
[3] Katagiri K,Ariga K,Kikuchi J.Preparation of organic-inorganic hybrid vesicle “cerasome” derived from artificial lipid with alkoxysilyl head[J].Chemistry Letters,1999(7):661-662.
[4] Katagiri K,Hashizume M,Ariga K,et al.Preparation and characte-rization of a novel organic-inorganic nanohybrid “cerasome” formed with a liposomal membrane and silicate surface[J].Chem Eur J,2007,13(18):5272-5281.
[5] Katagiri K.Sol-gel nanohybrid materials prepared via supramolecular organization[J].J Sol-Gel Sci Technol,2008,46(3):251-257.
[6] Mineo Hashizume,Hiroyuki Horii,Jun-ichi Kikuchi,et al.Effects of surface carboxylic acid groups of cerasomes,morphologically stable vesicles having a silica surface,on biomimetic deposition of hydroxyapatite in bodyfluid conditions[J].J Mater Sci,2010,21:11-19.
[7] Daiki Minamida,Shusuke Okada,Mineo Hashizume.Creation of magnetic cerasomes through electroless plating and their manipulation using external magnetic fields[J].J Sol-Gel Sci Technol,2008,48:95-101.
[8] Zhifei Dai,Wenjie Tian,Xiuli Yue,et al.Efficient fluorescence reso-nance energy transfer in highly stable liposomal nanohybrid cerasome[J].Chemical Communications,2009,15:2032-2034.
[9] Zhong Cao,Yan Ma,Xiuli Yue,et al.Stabilized liposomal nanohybrid cerasomes for drug delivery applications[J].Chemical Communications,2010,46(29):5265-5267.
[10] Zhong Cao,Xiuli Yue,Yushen Jin,et al.Modulation of release of paclitaxel from composite cerasomes[J].Colloids and Surfaces B,2012,98:97-104.
[11] Yushen Jin,Xiuli Yue,Qingyuan Zhang,et al.Cerasomal doxorubicin with long-term storage stability and controllable sustained release[J].Acta Biomaterialia,2012,8:3372-3380.
[12] Yan Ma,Zhifei Dai,Zhengbao Zha,et al.Selective antileukemia effect of stabilized nanohybrid vesicles based on cholesteryl succinyl silane[J].Biomaterials,2011,32(35):9300-9307.
[13] Yan Ma,Zhifei Dai,Yanguang Gao,et al.Liposomal architecture boosts biocompatibility of nanohybrid cerasomes[J].Nanotoxicology,2011,5(4):622-635.
[14] 曹眾.基于硅質體的新型納米藥物載體材料的研究[D].哈爾濱:哈爾濱工業大學生命科學與技術學院,2011.
[15] Xiaolong Liang,Xiuli Yue,Zhifei Dai.Photoresponsive liposomal nanohybrid cerasomes[J].Chemical Communications,2011,47:4751-4753.
[16] Yan Ma,Xiaolong Liang,Sheng Tong,et al.Gold Nanomicelles for potential magnetic resonance imaging,light-triggered drug release and photothermal therapy[J].Advanced Functional Materials,2013,23(7):815-822.
150001 哈爾濱,哈爾濱醫科大學附屬第一醫院(康傳哲,馬滿玲);黑龍江省齊齊哈爾市中醫醫院藥劑科(何 伊)
馬滿玲,E-mail:mamanling@126.com
R 966
A
1004-0188(2014)02-0226-03
10.3969/j.issn.1004-0188.2014.02.049
2013-09-25)

