內源性大麻素系統在慢性間歇低氧大鼠心肌肥厚病理過程中的作用*
張晉源,陳彥,肖玲,唐茜,王蓓,范艷鋒
研究證實阻塞型睡眠呼吸暫停低通氣綜合征(OSAHS)患者易合并高血壓、擴張型心肌病等疾患[1],中、重度OSAHS患者普遍存在左心室肥厚[2]。研究發現擴張性心肌病在藥物基礎上使用無創呼吸機后,心臟結構發生可逆性改變[3]。該病表現為心肌肥厚[4],目前多采用鈣/鈣調素依賴性蛋白激酶II(CaMKII)與心肌營養素-1(CT-1)作為心肌肥厚損傷評價指標,兩者持續過度激活與心臟重構密切相關[5]。內源性大麻素系統中受體1過度表達是導致心血管疾病的原因之一[6]。利莫那班阻斷大麻素受體1, 改善肥胖、糖代謝紊亂等,從而可降低心血管事件危險因素。那么,OSAHS患者存在的心肌肥厚是否與內源性大麻素系統紊亂相關呢?本研究旨在通過慢性間歇低氧模型探討內源性大麻素系統在心肌肥厚病理過程中的作用,并觀察使用利莫那班后對其的影響。
1 材料與方法
材料:①動物:2012-11至2013-07選取普通級雄性Wistar大鼠48只,體重200~250 g,購自山西醫科大學動物實驗中心。48只大鼠隨機分為正常對照即根據充氣時間又分為正常對照4周組,正常對照6周組;間歇低氧大鼠即根據低氧時間又分為低氧4周組,低氧6周組;間歇低氧+利莫那班干預即根據低氧時間又分為間歇低氧4周+利莫那班組(簡稱低氧拮抗4周組),低氧拮抗6周組。共6組,每組均為8只。②主要試劑:兔抗鈣/鈣調素依賴性蛋白激酶II-CaMKIIα/δ(M281)抗體購于Bioworld(Minnesota,USA)公司,CT-1抗體、鏈霉親和素-生物素-過氧化物酶復合物免疫組化染色試劑盒購自武漢博士德生物工程有限公司,利莫那班(SR141716)購于Selleckchem(Texas,USA )。
慢性間歇低氧模型的制備:每天分別循環充入不同流速的壓縮空氣(5 L/min及10 L/min)和純氮,每一循環為120 s,先充入純氮使低氧艙中氧含量在30 s內從21%分別下降至各組最低值(8%~9%),再充入50 s以上不同流速壓縮空氣使艙內氧含量盡快恢復至接近 21%,最后充入 40 s 5 L/min 壓縮空氣使艙內氧含量以21%維持至下個循環。大鼠每天暴露8 h(9:00 am~5:00 pm)。干預的各組每天造模前腹腔內注射利莫那班每只大鼠1 mg/kg,0.5 h后開始通氣。
大鼠標本處理:分別于間歇低氧4周及6周后隨機抽取各組一半數目大鼠,給予以下處理:10%的水合氯醛3.5 ml/kg腹腔注射后,剪開胸廓,立即取出心臟,用預冷的生理鹽水漂洗,沿房室交界處剪去血管根部,左、右心房及心耳, 沿室間隔分離出左心室(含室間隔),用濾紙吸干,稱左心室重量,并計算左心室重量與體重之比,作為左心室肥厚指標,即左心室質量指數(LVMI)[7]。再注入4%多聚甲醛300~350 ml固定液,在4%多聚甲醛中4℃固定24 h,石蠟包埋,切片。蘇木素伊紅(HE)染色,光鏡下觀察心肌變化:常規脫蠟至水后,HE染色10 min、水洗 ,然后 1% 鹽酸酒精分化 1~2 s 、水洗,再經過1%氨水返藍液1~2 min、水洗, 0.5%水溶性伊紅 10 s~1 min、水洗,接著乙醇脫水、二甲苯透明后,中性樹膠封片。光學顯微鏡下觀察心肌細胞形態變化。
免疫組化鏈霉親和素-生物素-過氧化物酶復合物法:檢測CaMKII α/δ、CT-1在心臟表達水平,參照文獻[8]。
統計學方法:計量資料用x±s表示,采用SPSS 16.0軟件進行分析,兩樣本均數比較采用完全隨機設計兩樣本t檢驗,相關性檢驗采用Pearson相關分析,以P<0.05為差異有統計學意義。
2 結果
免疫組化半定量分析顯示間歇低氧和利莫那班干預對大鼠心肌左心室質量指數比較。(表1)
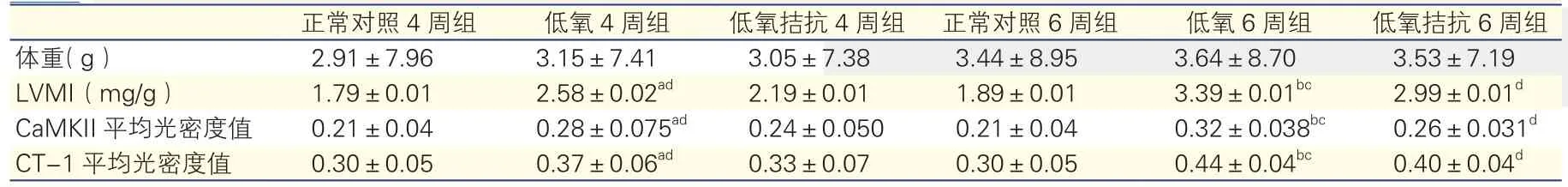
表1 免疫組化半定量分析顯示間歇低氧和利莫那班干預對大鼠心肌CaMKⅡ、CT-1水平的影響(n=8,±s)
由表1可見,低氧4周組、低氧6周組表達分別強于正常對照組4周組(t=108.674,P<0.001)、正常對照6周組(t=387.553,P<0.001);低氧6周組表達強于低氧4周組(t'=6.278,P<0.001);低氧4周組、低氧6周組表達分別強于低氧拮抗4周組(t'=59.818,P<0.001)、低氧拮抗6周組(t=96.462,P<0.001);低氧拮抗6周組表達強于低氧拮抗4周組(t=205.897,P<0.001),組間比較差異均有統計學意義。
病理組織學所見:心肌組織病理學改變:光鏡下① 正常對照4周組:心肌細胞排列整齊,未見肥大,間質中無炎細胞浸潤;②低氧4周組:心肌細胞輕度肥大,胞漿豐富,胞核增大;③低氧拮抗4周組:心肌細胞間距稍有增大,少許炎細胞浸潤;④ 正常對照6周組:未見心肌細胞肥大;⑤低氧6周組:細胞間距增大,胞漿豐富、著色深,胞核增大呈濃染,心肌纖維增粗、排列紊亂,血管周圍少量炎細胞浸潤,間隙有紅細胞滲出;⑥低氧拮抗6周組:間隙增寬,胞漿凝聚,少量炎細胞浸潤,紅細胞滲出。(圖1)
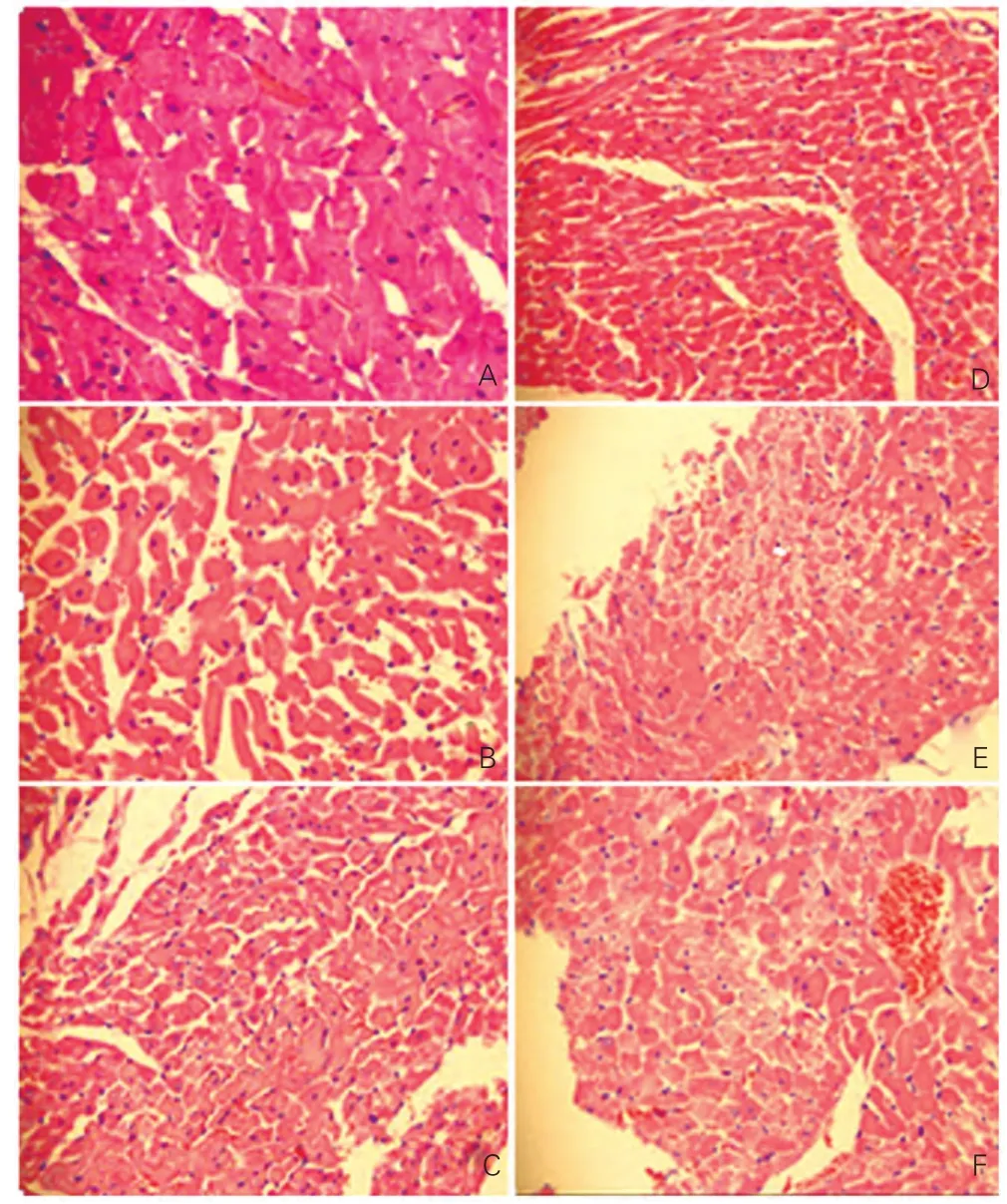
圖1 心肌組織病理學改變(HE ×400)
CaMKⅡ、CT-1在心肌組織的免疫組化表達(圖2、3,以下數值t1、P1為CaMKⅡ的數值,t2、P2為CT-1的數值):正常對照4周組、正常對照6周組大鼠心肌組織中有少量CaMKⅡ、CT-1表達(低表達),CaMKⅡ分布于胞漿及胞核,CT-1分布于胞漿;低氧4周組和低氧拮抗4周組(弱陽性表達),低氧6周組和低氧拮抗6周組CaMKⅡ、CT-1表達明顯增強(強陽性表達),陽性著色明顯升高[免疫組化圖片 CaMK Ⅱ見圖 2(A~G)、 CT-1 見圖 3(A~F)],CaMKⅡ分布于胞漿及胞核,CT-1分布于胞漿,其中低氧4周組表達強于正常對照4周組(t1'=4.952,P1<0.001、t2=4.963,P2<0.001)、低氧 6 周組表達強于正常對照6周組(t1=11.765,P1<0.001、t2'=13.943,P2<0.001)、低氧6周組表達強于低氧4周組(t'1=2.902,P1<0.005、t2'=6.278,P2<0.001)、 低 氧 4 周 組 表 達強于低氧拮抗4周組(t'1=2.653,P1=0.01、t2=2.422,P2<0.05)、低氧6周組表達強于低氧拮抗6周組(t1=6.970,P1< 0.001、t2=4.250,P2<0.001),低氧拮抗6周組表達強于低氧拮抗4周組(t'1=2.54,P1<0.014、t2'=5.555,P2<0.001),組間比較差異均有統計學意義。各組大鼠平均光密度值詳見表1。CT-1與CaMKⅡ呈正相關關系,相關系數r=0.426,P<0.01。
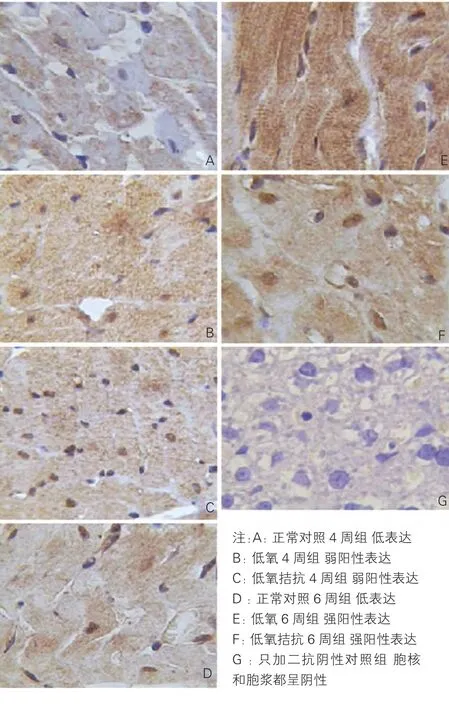
圖2 CaMKⅡ在心肌組織免疫組化表達 (DAB ×400)。余注見表1
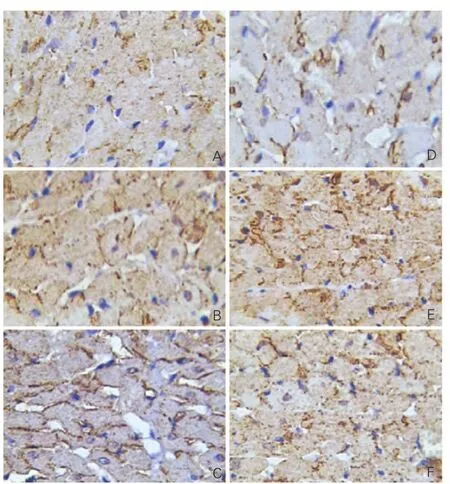
圖3 CT-1在心肌組織免疫組化表達 (DAB ×400)。余注見表1
3 討論
夜間反復發生的慢性間歇低氧是OSAHS最主要病理生理改變,其可參與氧化應激、炎癥反應、心臟自主神經功能紊亂等多種過程,被認為是心血管事件的獨立危險因素。
越來越多的證據顯示對于心血管疾病而言OSAHS是一個重要的可干預的危險因素,但具體機制尚未清楚。左心室重量指數、CaMKⅡ、CT-1是心肌肥厚損傷常用的評價指標,三者與心律失常、心室重塑等密切相關,國外研究已證實在實驗性心肌病狀態下CaMKⅡ、CT-1出現過度表達[9],因此檢測三者的表達可明確反映心肌肥厚的變化。而在本研究同樣發現慢性間歇低氧模型低氧組大鼠心肌組織中左心室質量指數值以及CaMKⅡ、CT-1表達明顯增加,并隨著低氧周數的延長表達增加更明顯。
既然慢性間歇低氧中確實發生了心肌肥厚,那么其機制是什么呢?目前關于OSAHS導致心肌肥厚可能與以下幾個方面相關:①自主神經功能紊亂;②氧化應激及炎癥反應;③血管內皮損害;④血流粘度增高、高凝狀態、纖溶系統異常;⑤內分泌代謝異常;⑥胸腔內壓的改變,但其具體機制仍在進一步探討。
本課題組前期臨床實驗已發現OSAHS患者存在內源性大麻素系統紊亂,內源性大麻素紊亂可導致糖代謝紊亂、氧化應激、炎癥因子活化、神經系統紊亂以及體溫調節障礙等多系統的病理過程,并且被認為是心血管事件的危險因素。那么內源性大麻素系統紊亂與心肌肥厚是否存在關聯呢?
大麻素受體1是內源性大麻素系統的主要受體,由于內源性大麻素系統調節體內多種生理功能均通過大麻素受體1完成[10],因此目前研究多通過檢測大麻素受體1來評價內源性大麻素系統變化。由于大麻素受體1主要表達于肝臟、胃腸道、胰腺和脂肪細胞,但其在心肌中表達較少。因此直接測定其在心肌中表達并不容易,本研究采用內源性大麻素受體拮抗劑利莫那班預先干預,旨在從另一層面證實心肌肥厚中該系統所發揮的作用,結果發現使用利莫那班組大鼠心肌組織中CaMKⅡ 、CT-1表達較單純低氧組明顯減少,提示利莫那班對慢性間歇低氧所造成的心肌細胞損害有一定保護作用,從而證實OSAHS導致的慢性間歇低氧可發生內源性大麻素系統紊亂,最終導致心肌肥厚發生。分析其原因可能為:①內源性大麻素系統活性升高不僅具有增加食欲促進攝食等中樞性作用,同時還影響周圍組織能量代謝,引起體重增加,引發血脂異常;②內源性和外源性大麻系統可能表現出對心血管系統直接影響,心肌、血管及神經末梢大麻素受體激活后能夠觀察到明顯生理效應;③內源性大麻素系統過度激活促進動脈粥樣硬化的炎癥;④內源性大麻素系統導致胰島素抵抗。內源性大麻素系統過度活躍導致以上心血管代謝危險發生,進而引起心肌肥厚。而利莫那班選擇性阻斷大麻素受體1,可以顯著降低體重,并且在出現超重或肥胖、促進動脈粥樣硬化發展的血脂紊亂、高血壓及2型糖尿病的高危人群中可以改善若干代謝危險因素。通過利莫那班阻斷大麻素受體1,從而降低心血管事件危險因素。
綜上所述,OSAHS患者出現心肌肥厚病理改變的可能機制之一為內源性大麻素系統的紊亂,而提早使用利莫那班干預可減少心肌肥厚病理過程,對慢性間歇低氧導致的心肌損害具有一定保護作用,這為進一步減輕慢性間歇低氧造成的心肌損害提供了一定的臨床思路。
[1]Hersi AS. Obstructive sleep apnea and cardiac arrhythmias . Ann Thorac Med, 2010, 5: 10-17.
[2]Usui K, Parker JD, Newton GE, et al. Left ventricular structural adaptations to obstructive sleep apnea in dilated cardiomyopathy.Respir Crit Care Med,2006, 173: 1170-1175.
[3]王大鵬, 王蓓. 持續氣道正壓通氣治療睡眠呼吸暫停合并擴張性心肌病的臨床特點 . 中華結核和呼吸雜志 , 2010, 9: 700-702.
[4]李鵬,賈志梅,馬春燕,等. 胸腺五肽聯合比索洛爾對免疫介導大鼠擴張型心肌病的干預研究 . 中國循環雜志,2013, 28: 230-233.
[5]Westenbrink BD, Edwards AG, McCulloch AD, et al. The promise of CaMKII inhibition for heart disease preventing heart failure and arrhythmias. Expert Opin Ther Targets , 2013, 17: 889-903 .
[6]Padwal RS,Majumdar SR. Drug treatments for obesity: orlistat,sibutramine, and rimonab-ant. Lancet, 2007, 369: 71-77.
[7]張淑華,王云霞,張娜,等. 纈沙坦、氨氯地平及螺內酯聯合應用對大鼠腹主動脈部分縮窄引起心肌肥厚的影響. 中國循環雜志,2012, 27: 383-386.
[8]Hofman P, Ilie M , Hofman V, et a1. Immunohistochemistry to identify EGFR mutations or ALK rearrangements in patients with lung.Adenocarcinoma. Annals of Oncology, 2012, 23: 1738-1743.
[9]Chung CP, Oeser A, Solus JF, et a1. Inflammation-associated insulin resistance: differential effects in rheumatoid arthritis and systemic lupus erythematosus define potential mechanisms. Arthritis Rheum,2008, 58: 2105-2112.
[10]Hill MN, McEwen BS. Involvement of the endocannabinoid system in the neurobehavioural effects of stress and glucocorticoids. Prog Neuropsychopharmacol Biol Psychiatry, 2010, 34: 791-797.

