半纖維素熱解反應的微觀反應機理研究
曹小玲,熊家佳,鄧勝祥, 張航,羅海銀,唐世斌
(1.長沙理工大學 能源與動力工程學院, 長沙 410004;2.中南大學 能源科學與工程學院, 長沙 410083)
引言
生物質能作為一種清潔的可再生能源,逐步引起了全世界的廣泛關注。生物質熱解是一種高效轉化生物質能[1-5]的新技術,它是生物質氣化和生物質燃燒的起始過程。目前,對于生物質熱解機理的研究仍處于摸索階段。半纖維素由于結構復雜且多變,熱解過程發生大量的脫水、化學鍵的合成與斷裂、小分子化合物聚合等反應,不易掌握其整個熱解過程,所以相關的研究與報道也相對較少,對其理化性質以及熱解反應機理缺乏深入的研究。[6-9]對半纖維素熱解反應的微觀機理進行深入研究不僅有助于了解生物質的熱解過程,為生物質的熱解技術提供理論基礎,而且對生物質能的利用以及富含半纖維素的工業廢棄物的利用在造紙行業領域具有重要的工程價值。[10]
研究發現,半纖維素的典型模化物木聚糖熱解反應后會得到一種非常重要的產物2-糠醛,而且幾乎所有的關于木聚糖熱解反應的研究中都能發現2-糠醛的存在。[11]本文以2-糠醛為切入點來研究半纖維素的熱解反應機理。
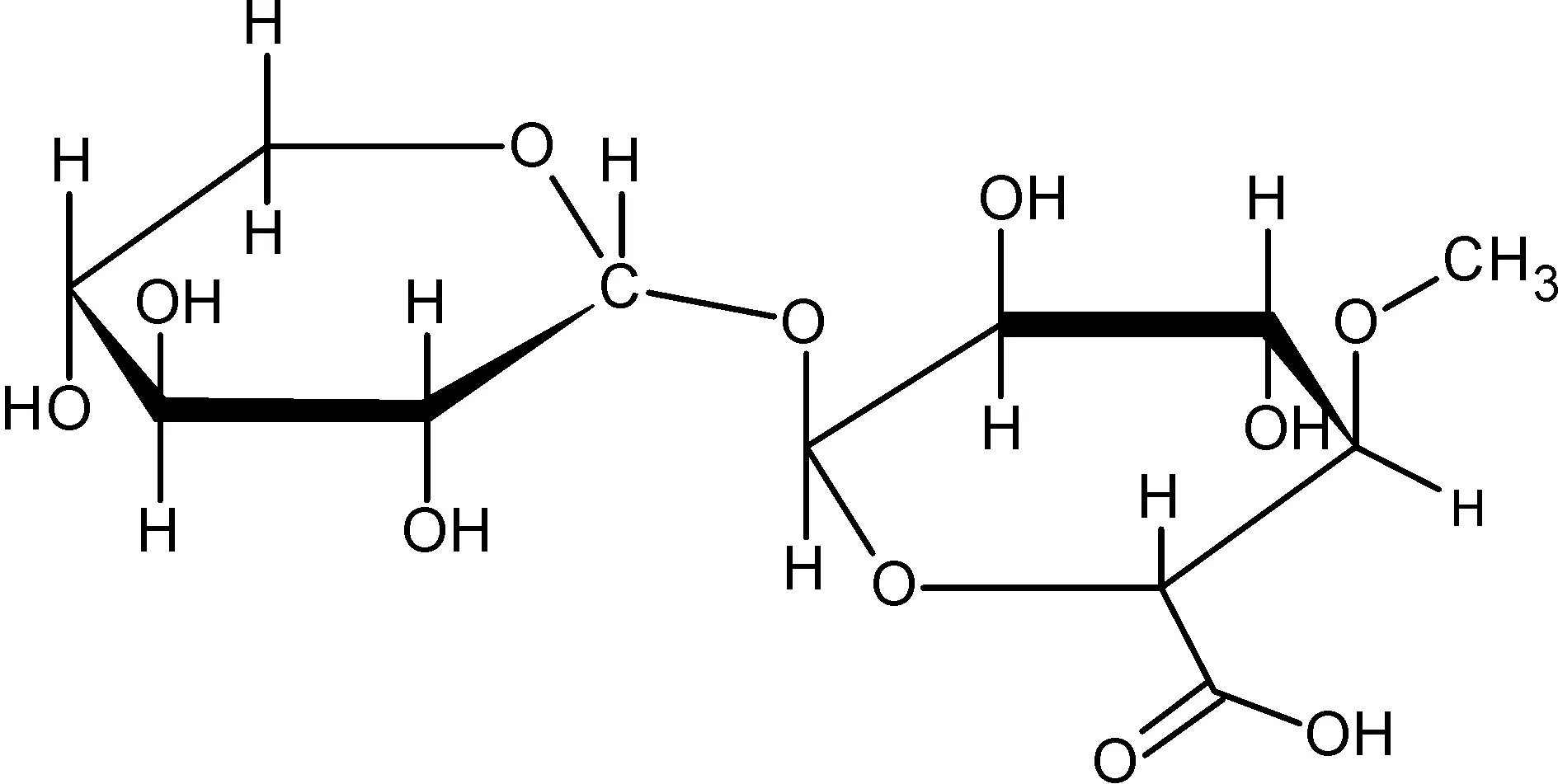
圖1 4-O-甲基-D-葡萄糖醛酸-D-木糖
1 反應路徑設計
半纖維素的二聚體模型物分子4-O-甲基-D-葡萄糖醛酸-D-木糖,如圖1所示。其中的D-木糖作為半纖維素主鏈的代表,4-O-甲基-D-葡萄糖醛酸作為支鏈的代表。將熱解反應分為兩個階段[12-15]來研究,其中第一階段為二聚體4-O-甲基-D-葡萄糖醛酸-D-木糖的解聚,第二階段為解聚后的兩個單體分別反應生成半纖維素熱解反應的典型產物2-糠醛。
1.1 第一階段二聚體模型化合物的解聚反應
4-O-甲基-D-葡萄糖醛酸-D-木糖的解聚如圖2所示。4-O-甲基-D-葡萄糖醛酸-D-木糖分子和水分子在一定的溫度條件下被激發,此時二聚體從中間斷裂,斷裂的部分分別連接上水分子的羥基和氫原子,形成D-木糖分子和4-O-甲基-D-葡萄糖醛酸分子,這樣整個二聚體的解聚就完成了,即第一階段的熱解反應完成。這個階段表示兩個糖基單元的分離,代表半纖維素分子的支鏈從主鏈上脫離,是半纖維素的熱解最開始的階段。
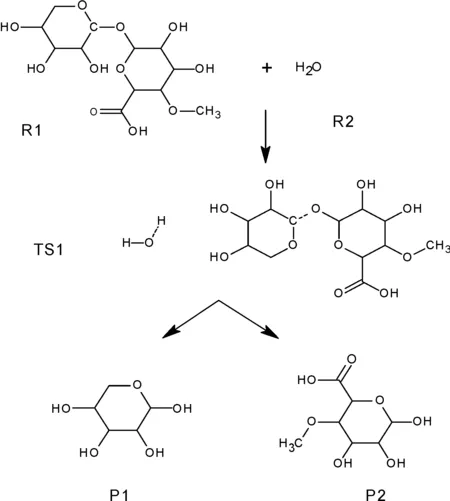
圖2 二聚體4-O-甲基-D-葡萄糖醛酸-D-木糖的解聚
1.2 第二階段單體1反應生成2-糠醛
在較低溫度時,木聚糖的熱解反應主要發生在其支鏈上,即糖基單元4-O-甲基-D-葡萄糖醛酸分解過程,如圖3所示。甲氧基脫離,羧基發生脫酰基反應,這兩部分形成CH3OH分子和CO2分子。剩下來的雜環發生開環反應,脫去水分子再形成一個新的雜環分子,從六元環變成五元環。五元環再脫去水分子,形成2-糠醛分子。這是熱解反應第二階段低溫時支鏈上發生的反應,稱為第二階段反應1。

圖3 4-O-甲基-D-葡萄糖醛酸反應生成2-糠醛
1.3 第二階段單體2反應生成2-糠醛
隨著熱解溫度的升高,熱解反應深入進行,木聚糖的主鏈發生解聚反應分解為很多糖基單元。糖基單元D-木糖單體發生分解,通過一系列反應得到各種小分子化合物,其中包括木聚糖熱裂解的典型產物2-糠醛。如圖4所示,雜環發生開環反應,形成新的雜環,從六元環變成五元環。新形成的五元環的支鏈上發生脫水反應形成甲醛基。剩下的部分再脫去兩分子水形成剩下2-糠醛分子。這是熱解反應第二階段溫度升高時主鏈上發生的反應,稱為第二階段反應2。
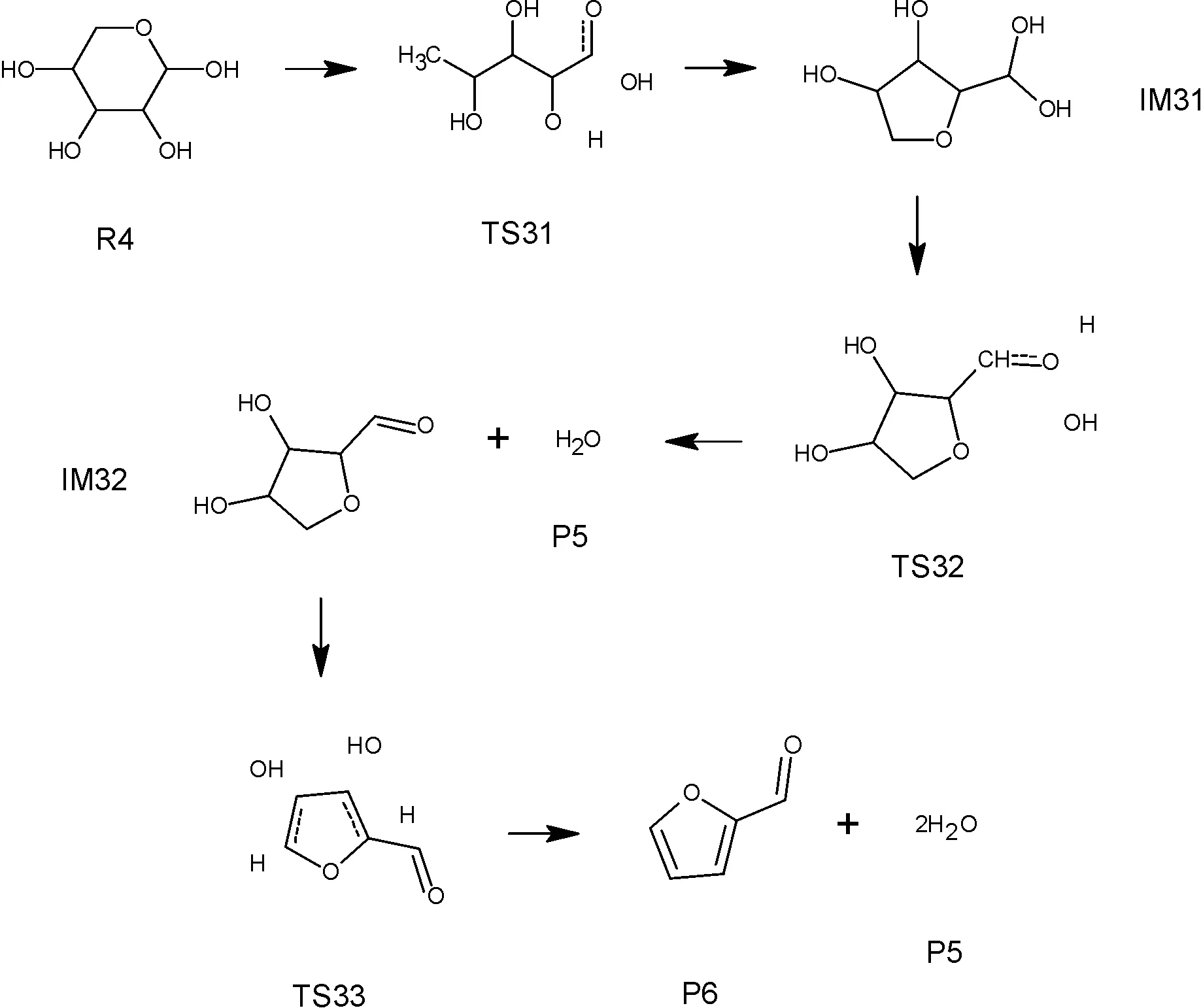
圖4 D-木糖反應生成2-糠醛
2 計算方法
密度泛函理論[16](DFT)在考慮電子相關效應的同時,不僅可進行大分子體系的計算,而且計算結果準確、可靠。對于比較輕的元素,比如C、H、O和N等,B3LYP/6-31G(d,p)基組就很合適。
為了進一步研究半纖維素的熱解反應機理和其反應路徑,采用Gaussian09程序中的密度泛函理論中的B3LYP /6-31G( d,p)方法,對半纖維素的模型化合物二聚體4-O-甲基-D-葡萄糖醛酸-D-木糖在設計反應路徑中的各反應物、產物、中間體及過渡態進行了幾何構型的全優化,并對熱力學量考慮了振動零點能(ZPE)校正,然后進行頻率計算,得出各個構想的單點能。采用TS方法來尋找過渡態,過渡態有惟一的虛頻振動頻率。計算反應各駐點的振動頻率,分析每一個過渡態的真實性。在做頻率計算時,加入關鍵詞temperature=(300K,500K,700K,900K,1100K)等,分別控制熱解反應的不同溫度條件,最后用內稟反應坐標IRC方法來驗證所設計的熱解反應過程的正確性,正確銜接過渡態結構和反應物、中間體、產物,驗證前面設計的反應路徑,從而得到半纖維素熱解反應機理模型。
3 計算結果及分析
3.1 第一階段二聚體模型化合物的解聚反應動力學分析
按照過渡狀態理論,反應物與位能面的鞍點(即過渡態)均處于基態時,它們的最低位能差就是活化能。根據此原理,在對反應物、產物及過渡態分別進行幾何構形的優化后,再對它們做頻率計算,得到了經過零點能校正后的總能量E。
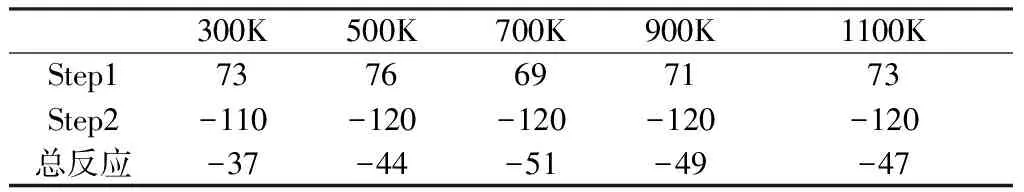
表1 第一階段熱解反應在不同溫度下的焓變ΔH(單位:kJ/mol)
由表1可以看出,熱解反應的第一階段是反應物R1和R2反應先產生過渡態TS1,然后TS1反應生成產物P1及P2。R1和R2反應生成過渡態TS1這一步是吸熱反應,700K時吸收的熱量最少,此時的焓變為69kJ/mol。TS1反應生成P1和P2這一步是放熱反應,300K時放出的熱量最少,此時的焓變為-110kJ/mol。整個反應即熱解反應第一階段是放熱反應。
對比5個溫度下的反應焓變ΔH發現,如表2所示,隨著溫度的升高,反應的放熱越來越多,到700K左右熱解反應達到峰值,溫度再升高,反應的放熱反倒減少。700K時反應放熱最多,表示此時反應更容易進行,反應速率是最大的。
這個反應路徑在不同溫度下的反應自由能變ΔG均小于0,表明第一階段的熱解反應可以自發進行。隨著溫度的升高,反應自由能變ΔG呈現波動的趨勢,結合焓變ΔH分析可知,300K時溫度較低,整個反應是放熱反應,溫度越低反應越容易發生,同時產物的轉化率也越高。隨著溫度的升高,500K時產物的轉化率最低。700K時反應放熱最多,表示此時反應更容易進行,反應速率是最大的,同時此時的ΔG也較500K時小,產物的轉化率較500K時高。根據勒夏特列原理,再往后溫度繼續升高,放熱反應會向逆反應的方向進行,即反應的正反應越難進行,產物的轉化率降低。
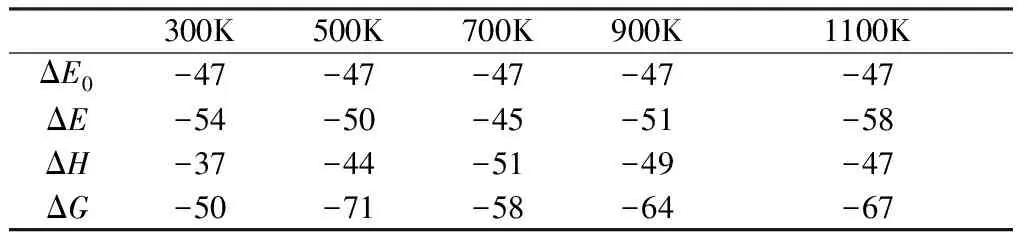
表2 第一階段反應路徑的動力學變值(單位:kJ/mol)
綜合上述分析可以發現,700K應該是第一階段的熱解反應發生的最佳溫度。
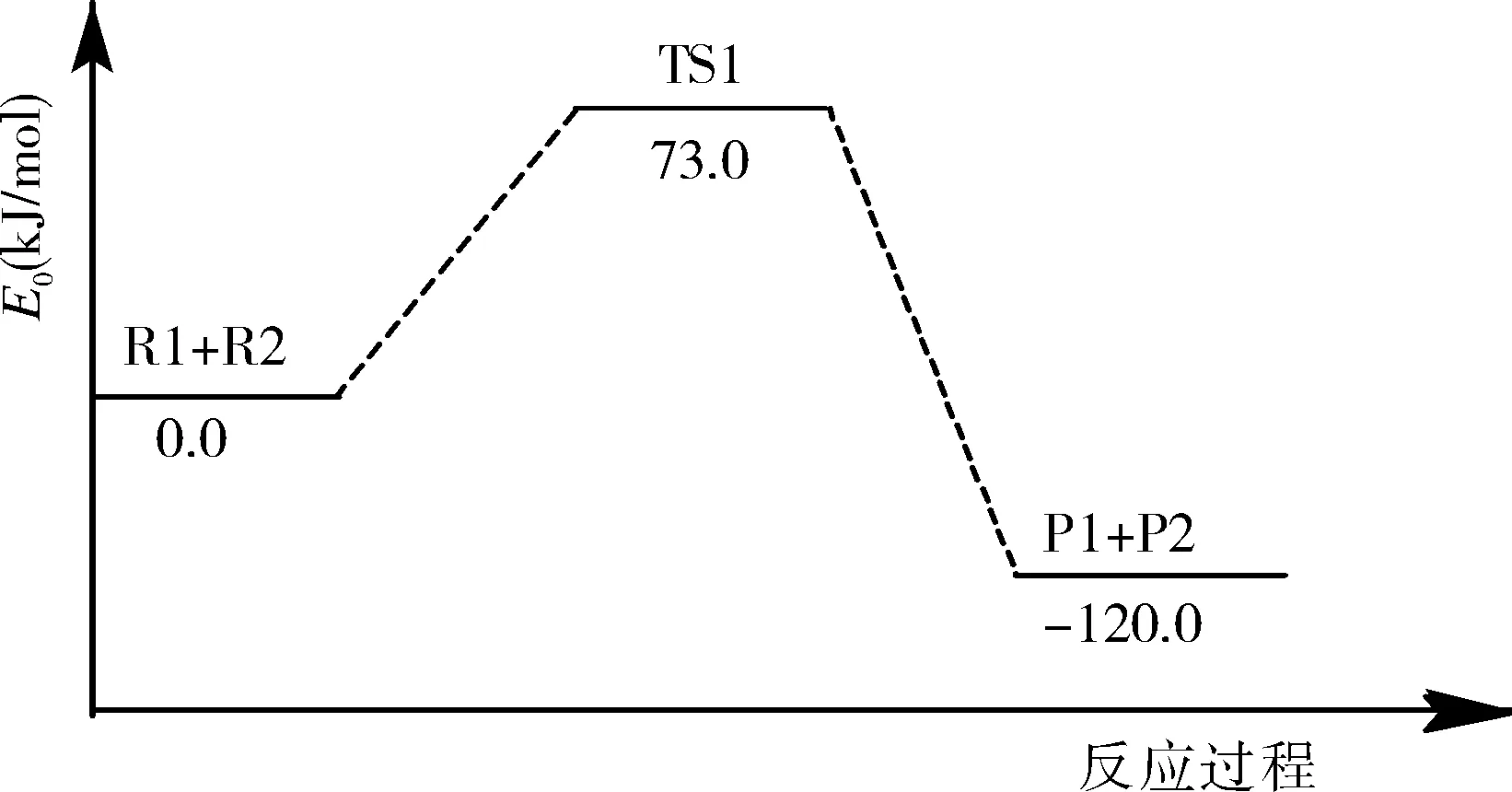
圖5 第一階段反應的勢能剖面圖
圖5為第一階段熱解反應的勢能剖面圖。從圖中可以看出,反應物R1和R2反應先產生過渡態TS1,然后TS1反應生成產物P1及P2。
3.2 第二階段單體1反應生成2-糠醛動力學分析
由表3和圖3可以看出,在熱解反應第二階段的反應1是反應物R3反應先產生過渡態TS21,然后TS21反應生成中間體IM21和產物P3及P4。R3反應生成TS21是吸熱反應,不同溫度下焓變相同,都是190kJ/mol,說明溫度對這一步的反應影響不大。TS21反應生成中間體IM21和產物P3及P4是放熱反應,隨著溫度的變化,焓變值略有不同,低溫和高溫時放熱較多,500K時放熱最少,此時的焓變為-227kJ/mol。接著中間體IM21反應生成過渡態TS22,這一步也是吸熱反應,1100K時吸收的熱量最少,此時的焓變為230kJ/mol。過渡態TS22反應生成中間體IM22和產物P5,這一步是放熱反應。中間體IM22反應生成過渡態TS23,最后TS23反應生成產物P5和P6。IM22反應生成TS23是吸熱反應,TS23反應生成P5和P6是放熱反應。整個反應即熱解反應第二階段反應1是放熱反應。
表4給出了熱解反應第二階段反應1在不同溫度下的動力學數據。5個溫度下的反應焓變ΔH均小于0,表示這個反應是放熱反應。隨著溫度的升高,反應放出的熱量呈現波動的情況,到500K左右放出的熱量最少。
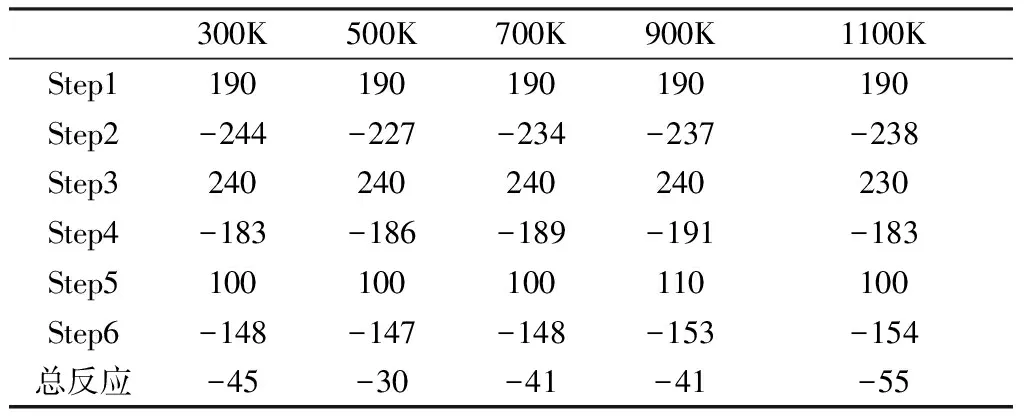
表3 第二階段熱解反應1在不同溫度下的焓變ΔH(單位:kJ/mol)
熱解反應第二階段反應1在不同溫度下的反應自由能變ΔG均小于0,表示反應1可以自發進行。隨著溫度逐漸升高,反應自由能變ΔG逐漸變大,說明溫度的升高不利于反應1正反應的進行。溫度的繼續升高,產物的轉化率也逐漸降低。300K時反應物的轉化率最高,1100K時反應物的轉化率最低。
綜合上述分析可以發現,500K左右時第二階段反應1的反應速率最大。
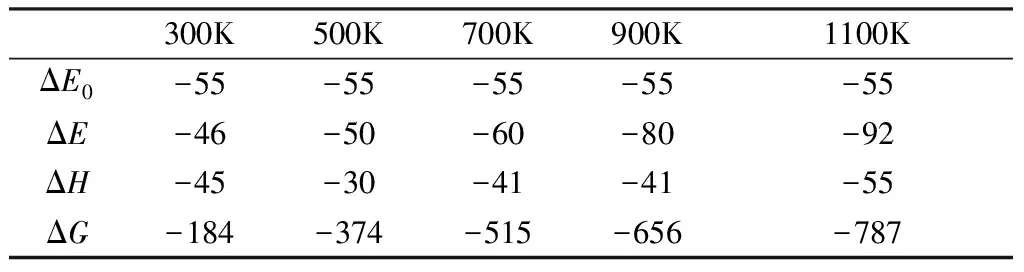
表4 第二階段反應1在不同溫度下的動力學變值(單位:kJ/mol)
圖6為第二階段反應1的勢能剖面圖。從圖中可以看出,反應物R3先反應產生過渡態TS21,然后TS21形成三個自由基(產物P3、P4和中間體IM21)。中間體再次反應,IM21反應生成過渡態TS22,然后TS22形成自由基(產物P5和中間體IM22)。中間體IM22生成過渡態TS23,然后生成產物P6和P5。
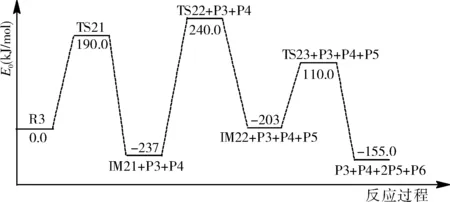
圖6 第二階段反應1的勢能剖面圖
3.3 第二階段單體2反應生成2-糠醛動力學分析
由表5和圖4可以看出,熱解反應第二階段的反應2是反應物R4先產生過渡態TS31,然后TS31反應生成中間體IM31。R4反應生成TS31是吸熱反應,不同溫度下焓變相同,都是170kJ/mol,說明溫度對這一步的反應影響不大。TS31反應生成中間體IM31是放熱反應,隨著溫度的變化,焓變值略有不同,300K時放熱最多,此時的焓變為-160kJ/mol。接著中間體IM31反應生成過渡態TS32,這一步也是吸熱反應,300K時吸收的熱量最多,此時的焓變為150kJ/mol。然后過渡態TS32反應生成中間體IM32和產物P5,這一步是放熱反應,隨著溫度的變化,反應放出的熱量呈現波動,700K時放熱最少,此時的焓變是-89kJ/mol,900K時放熱最多,此時的焓變是-101KJ/mol。再接著是中間體IM32反應生成過渡態TS33,最后TS33反應生成產物P6和P5。IM32反應生成TS33是吸熱反應,TS33反應生成P5和P6是放熱反應。整個反應即熱解反應第二階段反應2是吸熱反應。
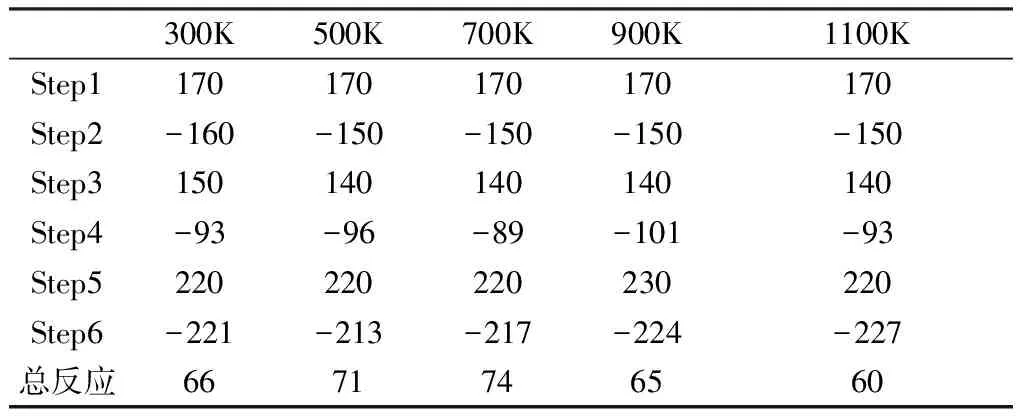
表5 第二階段熱解反應2在不同溫度下的焓變ΔH(單位:kJ/mol)
表6 中給出了熱解反應第二階段反應2在不同溫度下的動力學數據。5個溫度下的反應焓變ΔH均大于0,表示這個反應是吸熱反應。隨著溫度的升高,反應吸收的熱量越來越多,到700K左右達到峰值,溫度再升高,反應吸收的熱量反而減少。700K時反應吸收的熱量最多,表示此時的反應最容易進行,反應速率是最大的。
熱解反應第二階段反應2在不同溫度下的反應自由能變ΔG均小于0,表明反應2可以自發進行。隨著溫度的升高,反應自由能變ΔG逐漸變大,表明溫度的升高不利于反應2正反應的進行。隨著溫度的繼續升高,產物的轉化率逐漸降低。300K時反應物的轉化率最高,1100K時反應物的轉化率最低。
綜合上述分析可以發現,700K左右時第二階段反應2的反應速率最大。
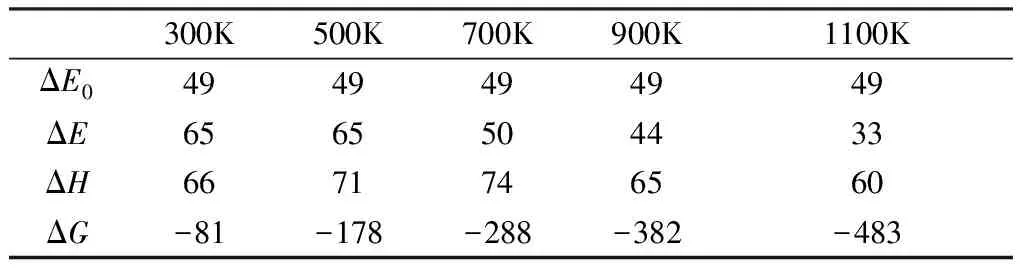
表6 第二階段反應2在不同溫度下的動力學變值(單位:kJ/mol)
圖7為第二階段反應2的勢能剖面圖。從圖中可以看出,反應物R4先反應產生過渡態TS31,然后TS31形成自由基(中間體IM31)。中間體再次反應,IM31反應生成過渡態TS32,然后TS32形成自由基(產物P5和中間體IM32)。中間體IM32生成過渡態TS33,然后生成產物P6和P5。
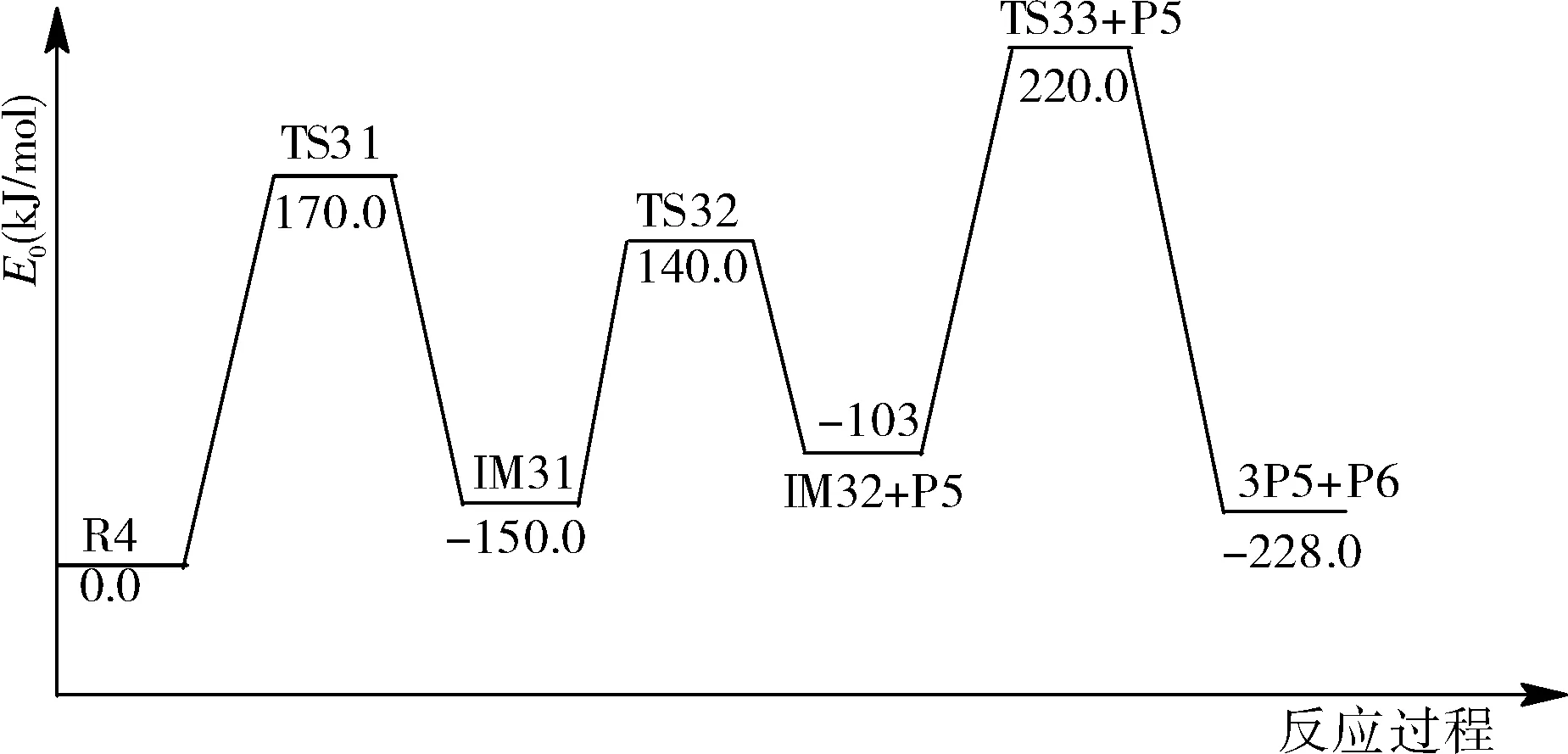
圖7 第二階段反應2的勢能剖面圖
4 結論
在半纖維素熱解反應過程中,利用其模型物二聚體4-O-甲基-D-葡萄糖醛酸-D-木糖來代替天然的半纖維素作為研究對象,將熱解反應分為兩個階段來研究,第一階段為二聚體4-O-甲基-D-葡萄糖醛酸-D-木糖的解聚,第二階段為解聚后的兩個單體分別反應生成半纖維素熱解反應的典型產物2-糠醛。
從各條反應路徑計算得到的熱力學數值上分析得出以下結論:隨著溫度的升高,反應放出的熱量越來越多,到700K左右熱解反應達到峰值,溫度再升高,反應的放熱反倒減少。但隨著溫度的繼續升高,產物的轉化率也逐漸降低。300K時反應物的轉化率最高,1100K時反應物的轉化率最低。綜合分析每個反應的動力學變值可以發現,700K左右是第一階段的熱解反應即二聚體解聚發生的最佳溫度,500K左右為第二階段反應1即支鏈分解反應的最大反應速率,700K左右為第二階段反應2即主鏈分解反應的最大反應速率。
參考文獻:
[1]宋衛東,方彤,王乾坤,等.2009年《世界能源展望》要點綜述[J].能源技術經濟,2010,22(1):18-22.
[2]中國可再生能源學會,中國科學院廣州能源研究所.中國新能源與可再生能源年鑒2010[K].西安:中國可再生能源學會,2010.
[3]Ahmed I I,Gupta A K.Kinetics of woodchips char gasification with steam and carbon dioxide[J].Applied Energy, 2011, 88(5): 1613-1619.
[4]Umeki K,Yoshikawa K,Namioka T.Analysis of an updraft biomass gasifier with high temperature steam using a numerical model[J].Applied Energy, 2012, 90(1): 38-45.
[5]郭艷,王垚,魏飛,等.生物質快速裂解液化技術的研究進展[J].化工進展,2001,(8):13-17.
[6]武書彬,彭云云.TG-FTIR聯用研究半纖維素的熱裂解特性[J].化工進展,2009,28(8):1478-1484.
[7]彭云云.蔗渣半纖維素的化學結構及其熱裂解特性研究[D].廣州:華南理工大學,2006.
[8]劉朝,李豪杰,黃金保.木聚糖熱解過程的分子動力學模擬[J].功能高分子學報,2010,23(9):291-296.
[9]譚洪.生物質熱裂解機理試驗研究[D].杭州:浙江大學,2005.
[10]王鳳娟,黃峰,楊桂花,等.半纖維素對漿紙質量的影響[J].造紙科學與技術,2010,29(1):28-32.
[11]張智,劉朝,李豪杰,等.木聚糖單體熱解機理的理論研究[J].化學學報,2011,69(9):2099-2107.
[12]董優雅.油菜籽粕生物質熱解過程及產物特性研究[D].北京:北京化工大學,2011.
[13]劉軍利.木質纖維類生物質定向熱解行為研究[D].南京:中國林業科學研究院,2011.
[14]楊卿.麥草及其三種主要組分的熱解規律[D].廣州:華南理工大學,2010.
[15]胡億明.木質生物質各組分熱解過程和熱力學特性研究[D].南京:中國林業科學研究院,2013.
[16]Bicout D,Field M.Quantum Mechanical Simulation Method for Studing Biological System(Les Houches Workship)[M].Berlin:Springer-Verlag,1995:1-21.

