原發(fā)性骨髓纖維化的治療進(jìn)展
譚栩,楊澤松,彭曦,李珍綜述 陳建斌審校
綜 述
原發(fā)性骨髓纖維化的治療進(jìn)展
譚栩,楊澤松,彭曦,李珍綜述 陳建斌審校
骨髓纖維化,原發(fā)性;異基因造血干細(xì)胞移植;JAK2抑制劑
原發(fā)性骨髓纖維化(PMF)是一種不常見的造血干細(xì)胞克隆性增殖性疾病(MPN),以骨髓纖維組織增生并髓外造血為特點(diǎn),出現(xiàn)進(jìn)行性貧血、脾臟腫大,伴有發(fā)熱、乏力、盜汗、消瘦等全身癥狀。在MPN中生存期和生活質(zhì)量都是最差的,中位生存期約5年,最終將進(jìn)展為骨髓衰竭或轉(zhuǎn)化為急性白血病。近年來低強(qiáng)度預(yù)處理的造血干細(xì)胞移植和靶向藥物等已經(jīng)用于PMF的治療并初顯療效,現(xiàn)將PMF治療進(jìn)展作一綜述。
1 PMF概述及臨床表現(xiàn)
PMF屬于BCR-ABL陰性的骨髓增殖性腫瘤。研究發(fā)現(xiàn)其發(fā)病原因可能是由于造血祖細(xì)胞的獲得性突變所引起激酶信號(hào)途徑失調(diào)、異常細(xì)胞因子表達(dá)和克隆性骨髓增殖。PMF以骨髓纖維組織增生并髓外造血為特點(diǎn),以貧血與脾大為主要臨床表現(xiàn),多數(shù)發(fā)生在50~70歲。早期臨床表現(xiàn)不典型,多數(shù)無癥狀。中期可出現(xiàn)乏力、消瘦或脾大所致的腹脹感。實(shí)驗(yàn)室檢查中,多數(shù)患者就診時(shí)有輕重不等的貧血,通常為正細(xì)胞正色素貧血,血涂片可見淚滴樣及多染性紅細(xì)胞,約70%出現(xiàn)幼粒、幼紅細(xì)胞。骨髓穿刺呈“干抽”現(xiàn)象是骨髓纖維化的特征。骨髓活檢可見到大量網(wǎng)狀纖維組織,為本病的診斷依據(jù)。染色體檢查可發(fā)現(xiàn)半數(shù)患者出現(xiàn)異常,但無pH染色體。總體預(yù)后差,中位生存年齡約5年,最終將進(jìn)展為骨髓衰竭或轉(zhuǎn)為急性白血病。
近期,經(jīng)過國(guó)際協(xié)作組的研究,加強(qiáng)版的國(guó)際動(dòng)態(tài)預(yù)后評(píng)分系統(tǒng)(DIPSS-plus)已經(jīng)問世,此系統(tǒng)結(jié)合了核型、血小板計(jì)數(shù)和輸血狀態(tài)的預(yù)后信息,見表1。預(yù)后不良因素包括年齡>65歲、全身癥狀(診斷前1年體質(zhì)量下降>10%、不明原因的發(fā)熱、嚴(yán)重盜汗超過1個(gè)月)、Hb<100 g/L、PLT<100×109/L、WBC>25×109/L、外周血原始細(xì)胞≥0.010、輸血依賴、不良核型[復(fù)雜核型、+8、-7/7q-、i(17q)、inv(3)、-5/5q-、12p-或11q23][1]。
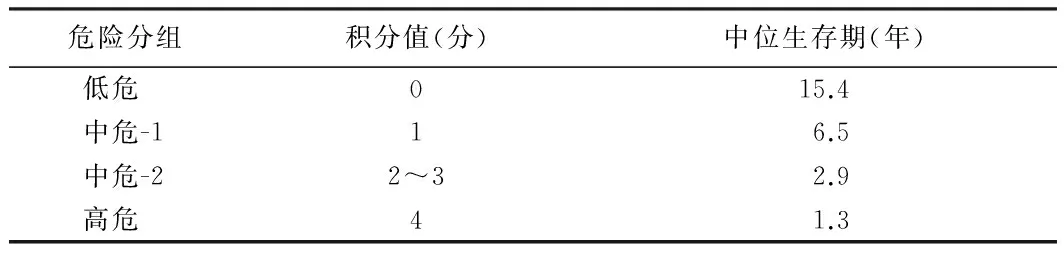
表1 DIPSS-plus危險(xiǎn)分組
2 原發(fā)性骨髓纖維化的治療
目前PMF的治療方法根據(jù)病情的嚴(yán)重程度來進(jìn)行治療。首先是常規(guī)藥物治療,其次就是放療以及臨床試驗(yàn)性藥物治療,最后是造血干細(xì)胞移植。根據(jù)預(yù)后分組選擇治療策略,有學(xué)者建議根據(jù)DIPSS-plus預(yù)后評(píng)分選擇治療方案。見圖1[2]。
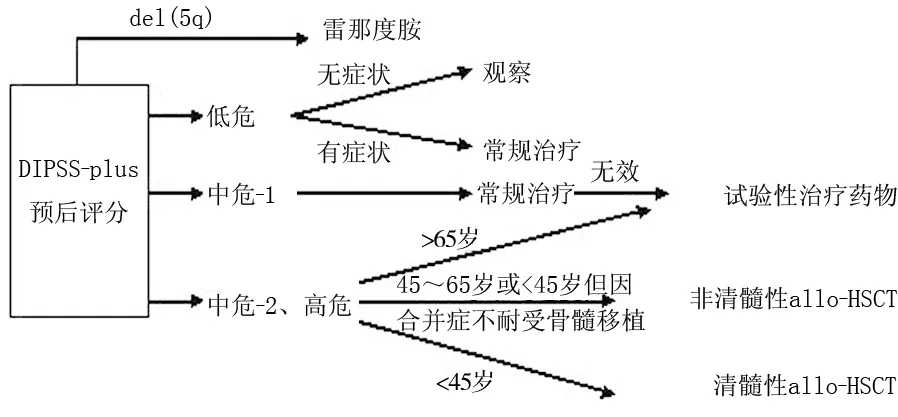
圖1 原發(fā)性骨髓纖維化患者的治療選擇
2.1 常規(guī)藥物治療
2.1.1 改善貧血: Hb<100 g/L時(shí)開始治療。常規(guī)藥物包括糖皮質(zhì)激素、雄激素、紅細(xì)胞生成素和免疫調(diào)節(jié)劑,根據(jù)患者的年齡及耐受情況等選擇合適藥物。初治患者可聯(lián)合糖類皮質(zhì)激素與雄性激素進(jìn)行治療,至少3個(gè)月,如果療效好,雄激素繼續(xù)服用,但皮質(zhì)激素用量需逐漸減量[3]。EPO適用于EPO<100 U/L的患者,對(duì)輸血依賴的患者效果欠佳,用于中度以上的脾臟腫大患者可能會(huì)加重脾大。嚴(yán)重貧血的可輸注紅細(xì)胞,文獻(xiàn)報(bào)道對(duì)于輸血依賴的患者,多次輸血需去鐵治療,可減少輸血次數(shù)[4]。
免疫調(diào)節(jié)劑的作用主要有抗血管新生,下調(diào)TNF-α和IL-6,上調(diào)IL-2和TNF-α及增強(qiáng)T細(xì)胞和NK細(xì)胞增殖與活性。其中用于改善PMF患者的貧血、血小板減少等癥狀的較常見的藥物就是沙利度胺,先從小劑量(50~100 mg/d)開始,緩慢增加用量。但大劑量沙利度胺(100~600 mg/d)會(huì)出現(xiàn)便秘、嗜睡、頭痛、神經(jīng)炎等不良反應(yīng),大部分患者難以耐受而退出治療。為了避免這些不良反應(yīng),研究者采用小劑量沙利度胺(50 mg/d)和聯(lián)合尼松治療,此方法能夠減少不良反應(yīng)同時(shí)又縮短不良反應(yīng)的時(shí)間[5]。雷那度胺是沙利度胺的衍生物,近年來有取代沙利度胺的趨勢(shì),不但對(duì)TNF-α的抑制作用加強(qiáng),且不良反應(yīng)明顯減輕,能有效治療伴有5q-細(xì)胞遺傳學(xué)異常的PMF。沙利度胺的另一種衍生物pomalidomide,為第3代免疫調(diào)節(jié)劑,主要不良反應(yīng)包括中性粒細(xì)胞減少和血栓形成,其神經(jīng)毒性明顯低于沙利度胺,骨髓抑制作用明顯低于雷那度胺。近期Begna等[6]進(jìn)行的II期臨床試驗(yàn)表明小劑量(0.5 mg/d)對(duì)JAK2 V617F陽性患者的療效明顯優(yōu)于陰性者。
2.1.2 減輕脾臟腫大 (1)化療:歐洲白血病網(wǎng)建議的藥物包括克拉曲濱(每日5 mg/m2,輸注2 h,連用5 d,每月1個(gè)療程,重復(fù)4~6個(gè)療程)、馬法蘭(2.5 mg,每周3次)、白消安(2~4 mg/d)[7]。不可忽視的是,羥基脲自然是化療的第一選擇,其用量控制20~30 mg/kg,縮脾有效率約40%。但是使用羥基脲會(huì)出現(xiàn)貧血或紅細(xì)胞形態(tài)異常、白細(xì)胞減少、血小板減少等不良反應(yīng)。(2)放射治療: 如果患者有以下癥狀之一可以選擇放射治療:嚴(yán)重的脾區(qū)疼痛、脾臟顯著腫大、禁忌切脾、脊髓壓迫癥狀、髓外纖維造血性腫瘤等癥狀。放射治療的優(yōu)點(diǎn)是有顯著的縮脾效果,缺點(diǎn)是作用時(shí)間不持久,大約是3~6個(gè)月。(3)脾切除: 由于脾臟是髓外造血器官,切除脾臟后可能會(huì)引起肝臟快速增大,血小板急劇增加,所以該方法有一定的限定人群。該方法適用于:①如果巨脾出現(xiàn)明顯的壓迫癥狀后又持續(xù)出現(xiàn)脾梗死,從而造成持續(xù)性疼痛。②血小板急劇減少或者出現(xiàn)溶血癥狀是由于脾功能亢進(jìn)導(dǎo)致的患者,在長(zhǎng)期藥物治療無效可以采用這個(gè)方法。而對(duì)血小板偏高者,并且手術(shù)后容易發(fā)生靜脈內(nèi)血栓,此類患者一般被視為脾切除手術(shù)禁忌證。脾臟腫大是擬行造血肝細(xì)胞移植患者的不良預(yù)后因素,因此有學(xué)者建議脾臟顯著增大的患者移植前應(yīng)先行脾切除。
2.2 異基因造血干細(xì)胞移植 目前,惟一可能治愈PMF的治療手段就是異基因造血干細(xì)胞移植(allo-HSCT)[8],但是其風(fēng)險(xiǎn)大,有較高的術(shù)后并發(fā)癥發(fā)生率(慢性移植物抗宿主病、感染等)和病死率[9~11],且目前還沒有確鑿的證據(jù)證實(shí)allo-HSCT與生存期延長(zhǎng)相關(guān)。一項(xiàng)對(duì)289例PMF患者的大型回顧性分析結(jié)果提示,1年間非血緣供受者間的allo-HSCT病死率達(dá)27%~43%[10]。所以對(duì)患者根據(jù)危險(xiǎn)因素分組,選擇治療方案具有重要的意義。Cervantes等[12]和Dingle等[13]都提出了依據(jù)患者年齡和預(yù)后危險(xiǎn)度選擇治療方案的原則,均認(rèn)為對(duì)于高危患者,應(yīng)行allo-HSCT。中危-2組患者由于生存期小于3年,故allo-HSCT仍為一線治療方案。低危組患者生存期長(zhǎng)可暫予以對(duì)癥支持治療。
根據(jù)研究表明,能否治愈的一項(xiàng)重要因素就是年齡,清髓性allo-HSCT的5年生存率,年齡>45歲患者僅14%,而45歲以下患者為62%[14]。但PMF患者年齡大多在50~60歲以上,清髓性allo-HSCT死亡風(fēng)險(xiǎn)高。研究發(fā)現(xiàn)清髓性和非清髓性allo-HSCT療效相當(dāng),因此部分清髓到非清髓的各種減低劑量預(yù)處理(reduced intensity conditioning,RIC)方案得以推出,且已在因年齡過高或有合并癥而無法接受清髓性SCT的PMF患者中成功應(yīng)用。一項(xiàng)RIC回顧性研究中,21例平均年齡54歲、中/高危患者,用不同的RIC方案進(jìn)行預(yù)處理,并接受了來自親緣供者的allo-HSCT,第1年非因疾病復(fù)發(fā)病死率(non-relapse mortality,NRM)為10%,2.5年總生存率為85%[15]。最近的一項(xiàng)RIC前瞻性研究,參與該研究的103例患者(平均年齡為55歲)以低劑量白消安/氟達(dá)拉濱預(yù)處理,1年內(nèi)非復(fù)發(fā)病死率為16%,32%的患者經(jīng)歷了慢性移植物抗宿主疾病,3年總生存率為70%,3年內(nèi)總復(fù)發(fā)率為22%[16]。可見RIC可減低移植相關(guān)病死率,改善allo-HSCT患者的預(yù)后。近年來,從國(guó)際血液和骨髓移植研究中心的數(shù)據(jù)顯示,進(jìn)行allo-HSCT的數(shù)量逐漸增多,考慮與降低預(yù)處理方案強(qiáng)度,使老年MF患者及合并高風(fēng)險(xiǎn)疾病的患者有機(jī)會(huì)行allo-HSCT有關(guān)[17,18]。另外,JAK2抑制劑的使用可改善MF患者的生存質(zhì)量,也可能增加了可進(jìn)行allo-HSCT的患者人數(shù)。
移植的時(shí)機(jī)對(duì)療效同樣重要。臨床實(shí)踐中,讓患者做干細(xì)胞移植是推后的治療手段。但如果患者有不良的細(xì)胞遺傳學(xué)(尤其是17號(hào)染色體)異常和/或疾病進(jìn)展的臨床表現(xiàn)(比如原始細(xì)胞增多,嚴(yán)重血小板減少),或轉(zhuǎn)為急性白血病,預(yù)示生存期<1年[19],則迫切的需要干細(xì)胞移植不能拖延。有研究表明在纖維化階段進(jìn)行allo-HSCT的成功率為50%~80%,但發(fā)生白血病轉(zhuǎn)化后移植成功率降為25%~40%[20]。因此PMF患者應(yīng)盡早進(jìn)行危險(xiǎn)度評(píng)估,預(yù)后評(píng)分差及高齡患者早期進(jìn)行適宜方案的干細(xì)胞移植對(duì)改善纖維化程度、降低移植相關(guān)病死率及延長(zhǎng)生存時(shí)間十分關(guān)鍵。
2.3 靶向藥物治療 目前的藥物性治療基本上為姑息性治療,不能改變PMF的進(jìn)展,更不能達(dá)到完全治愈PMF,所以研究者嘗試?yán)酶鞣N新藥,采用臨床試驗(yàn)的方法來測(cè)試藥物的可行性,其中JAK2抑制劑是比較成功的代表。JAK2 V617F突變發(fā)生在約50%的PMF患者。常用的JAK2抑制劑分特異性(I類)和非特異性(II類)2種。一些已在中高危PMF患者中開始使用。
2.3.1 INCB018424(ruxolitinib): 是一個(gè)高選擇性、口服生物利用度高的IAK1和JAK2抑制劑,2011年Incyte公司公布了ruxolitinib治療MF患者(包括原發(fā)性骨髓纖維化、真性紅細(xì)胞增多癥性和原發(fā)性血小板增多癥后骨髓纖維化患者)的COMEORT-I及COMEORT-II的研究成果顯示[21,22], 528例患者參與了該藥的安全性和有效性評(píng)價(jià)研究。研究分為3組:ruxolitinib組、安慰劑組(糖丸)和目前最佳療法(化療藥物羥基脲或糖皮質(zhì)激素)組。與安慰劑組和目前最佳療法組相比,ruxolitinib組50%以上患者腫大的脾臟至少縮小了35%。同樣,與安慰劑組相比,接受ruxolitinib治療的大部分患者觀察到的骨髓纖維化相關(guān)癥狀(包括腹部不適、盜汗、瘙癢、肌肉和骨骼疼痛)減輕50%以上。治療組報(bào)告的最嚴(yán)重的不良反應(yīng)包括血小板水平低(血小板減少癥)、貧血、乏力、腹瀉、氣短(呼吸困難)、頭痛、頭暈和惡心。JAK抑制劑臨床發(fā)展是非常樂觀的,并且最佳的治療時(shí)機(jī)、劑量和治療時(shí)間會(huì)將變得更加確切。
2.3.2 TG101348: 對(duì)JAK2選擇性強(qiáng)于JAK1,一個(gè)I/II期多中心臨床試驗(yàn)[23]對(duì)59例MF患者的臨床療效及安全性進(jìn)行了研究,最大耐受劑量為680 mg/d,28 d為1個(gè)療程,不良反應(yīng)為可逆的和無癥狀的血清淀粉酶升高,胃腸道反應(yīng)較大,約70%的患者出現(xiàn)惡心嘔吐,貧血、血小板減少、中性粒細(xì)胞減少的發(fā)生率分別為35%、24%和10%。但在患者用滿6個(gè)療程時(shí),已有近60%的患者脾臟縮小大于50%,且大部分合并高白細(xì)胞及高血小板的患者血細(xì)胞計(jì)數(shù)恢復(fù)正常。TG101348可以明顯減低JAK2 V617F突變的基因負(fù)荷,40%的患者突變基因負(fù)荷減少大于50%,TG101348也減少血液中炎性因子的含量,50%以上患者的夜間盜汗、疲勞、皮膚瘙癢及咳嗽癥狀迅速好轉(zhuǎn)。
2.3.3 CEP-701(Lestaurtinib): CEP-701是口服的JAK2及FLT3抑制劑, II期臨床試驗(yàn)選取22例JAK2 V617F陽性的PMF患者,劑量為80 mg,每天2次。其中6例(27%)臨床癥狀明顯緩解,中位起效時(shí)間為3個(gè)月,療效維持時(shí)間14個(gè)月以上。但是,8例(36.4%)出現(xiàn)3/4級(jí)不良反應(yīng),6例(27.3%)需要降低劑量,主要不良反應(yīng)是骨髓抑制和胃腸道反應(yīng)。胃腸道毒性顯著,腹瀉、惡心、嘔吐發(fā)生率分別為72%、50%和27%。在減少炎性細(xì)胞因子水平和JAK2 V617F突變的基因負(fù)荷沒有明顯療效[24]。
2.3.4 CYT-387: 在完成了對(duì)36例PMF患者I/II期臨床試驗(yàn)后結(jié)果顯示[25],貧血癥狀改善應(yīng)答率為63%(IMG-MRT標(biāo)準(zhǔn)),5例患者脫離輸血,37%的患者脾臟體積減小至少50%以上。提示CYT-387在改善貧血的方面療效佳。不良反應(yīng)方面,未見4級(jí)非血液學(xué)不良反應(yīng),3級(jí)非血液學(xué)不良反應(yīng)包括轉(zhuǎn)氨酶升高2例,堿性磷酸酶升高2例,頭痛2例,脂肪酶升高l例,QTc延長(zhǎng)1例,13例(36.1%)出現(xiàn)自限性的首劑效應(yīng)包括頭昏目眩和低血壓,8例(22.2%)出現(xiàn)3/4級(jí)血小板減少,1例突然出現(xiàn)3級(jí)貧血。
2.4 中醫(yī)治療 本病屬難治性血液系統(tǒng)疾病,病因未明確,中醫(yī)中藥治療鮮見,在現(xiàn)有的文獻(xiàn)報(bào)道中,以活血化瘀解毒法治療居多。蔡寅宵等[26]報(bào)道用清熱解毒、活血化瘀、軟堅(jiān)散結(jié)法治療12例IMF結(jié)果好轉(zhuǎn)者1例,進(jìn)步者8例,無效者2例,治療后臨床癥狀消失2例,臨床癥狀明顯改善7例,改善不明顯3例,提示活血化瘀法治療IMF有一定療效。
3 總結(jié)與展望
PMF發(fā)生的原因至今還沒有非常明確,可見這種病是非常復(fù)雜的,它是基于多種基因以及染色體的改變而導(dǎo)致的[27,28]。減低預(yù)處理劑量的非清髓allo-HSCT,已使部分患者獲得緩解,但仍有大部分患者因各種原因不適用于此方法。但如果只是靠藥物來維持,從而達(dá)到控制病情是不可能的;目前研究者已經(jīng)開始著手使用一些藥物聯(lián)合應(yīng)用,一些靶向IAK2V617F突變的新藥已經(jīng)進(jìn)入或完成臨床試驗(yàn),明顯改善患者的生活質(zhì)量。JAK2抑制劑對(duì)PMF患者的療效是明確的,但是PMF患者的突變基因不僅如此,還包括MPL、CBL等,因此仍有局限性[29,30]。臨床療效及藥物不良反應(yīng)的最佳比例很關(guān)鍵。希望不久的將來能達(dá)到逆轉(zhuǎn)PMF進(jìn)程的目的,使得恢復(fù)骨髓的基本造血功能成為可能。隨著醫(yī)學(xué)的進(jìn)步和發(fā)展,PMF發(fā)生的分子機(jī)制將會(huì)被詳細(xì)地闡明。此外,根據(jù)不同地域人的身體素質(zhì),或許適合于西方國(guó)家患者的藥物及劑量不一定適合于我國(guó)患者,所以還需要進(jìn)一步的實(shí)驗(yàn)室及臨床試驗(yàn)驗(yàn)證。
1 Tefferi A.How I treat myelofibrosis[J]. Blood, 2011, 117(13):3494-504.
2 Stewart WA,Pearce R, Kirkland KE, et al .The role of allogeneic SCT in primary myelofibrosis:a British society for blood and mar-row transplantation study[J]. Bone Marrow Transplant,2010,45(11):1587-1593.
3 肖志堅(jiān).規(guī)范和重視原發(fā)性骨髓纖維化的診斷和治療[J].白血病·淋巴瘤,2010,19(9): 513-516.
4 Di Tucci AA,Murru R,Alberti D,et al.Correction of anemia in a transfusion-dependent patient with primary myelofibrosis receiving iron chelation therapy with deferasirox[J].Eur J Haematol,2007,78(6):540-542.
5 Mesa RA, Steensma DP, Pardanani A, et al. A phase 2 trial of combination low-dose thalidomide and prednisone for the treatment of myelofibrosis with myeloid metaplasia[J]. Blood, 2003, 101(7):2534-2541.
6 Begna KH,Mesa RA,Pardanani A,et al.A phase-2 trial of low-dose pomalidomide in myelofibrosis[J].Leukemia,2011,25(2):301-304.
7 Barbui T, Barosi G, Birgegard G, et al. Philadelphia-negative classical myeloproliferative neoplasms: critical concepts and management recommendations from European Leukemia Net[J]. J Clin Oncol, 2011,29(6): 761-770.
8 Alchalby H, Badbaran A, Zabelina T,et al. Impact of JAK2V617F mutation status, allele burden, and clearance after allogeneic stem cell transplantation for myelofibrosis[J]. Blood,2010,116(18):3572-3581.
9 Patriarca F, Bacigalupo A, Sperotto A,et al. Allogeneic hematopoietic stem cell transplantation in myelofibrosis: the 20-year experience of the Gruppo Italiano Trapianto di Midollo Osseo(GITMO)[J]. Haematologica,2008,93(10):1514-1522.
10 Ballen KK, Shrestha S, Sobocinski KA,et al. Outcome of transplantation for myelofibrosis[J]. Biol Blood Marrow Transplant,2010,16(13):358-367.
11 Stewart WA, Pearce R, Kirkland KE,et al. The role of allogeneic SCT in primary myelofibrosis: a British Society for Blood and Marrow Transplantation study[J]. Bone Marrow Transplant,2010,45(11):1587-1593.
12 Cervantes F,Dupriez B,Pemim A,et a1.New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment[J].Blood,2009,113(13):2895-2901.
13 Dingle D,Sehwager SM,Mesa RA,et a1.Prognosis in transplant eligible patients with agnogenic myeloid metaplasia[J].Cancer,2006,106(3):623-630.
14 Bacigalupo A,Soraru M,Dominietto A,et al.Allogeneic hemopoietic SCT for patients with primary myelofibrosis:a predictive transplant score based on transfusion requirement,apleen size and donor type[J].Bone Marrow Transplant,2010,45(3):458-463.
15 Rondelli D,Barosi G,Bacigalupo A,et a1.Allogeneic hematopoietic stem-cell transplantation with reduced-intensity conditioning in intermediate or high-risk patients with myelofibrosis with myeloid metaplasia[J].Blood,2005,105(10):4115-4119.
16 Kroeger N,Holler E,Kobbe G,et a1.Allogeneic stem cell transplantation after reduced-intensity conditioning in patients with myelofibeosis:a prospective,multicenter study of the Chronic Leukemia Working Party of the European group for Blood and Marrow Transplantation[J].Blood,2009,114(26):5264-5270.
17 Ciurea SO,Sadedi B,Wilbur A,et al.Effects of eatensive splenomegaly in patients with myelofibrosis undergoing a reduced intensity allogeneic stem cell transplantation[J].Br J Haematol,2008,141(1):80-83.
18 Kroger N, Alchalby H, Klyuchnikov E,et al. JAK2-V617F-triggered preemptive and salvage adoptive immunotherapy with donor lymphocyte infusion in patients with myelofibrosis after allogeneic stem cell transplantation[J].Blood,2009,113(8):1866-1868.
19 Tam CS, Kantarjian H, Cortes J, et al.Dynamic model for predicting death within 12 months in patients with primary or post-polycythemia vera/essential thrombocythemia myelofibrosis[J]. J Clin Oncol,2009,27(33):5587-5593.
20 Scott B,Deeg HJ.Hemopoietic cell transplantation as curative therapy of myelodysplastic syndromes and myeloproliferative disorders[J].Best Praet Res Clin Haematol,2006,19(3):519-533.
21 Verstovsek S, Mesa RA, Gotlib J, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis[J].N Eng J Med,2012,366(9):799-807.
22 Harrison C, Kiladjian JJ, Al-Ali HK, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis[J].N Eng J Med,2012,366(9):787-798.
23 Pardanani A, Gotlib JR, Jamieson C, et al.Safety and efficacy of TG101348, a selective JAK2 inhibitor, in myelofibrosis[J]. J Clin Oncol,2011,29(7):789-796.
24 Santos FP,Kantarjian HM, Jain N,et a1.Phase 2 study of CEP-701,an orally available JAK2 inhibitor,in patients with primary or post-polycythemia vera/essential thromboeythemia myelofi brosis[J].Blood,2010,115(6):1131-1136.
25 Pardanani A,Laborde RR,Lasho TL,et al. Safety and efficacy of CYT387, a JAK-1/2 inhibitor, for the treatment of myelofibrosis[J].Leukemia,2013,27(6):1322-1327.
26 蔡寅宵,吳維海,張霞,等.中藥治療原發(fā)性骨髓纖維化12例臨床觀察[J].河北中醫(yī)藥學(xué)報(bào),2001,16(4):20-21.
27 徐祖瓊,孫雪梅,陳敏,等.骨髓纖維化JAK2V617F突變的臨床意義[J].臨床誤診誤治,2012,25(11):50-52.
28 趙玉霞,梁英,羅文波.骨髓活檢與涂片同步觀察全血細(xì)胞減少的臨床體會(huì)[J].中國(guó)現(xiàn)代醫(yī)生,2010,48(15):61,1040.
29 徐曉燕,翟小琳,呂濤.骨髓纖維化20例臨床分析[J].中國(guó)醫(yī)藥導(dǎo)報(bào),2009,6(4):155-156.
30 王菊關(guān),申克明,田佩華,等.慢性骨髓增殖性疾病患者JAK2 V617F點(diǎn)突變和KLF4 mRNA表達(dá)及其相關(guān)性的研究[J].疑難病雜志,2009,8(1):35-36.
重慶市衛(wèi)生局重點(diǎn)項(xiàng)目(No.2011-1-032)
400016 重慶醫(yī)科大學(xué)附屬第一醫(yī)院血液科
陳建斌,E-mail:cqchenjianbin@126.com
10.3969 / j.issn.1671-6450.2014.05.035
2013-10-23)

