經胼胝體側腦室脈絡膜裂入路切除丘腦膠質瘤的臨床效果觀察
羅冬冬 彭玉平 彭彪 秦明筠 張訓 胡骕 趙海林 李丹
青少年大約5%的顱內腫瘤發生于丘腦,其中以丘腦膠質瘤常見,且50%的腫瘤為高級別膠質瘤[1]。丘腦膠質瘤位置深在,毗鄰三腦室、內囊、下丘腦等重要中樞結構,手術難度大,并發癥多,病死率及病殘率高[2-3]。有學者對該部位腫瘤主張活檢明確診斷后再放射治療和/或化療,以延長患者的生存時間[4]。隨著神經外科顯微技術的發展,丘腦腫瘤也可得到次全切除,甚至全切除。近年來,本院采取經胼胝體側腦室脈絡膜裂入路切除內側型及外側型丘腦膠質瘤,并取得較為滿意的效果,現報告如下。
1 資料與方法
1.1 一般資料 選取2010年10月-2012年10月廣州醫科大學附屬腫瘤醫院收治的11例內側型及外側型丘腦膠質瘤患者,其中男6例,女5例;年齡9~54歲,平均25.6歲。臨床癥狀表現頭痛、嘔吐等顱內高壓征9例(81.8%),一側肢體乏力5例(45.5%),偏身感覺減退6例(54.5%),記憶力減退及智力下降2例(18.2%)。
1.2 影像學檢查 本組病例均行頭部MRI檢查,1例呈T1高低混雜信號,T2高信號,花斑狀強化;9例呈T1稍低信號,T2高信號,不均勻輕度強化;1例呈T1等信號,T2稍高信號,不均勻強化。所有病例邊界不清。均生長于一側丘腦,其中左側7側,右側4例。腫瘤大小2.2~6.5 cm,平均4.4 cm。腫瘤位于一側丘腦的外側,突向一側腦室或三腦室,其中內側型丘腦膠質瘤4例,外側型膠質瘤7例,1例患者腫瘤堵塞一側室間孔致一側腦積水,1例患者腫瘤巨大,突向側腦室三角部。
1.3 手術方法 選擇仰臥位,頭位抬高20o,三釘頭架固定,選擇腫瘤一側額部發際內馬蹄形手術切口6 cm×6 cm,內側跨中線1 cm,后界在冠狀縫后1 cm,皮瓣翻向前,銑刀切割形成5 cm×4 cm骨瓣,內側暴露矢狀竇緣,弧形剪開硬膜翻向中線。于冠狀縫前1.5 cm沿兩外耳道假想平面的垂線分離縱裂,使用自動牽開器牽開一側額葉,暴露雙側胼周動脈及胼胝體前部,縱行切開胼胝體1.5 cm,暴露側腦室,放出部分腦脊液,便于牽開額葉。本組4例患者腫瘤突入第三腦室,需在脈絡膜裂內側穹隆帶切開進入第三腦室切除腫瘤,其他7例患者在脈絡膜裂的外側切開丘腦的表層的薄層白質后切除腫瘤。切除腫瘤時需先進行瘤內分塊切除,縮小腫瘤體積后,再逐步沿周邊分離分塊切除。注意保護大腦大靜脈,若腫瘤與丘腦、中腦邊界不清,不必勉強全切,以大部分切除,減壓為主,保持室間孔、導水管通暢,并作透明隔造瘺,術后于殘腔內置引流管外引流,并于硬膜下置顱內壓監測探頭,術后持續監測顱內壓的變化。
1.4 術后處理與隨訪 術后11例患者行三維適形放療和或替莫唑胺化療,隨訪3~12個月。
2 結果
2.1 手術效果 本組腫瘤次全切除7例(63.6%),大部分切除4例(36.4%),見圖1~2。病理診斷:星形細胞瘤Ⅱ級6例(54.5%),Ⅲ級4例(36.4%),膠質母細胞瘤1例(9.1%)。術后10例(90.9%)顱內高壓征明顯緩解,3例(27.3%)對側肢體乏力癥狀有好轉,其他8例(72.7%)經康復理療后對側肢體乏力好轉。4例(36.4%)記憶力有下降。其中1例患者腫瘤巨大,向三腦室三角部生長,血供豐富,邊界不清楚,大部分切除后,術后顱內壓監測示顱壓急劇升高,對側肢體偏癱,神志昏迷,腦疝形成,瘤腔內形成血腫(圖2E),急診再次開顱手術清除血腫,去除骨瓣減壓,患者3周后神志轉清,經康復治療后,對側肢體肌力改善。
2.2 隨訪結果 9例(81.8%)患者隨訪6~12個月逐漸恢復正常生活,1例(9.1%)患者1年后腫瘤復發,再次手術切除,1例(9.1%)膠質母細胞瘤患者4個月后原位復發死亡。
3 討論
3.1 活檢或是手術切除 丘腦膠質瘤位置深在,毗鄰三腦室、內囊、下丘腦等重要結構,決定其治療必然是一個綜合治療的過程,目前已基本形成手術切除+放療+化療的治療模式[3,5-6]。但也有學者對手術切除持保守態度,主張活檢明確診斷后輔以放射治療以延長生存時間[4,7]。Reardon等[8]認為手術切除的程度對兒童丘腦高級別膠質瘤進展生存時間沒有影響。Kramm等[1]報道術前或術后丘腦膠質瘤的大小不能作為腫瘤進展或總生存期長短的一個預測因素,但術后及放療8周后殘余腫瘤越小,無進展生存時間越長。隨著顯微技術的發展,丘腦膠質瘤開顱手術切除成為可能。筆者認為,術前神經功能尚健全、腫瘤較小、顱內壓增高不明顯者,可選擇活檢術,明確病理后有目的地輔以放射治療及化療。但對于腫瘤偏大、并發梗阻性腦積水或局部占位效應明顯、神經功能明顯障礙者,在保留正常生理功能的前提下,最大限度地切除腫瘤,縮小腫瘤體積,保證室間孔、導水管等腦脊液循環的通路暢通,緩解顱內壓,為進一步地放射治療、化療等創造條件。丘腦位置固然深在,腹外側面緊鄰基底核和內囊,但其位于腦室腔道內,內側面、后面、上面均是游離的,這些解剖結構有利于手術的切除。并且有報道稱殘余的腫瘤越小,其術后放化療效果越好,生存期越長[9]。本組11例患者均采用開顱手術切除,在術后隨訪12個月后81.8%可以基本恢復正常生活。
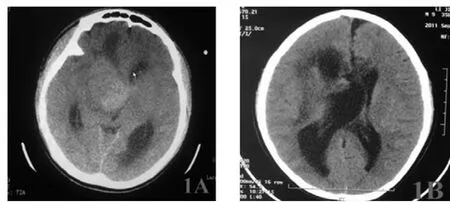
圖1 1例外側型丘腦膠質瘤手術前后影像學表現
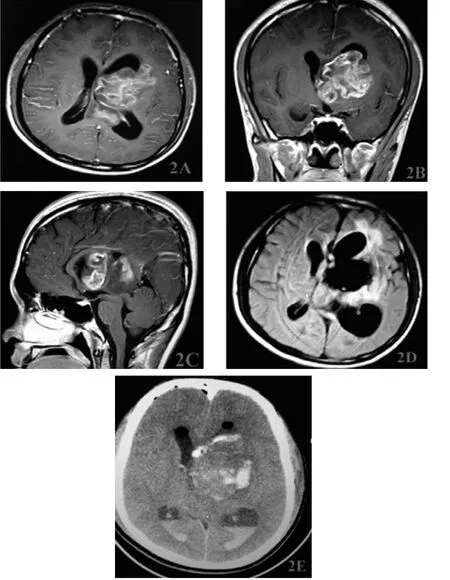
圖2 1例大型外側型丘腦膠質瘤手術前后影像學表現及術后瘤腔出血情況
3.2 經胼胝體側腦室脈絡膜裂入路的選擇 丘腦膠質瘤起源于起源于丘腦的外側部分,或腫瘤向外側生長,突入側腦室,為外側型丘腦膠質瘤;而起源于丘腦的內側,向中線生長,突入第三腦室則為內側型丘腦膠質瘤[10]。目前到達丘腦的手術入路有兩種:經皮質和經縱裂[11]。入路的選擇主要根據腫瘤的部位、生長方式、形狀及與毗鄰腦組織的關系等決定。對于內側型丘腦膠質瘤,宮劍等[10]報道選擇經胼胝體穹窿間入路進行切除,并取得較為滿意的效果。而外側型丘腦膠質瘤,常用的手術入路主要有經皮質(額、頂、顳、頂枕)腦室入路和經胼胝體入路腦室入路切除。選擇經胼胝體側腦室脈絡膜裂入路切除丘腦膠質瘤的優點有:(1)經胼胝體入路,可以通過縱裂、側腦室自然間隙入路,最大限度減少對皮層入路的損傷[12]。脈絡膜裂側腦室壁為最薄弱部位,經脈絡膜裂入路可以兼顧第三腦室前部、中部、后部范圍。本組10例采用自然間隙入路,均能達到切除腫瘤的目的,其中1例腫瘤巨大,由丘腦外側向側腦室體部及后角方向生長,需于冠狀縫前后切除部分額中回,進一步暴露術野切除。(2)路徑直接,解剖清楚,側腦室內空間大,丘紋靜脈、大腦內靜脈顯露清晰,便于術中的保護。本組無一例損傷相應靜脈而致嚴重的功能障礙。(3)該入路暴露良好,利于術中的充分止血,必要時可以通過神經內鏡的輔助,利用其不同角度的觀察,局部地放大作用,可以有效地對可能存在的術野死角進行充分止血并減少損傷正常的丘腦組織。(4)手術入路通過側腦室,有利于術后引流及減壓,且同時可進行顱內壓監測,為術后觀察患者病情提供充分條件。本組均常規使用有創顱內壓監護儀進行術后1周監測,可以動態觀察患者術后顱內壓的變化,尤其對可能存在的再出血,腦水腫等提供參考。
3.3 經胼胝體側腦室脈絡膜裂入路的術中技巧 (1)骨窗內側緣需盡可能靠近中線,可以垂直沿縱裂入路,避免為了暴露術野而極力牽拉額葉而致腦挫裂傷。但在切開胼胝體前均有可能損傷上矢狀竇、竇旁靜脈或胼周血管及其分支,術中注意保護,骨窗后緣以冠狀縫水平為佳,以避免損傷中央前回及中央溝靜脈[13]。胼胝體以切開體部為佳,偏前可能影響膝部和前聯合,造成額葉和顳葉信息傳遞中斷,偏后則會影響海馬聯合造成嚴重記憶障礙[14]。(2)脈絡膜裂、丘紋靜脈是重要的解剖標志。丘紋靜脈是丘腦背外側界的解剖標志,其外側是內囊和豆狀核,術中要嚴格保護。(3)于脈絡膜裂外側切除腫瘤前,需用棉片將腫瘤術區與腦室腔道隔開,避免血液流經腔道,導致積血,腦脊液循環障礙,術后出現高熱、腦積水等不良反應。(4)切除腫瘤先從最薄弱處開始,切開瘤質在瘤內切除,采用瘤鑷或吸引器由中心逐漸向外周分塊切除或吸除。(5)止血要注意細節。一般在切除腫瘤的過程,往往難以充分止血。這時先電凝大的出血,小的滲血可以使用棉片暫時壓迫止血,并逐步吸除腫瘤,出血必然會逐漸減少。瘤內出血往往較難止血,腫瘤組織軟,小血管有時會縮回去,因而會造成在瘤內反復電凝而未奏效,反而會因多次電凝而致腦組織熱損傷。筆者的經驗是在切到瘤腦交界薄層腦腫瘤時,先使用棉片壓住,使用低壓吸引逐漸吸除腫瘤,并逐步翻起腦棉片用微電流電凝止血,這樣在切除腫瘤的同時,止血也充分達到了,這時再敷貼止血紗往往達到良好的效果。容易忽略的是一些死角,比如游離面的內側,靠近三腦室內側,或巨大腫瘤超出顯微鏡視野范圍等是難于止血的,這時可以利用神經內鏡,在內鏡下控制下操作或內鏡輔助照明止血,也可選擇切除部分額葉擴大術野來解決。(6)術腔及腦室需分開放置引流管。有時術后瘤腔內再出血,隨著出血量的增多,會堵住瘤腔入口,形成血腫,且不與側腦室相通,造成嚴重后果。本組一例巨大的膠質瘤,瘤腔較大,只放置腦室引流管,術后6 h內再次出血,腦疝形成,頭部CT提示瘤腔內形成巨大血腫,反而腦室內積血不多(圖2E),該患者經二次手術清除血腫,放置引流,得以恢復,但神經功能損害較嚴重,恢復時間延長,總生存期2年。
隨著顯微技術的發展,通過胼胝體側腦室脈絡膜裂入路,術中注意操作技巧,可以達到腫瘤切除的效果,減輕腫瘤對內囊、腦室系統的壓迫,提高生存質量。但丘腦膠質瘤往往邊界不清,難以達到完全切除,術后應對殘留的腫瘤進行放療和化療,這樣更能有效提高生活質量并延長無進展生存時間[15-16]。
[1]Kramm C M,Butenhoff S,Rausche U,et al.Thalamic high-grade gliomas in children:a distinct clinical subset?[J].Neuro-oncology,2011,13(6):680-689.
[2]Martínez-Lage J F,Pérez-Espejo M A,Esteban J A,et al.Thalamic tumors:clinical presentation[J].Child’s Nerv Syst,2002,18(8):405-411.
[3]Souweidane M M,Hoffman H J.Current treatment of thalamic gliomas in children[J].J Neurooncol,1996,28(2-3):157-166.
[4]Coffey R J,Lunsford D L,Taylor F H.Survival after stereotactic biopsy of malignant gliomas[J].Neurosurgery,1988,22(3):465-473.
[5]Broadway S J,Ogg R J,Scoggins M A,et al.Surgical management of tumors producing the thalamopeduncular syndrome of childhood[J].J Neurosurg Pediatrics,2011,7(6):589.
[6]伍碧武,張義.丘腦膠質瘤研究現狀[J].中華神經外科雜志,2013,29(3):319-321.
[7]Bernstein M,Hoffman H J,Halliday W C,et al.Thalamic tumors in children:long-term follow-up and treatment guidelines[J].J Neurosurg,1984,61(4):649-656.
[8]Reardon D A,Gajjar A,Sanford R A,et al.Bithalamic involvement predicts poor outcome among children with thalamic glial tumors[J].Pediatr Neurosurg,1998,29(1):29-35.
[9]Steiger H J,G?tz C,Schmid-Elsaesser R,et al.Thalamic astrocytomas:surgical anatomy and results of a pilot series using maximum microsurgical removal[J].Acta Neurochir,2000,142(12):1327-1337.
[10]宮劍,馬振宇,張玉琪,等.經胼胝體-穹隆間入路切除內側型丘腦膠質瘤[J].中華醫學雜志,2005,85(20):1388-1391.
[11]黃繩躍,王開宇.經胼胝體入路顯微外科切除丘腦膠質瘤9例[J].福建醫藥雜志,2010,32(1):66-67.
[12]張義,莊冬曉,張海石,等.經額葉側腦室脈絡膜裂入路丘腦膠質瘤切除術[J].中華神經外科雜志,2011,27(4):484-486.
[13]Ulm A J,Russo A,Albanese E,et al.Limitations of the transcallosal transchoroidal approach to the third ventricle:Technical note[J].J Neurosurg,2009,111(3):600-609.
[14]Aryan H E,Ozgur B M,Jandial R,et al.Complications of interhemispheric transcallosal approach in children:review of 15 years experience[J].Clin Neurol Neurosurg,2006,108(8):790-793.
[15]段國升,張紀,周定標,等.丘腦腫瘤的外科治療[J].中華神經外科雜志,1989,5(3):164.
[16]萬經海,江澄川,仝海波.丘腦膠質瘤的外科治療[J].上海醫學,1994,17(12):683-685.

