骨髓間充質干細胞減緩急性百草枯中毒肺損傷
熊劍飛 朱長清 張柯基 呂利雄
·論著·
骨髓間充質干細胞減緩急性百草枯中毒肺損傷
熊劍飛 朱長清 張柯基 呂利雄
目的通過骨髓間充質干細胞(BMSCs)的植入,觀察其能否減緩急性百草枯中毒肺損傷。方法72只雌性大鼠隨機分為3組:百草枯組、BMSCs治療組、正常對照組,將體外分離和培養的BMSCs通過尾靜脈注入3組大鼠體內,觀察2周內3組大鼠的生存狀況、血漿中腫瘤壞死因子-α(TNF-α)、白介素-1β(IL-1β)、谷胱甘肽過氧化物酶(GSH-PX)、丙二醛(MDA)的水平變化和3組肺組織α-平滑肌肌動蛋白(α-SMA)表達水平。結果與百草枯組相比,BMSCs治療組可明顯延長大鼠的生存期,降低血漿中TNF-α、IL-1β的含量(P<0.01),升高GSH-PX的水平(P<0.01),減少血漿中MDA的水平(P<0.01),降低肺組織α-SMA表達水平(P<0.05)。結論BMSCs可減緩急性百草枯中毒引起的肺損傷。
骨髓間充質干細胞;百草枯;肺損傷;中毒
百草枯是一種有高度毒性的脫葉劑和除草劑,易溶于水。由于無意或故意攝入百草枯,急性百草枯中毒仍時有發生。其中毒主要累及肺臟,急性肺損傷是其典型改變,可引起一系列脂質過氧化反應和炎性反應,短期存活者常因晚期進行性肺纖維化、呼吸衰竭而死亡。由于目前尚無特效解毒藥物和有效的治療方法,百草枯中毒的病死率仍居高不下。多年來,國內外許多專家、學者對百草枯中毒機制進行了深入細致的研究,一直在努力尋找比較有效的治療方法,但至今前景不明[1]。骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)是存在于骨髓中的具有高度自我更新能力和多相分化潛能的成體干細胞,體外培養的BMSCs 有快速黏附和克隆能力和高度可塑性,能夠向不同譜系的細胞分化,如肝細胞、心肌細胞、腎小球細胞、神經元細胞,成骨細胞、軟骨細胞、脂肪細胞、肌肉細胞、星形膠質細胞等,這已被眾多的體外及體內實驗證實。近年來動物實驗發現骨髓來源的BMSCs可以向損傷肺臟遷移,直接或間接參與急性肺損傷的修復重建,對急性肺損傷有較好的治療效果,因而有可能為急性肺損傷的治療帶來新的希望[2,3]。本研究通過BMSCs的植入,觀察其能否減緩急性百草枯中毒肺損傷,初步探討BMSCs對急性百草枯中毒的影響,為臨床應用提供實驗依據。由于大部分患者死于頑固性低氧血癥及肺纖維化,所以如何有效地阻止肺損傷進一步惡化顯得十分關鍵,報告如下。
1 材料與方法
1.1 材料 雄性SD 大鼠3只,體重(60±5)g;雌性SD大鼠72只,體重(200±10)g(上海中醫藥大學動物實驗中心)。質量分數為20%的百草枯水劑(500 g/L,天津施普樂農藥技術發展有限公司)。DMEM-F12 (Hyclone公司), 胎牛血清(Hyclone公司),Percoll 分離液(Sigma公司),FITC anti-mouseCD34、CD45、CD44 和CD166(美國Biolegend公司)。大鼠IL-1β和TNF-αELISA試劑盒(上海西唐生物科技有限公司)。丙二醛(MDA)、谷胱甘肽過氧化物酶(GSH-PX)試劑盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 BMSCs的分離、培養與鑒定:將雄性SD大鼠頸椎脫臼法處死,無菌條件下取大鼠股骨和脛骨,無菌條件下取大鼠雙側股骨和脛骨,剔除骨表面附著的肌肉組織,在無菌潔凈工作臺中用無菌5 ml注射器抽取不含FBS的DMEM/F12培養液反復沖洗所取骨之髓腔,盡可能將骨髓組織多沖出。然后將沖出的骨髓細胞輕輕吹打制成單細胞懸液,用Percoll分離液分離后,將細胞重懸于10%胎牛血清的DMEM/F12培養液中,按1×105/cm2接種于25 cm2塑料培養瓶中, 置于37℃、5%CO2飽和濕度孵箱內培養。培養24 h后棄掉未貼壁細胞,貼壁細胞初期為單個圓形細胞,3~5 d后逐漸可見為梭形或多邊形明顯的集落生長。以后每2~3天換液1次,細胞長至80%~90%匯合后,大多數呈較均勻的梭形或紡錘形,用含0.02% EDTA的0.25%胰蛋白酶消化1 min,加適量血清終止消化,離心后重懸,按1∶3傳代。取第3代細胞,流式細胞儀檢測第3代細胞表達CD44、CD166,CD34和CD45不表達,表明獲得的貼壁細胞為BMSCs。
1.2.2 實驗動物分組和處理:受體動物是雌性SD大鼠,隨機分3組:①百草枯組(n=24):大鼠腹腔注射20%百草枯溶液15 mg/kg。②BMSCs治療組(n=24):百草枯注射同百草枯組,6 h后經尾靜脈注射BMSCs 1×106/只(0.5 ml)。③正常對照組(n=24):大鼠腹腔注射等體積0.9%氯化鈉溶液。
1.2.3 檢測指標與方法:觀察百草枯組和BMSCs治療組大鼠在注射后2周內的活動、進食表現并記錄存活天數。3組大鼠在注射后3、7、14 d處死,將收集的血漿用相應的試劑盒測定IL-1β、TNF-α、MDA和GSH-PX的水平。百草枯組大鼠存活時間短于14 d,故只收集百草枯注射后3、7 d血漿。同時分離并取出肺臟,取右肺中葉置入10%中性甲醛固定24 h,常規石蠟包埋,3組大鼠肺組織行免疫組化測α-平滑肌肌動蛋白(α-SMA)表達水平。使用Leica圖像自動分析系統對經α-SMA抗體免疫組化處理的切片100倍拍攝,每張切片拍攝6個不同視野,所得圖像進行進一步分析,計算每個視野中α-SMA所占比例,6個視野所得百分比相加求得算術平均數,以此平均數代表每張切片中α-SMA所占比例,從而獲得肺組織α-SMA定量數據。
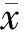
2 結果
2.1 BMSCs 的體外培養與鑒定 采用全骨髓法分離大鼠骨髓間充質干細胞,24 h后第1次換液,即可見較多細胞貼壁,細胞形態多為短棒狀,少數為多角形,可見少數細胞集落形成,但細胞仍混雜有較多的血細胞,經2~3次換液后,第5~6天絕大部分貼壁細胞形成集落,造血系細胞已明顯減少,細胞形態基本一致,呈長梭形,部分呈多角形。隨培養時間延長,貼壁細胞迅速增殖、數量日益增加,第8~10天細胞貼附緊密,呈長梭形,胞體中央可見胞核,待細胞鋪滿培養瓶底的80%~90%時可進行傳代培養。傳代后細胞在培養瓶中均勻生長,形態更為一致,梭形外觀。傳代細胞比原代細胞貼壁快,24 h內已全部貼壁、伸展,增殖迅速,均勻分布生長,傳至第三代時細胞形態比較均一。流式細胞儀檢測第3代細胞表達CD44、CD166、CD34 和CD45 不表達,表明獲得的貼壁細胞為BMSCs。
2.2 大鼠生存狀況和存活天數的觀察 百草枯組中,百草枯腹腔注射24~48 h后大鼠逐漸出現活動減少,進食少、呼吸頻率增快,存活最短時間是6 d,存活最長時間是12 d, 大鼠的平均存活天數是9.2 d。BMSCs治療組中,觀察的14 d中大鼠均存活,在注射后的前3 d內活動進食減少、呼吸頻率較快,但7 d后上述癥狀有所緩解。
2.3 3組大鼠血漿中TNF-α、IL-1β含量變化 與正常對照組相比, 百草枯組和BMSCs治療組中血漿TNF-α和IL-1β的含量均顯著上升(P<0.01)。在BMSCs治療組中,注射后3 d血漿TNF-α和IL-1β的含量與百草枯相比差異無統計學意義(P>0.05)。在BMSCs治療組注射后7 d血漿TNF-α和IL-1β的含量顯著低于百草枯組(P<0.01),到注射后14 d BMSCs 治療組炎性介質的含量有進一步下降。BMSCs治療組在各時段與正常對照組差異無統計學意義(P>0.05)。見表1。


組別 IL?1β3d(n=8)7d(n=8)14d(n=8)TNF?α3d(n=8)7d(n=8)14d(n=8)百草枯組46.78±4.52?112.36±7.91?-135.32±11.76?252.75±13.21?-BMSCs治療組45.25±5.63?79.75±5.82?#31.69±2.86?134.65±9.25?144.84±10.73?#65.20±6.64?正常對照組-11.98±3.66-35.96±3.83--
注:與正常對照組比較,*P<0.01;與百草枯組比較,#P<0.01
2.4 3組大鼠血漿中GSH-PX和MDA水平變化 與正常對照組比較,百草枯組和BMSCs 治療組中注射3 d大鼠血漿中GSH-PX 水平顯著下降(P<0.01),而MDA水平顯著上升(P<0.01);但與百草枯組相比,BMSCs 治療組中在注射7 d后,MDA水平開始下降(P<0.01),GSH-PX水平明顯回升(P<0.01)。BMSCs治療組在各時段與正常對照組差異無統計學意義(P>0.05)。見表2。
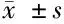

組別 MDA(nmol/ml)3d(n=8)7d(n=8)14d(n=8)GSH?PX(U/ml)3d(n=8)7d(n=8)14d(n=8)百草枯組4.58±0.63?5.39±0.72?-68.37±8.29?40.38±4.19?-BMSCs治療組4.45±0.58?4.05±0.22?#3.36±0.26?66.47±7.69?#89.71±6.32?#113.27±9.04?正常對照組-3.02±0.16--120.34±4.74-
注:與正常對照組比較,*P<0.01;與百草枯組比較,#P<0.01
2.5 3組肺組織α-SMA表達水平 免疫組化顯示與正常對照組相比,百草枯組和BMSCs治療組肺組織α-SMA表達水平均顯著上升(P<0.01)。但在BMSCs治療組中,注射后7 d肺組織α-SMA表達顯著低于百草枯組(P<0.05)。BMSCs對照組肺組織α-SMA表達水平與正常對照組比較差異無統計學意義(P>0.05)。見表3 。


組別α?SMA表達百草枯組43.01±2.49?BMSCs治療組35.14±2.85?#正常對照組22.87±3.16
注:與正常對照組比較,*P<0.01;與百草枯組比較,#P<0.05
3 討論
目前認為由于Ⅱ型肺泡細胞對百草枯有主動攝取和蓄積作用,使得肺臟成為此類中毒損害的主要靶器官。攝入百草枯后,通常2 h之內血漿濃度達到頂峰。而肺組織的百草枯濃度是血漿濃度的10~20倍[4]。百草枯作用于細胞的氧化還原反應,在細胞內活化為氧自由基是其中毒作用的基礎。所形成的過量超氧化陰離子自由基及過氧化氫等可引起肺、肝、腎及其他許多組織器官細胞膜脂質過氧化,從而造成多系統、多器官的損害。因為肺泡細胞對百草枯具有主動攝取和蓄積的特點,故肺組織中含量很高,且在5~7 h肺內百草枯濃度達到峰值,存留時間也非常久,所以肺損傷也最為明顯,早期可引起肺充血、出血、水腫、透明膜形成等改變,后期可出現肺纖維化。肺纖維化多發生在中毒后5~10 d,2~3周達到高峰,最終導致呼吸衰竭而死亡。有研究表明百草枯中毒的程度與肺組織中百草枯濃度有關[5]。因為急性肺損傷是導致百草枯急性中毒患者死亡的主要原因,所以救治的主要內容就是治療中毒繼發的急性肺損傷。近年來,國內也多次進行對百草枯中毒治療的大樣本臨床觀察和研究,試圖找到有效的綜合治療方案,但一直沒有找到突破口。當前臨床上主要通過洗胃、導瀉、口服活性炭或漂白土等盡快清除胃腸道殘留毒物,減少再吸收,血液凈化治療清除血液中的百草枯,但對于已進入重要器官和組織內的百草枯效果差;使用大劑量的糖皮質激素聯合免疫抑制劑治療,但療效不切確,且不良反應明顯。通過上述的綜合治療,雖然延長了中毒患者的存活時間,但并沒有明顯改變病死率。隨著近年來BMSCs研究的不斷進展,BMSCs技術在肺損傷領域的基礎研究和臨床應用前景也越來越受到關注。BMSCs有取材方便、再生能力強、細胞增殖快和操作簡單等優點。研究發現在受到電離輻射時,BMSCs有良好的自由基清除能力[6]。另有研究發現人類來源的BMSCs可移植到動物體內,說明BMSCs的低免疫原性,能逃避宿主的免疫排斥[7]。有學者發現BMSCs還有免疫調節作用,能抑制受體體內炎性介質的釋放[8]。已有研究顯示BMSCs 可聚集到肺損傷部位,分化并修復肺泡上皮細胞,減輕炎性反應[9]。上述的研究結果為BMSCs應用于百草枯中毒的治療提供了可能性。本研究結果顯示:BMSCs植入后7 d使百草枯中毒大鼠血漿中炎性介質IL-1β和TNF-α含量顯著降低,14 d內大鼠均存活,提示其具有抑制炎性介質釋放、減輕炎性反應和延長生存期的能力。而植入后3 d,BMSCs治療組與百草枯組大鼠血漿中炎性介質IL-1β和TNF-α含量無顯著性差異,說明BMSCs植入后起作用需要一定的時間。
百草枯中毒導致急性肺損傷的機制尚未完全闡明,目前主要理論之一即氧自由基損傷理論,百草枯進入組織后通過氧化還原過程產生大量氧自由基,誘導脂質過氧化,損害細胞,導致細胞變形壞死。MDA是機體內氧自由基代謝中產生的脂質過氧化產物,GSH-PX是體內重要的自由基清除劑,本研究顯示BMSCs的植入7 d后,大鼠體內MDA水平較百草枯組下降,而GSH-PX較百草枯組升高,表明機體脂質過氧化的程度下降。但在BMSCs植入第3天,BMSCs植入組MDA、GSH-PX水平與百草枯組無顯著性差異,同樣說明BMSCs植入后起作用需要一定的時間。至于為什么BMSCs植入早期作用不明顯和植入后多長時間其作用到達高峰需要在以后實驗中進一步研究。
研究表明上皮間質細胞轉移是肺纖維化過程中肌成纖維細胞的一個重要來源[10]。上皮間質轉化是指上皮細胞向間質細胞轉化。在分子水平,上皮間質轉化表現為上皮細胞標記物E-鈣黏蛋白的丟失,而出現肌成纖維細胞標記物α-SMA。本結果表明使用BMSCs后,肺組織α-SMA表達下降,提示BMSCs 的植入能減緩百草枯所致的肺纖維化。
1 Martin FW,Ravindra F,Ariyananda PL,et al.Improvement in survival after Paraquat ingestion following introduetion of a new formulation in Sri Lanka.PLoS Medicine,2008,5:250-258.
2 Rojas M,Xu J,Woods CR,et al.Bone marrow-derived mesenchymal stem cells in repair of the injured lung.Am J Respir Cell Mol Biol,2005,33:145-152.
3 Wang G,Bunnell BA,Painter RG,et al.Adult stem cells from bone marrow stroma differentiate into airway epithdial calls:potential therapy for cystic fibrosis.Pro Natl Acad Sci USA,2005,1029:186-191.
4 Hoet PH,Nemery B.Polyamines in the lung: polyamine uptake and polyamine-linked pathological or toxicological conditions.Am J Physiol Lung Cell Mol Physiol,2000,278:L417-433.
5 Jones AL,Elton R,Flanagan R.Multiple logistic regression analysis of plasma paraquat concentrations as a predictor of outcome in 375 cases of paraquat poisoning.QJM,1999,92:573-578.
6 Chen MF,Lin CT,Chen WC,et al.The sensitivity of human mesenchymal stem cells to ionizing radiation.Int J Radiat Oncol Biol Phys,2006,66:244-253.
7 Allers C,Sierralta W,Neubauer S,et al.Dynamic of distribution of human bone marrow-derived mesenchymal stem cells after transplantation into adult unconditioned mice.Transplantation,2004,78:503-508.
8 Jang MJ,Kim HS,Lee HG,et al.Placenta-derived mesenchymal stem cells have an immunomodulatory effect that can control acute graft-versus-host disease in mice.Acta Haematol,2013,129:197-206.
9 Yu J,Zheng C,Ren X,et al.Intravenous administration of bone marrow mesenchymal stem cells benefits experimental autoimmune myasthenia gravis mice through an immunomodulatory action.Scand J Immunol,2010,72:242-249.
10 Willis BC,duBois RM,Borok Z.Epithelial origin of myofibroblasts during fibrosis in the lung.Proc.Am Thorac Soc,2006,3:377-382.
10.3969/j.issn.1002-7386.2014.21.037
200127 上海市,上海交通大學醫學院附屬仁濟醫院急診科
朱長清,200127 上海交通大學醫學院附屬仁濟醫院;
E-mail: zhucq1965@126.com
R 781.66
A
1002-7386(2014)21-3295-04
2014-04-18)

