腹瀉型腸易激綜合征患者腸道目標菌群的分析
李小萍,王巧民,褚 源,宋繼中,沈佐君
腹瀉型腸易激綜合征患者腸道目標菌群的分析
李小萍1,王巧民1,褚 源1,宋繼中1,沈佐君2
目的 研究腹瀉型腸易激綜合征(IBS-D)患者與正常對照者的腸道菌群差異。方法 實時熒光定量PCR法檢測50例IBS-D患者及25例正常對照者糞便中長雙歧桿菌屬、乳酸桿菌屬、脆弱擬桿菌、產氣莢膜梭菌、大腸桿菌和糞腸球菌屬的數量,并對各組的目標菌群數量進行比較,計算腸道定值抗力,腸道定值抗力(CR)是指腸道內需氧的潛在致病菌群被腸道內源性厭氧菌抑制的能力,雙歧桿菌數值與腸桿菌數值之比作為腸道微生物定值抗力的指標,即B/E值。結果 與正常對照者比較,IBS-D患者糞便中大腸埃希菌、產氣莢膜梭菌的數量明顯增多(P<0.05),而乳酸及雙歧桿菌屬的數量明顯減少(P<0.05),糞腸球菌、脆弱擬桿菌在兩組之間比較差異無統(tǒng)計學意義。IBS-D患者B/E值<1,與正常對照者比較明顯降低(P<0.05)。結論 IBS-D患者腸道菌群平衡被打破,表現為B/E值降低,且糞便中腸桿菌及產氣莢膜梭菌數量增加,雙歧桿菌、乳酸桿菌的數量明顯減少。
腸易激綜合征;腸道菌群;實時熒光定量PCR
腸易激綜合征(irritable bowel syndrome,IBS)是胃腸道功能紊亂的一種常見病,其特征是病因不明的腹痛伴隨排便習慣及大便性狀的改變。盡管IBS不會帶來嚴重的疾病,但它卻降低了患者的生活質量[1]。傳統(tǒng)研究腸道菌群的分離培養(yǎng)方法對培養(yǎng)條件要求較高、費時費力,且大部分腸道共生菌為專性厭氧菌,在體外無法培養(yǎng)。近年來研究者開始應用分子生物學方法研究腸道菌群。該研究應用實時熒光定量PCR法對腹瀉型(IBS-D)患者及正常對照者糞便內目標菌群進行分析,比較兩組間糞便菌群的差異。
1 材料與方法
1.1 病例資料 根據羅馬Ⅲ診斷標準[2],收集2013年1月~7月于安徽醫(yī)科大學附屬省立醫(yī)院門診就診的IBS-D患者50例(男30例,女20例);年齡18~70(44.82±13.50)歲。有下列情況的IBS-D患者將被排除在外:①年齡<18歲;② 懷孕、哺乳期或無法合作者;③ 在過去的4周內使用過抗生素;④曾有重大的或復雜的腹部手術史者;⑤ 存在嚴重系統(tǒng)性疾病或子宮內膜異位癥,或被診斷患有老年癡呆癥。所有參與實驗組的研究對象均有臨床及內鏡下胃腸檢查或近1年內有鋇劑灌腸檢查。正常對照組的糞便標本選自年齡、性別與患者組匹配的25例正常對照者,男15例,女10例;年齡18~70(38.76±9.33)歲。要求兩組留取糞便標本前4周內沒有消化道不適癥狀,且沒有使用過抗生素或微生態(tài)制劑。
1.2 試劑與儀器
1.2.1 主要試劑 血平板、營養(yǎng)瓊脂平板、TPY瓊脂平板及改良MRS(實驗室自備);DNA提取試劑盒(德國Qiagen公司);DNA切膠回收試劑盒、2×Taq PCR Master Mix(美國Axygen公司);2×SYBR?PremixExTaqTM(北京康為世紀生物科技有限公司)。
1.2.2 主要儀器 YQX-Ⅱ手套式厭氧培養(yǎng)箱(上海新苗醫(yī)療器械制造有限公司);-80℃冰箱;7500型實時熒光定量PCR儀(美國ABI公司)。
1.2.3 6 種標準菌株 從廣東環(huán)凱微生物科技有限公司購買大腸埃希菌(Escherichia coli,8379)、糞腸球菌(Enterococcus faecalis,29212)、嗜酸乳桿菌(Lactobacillus acidophilus,1.1878)、長 雙 歧 桿 菌(Bifidobacteria longum,15701)、產氣莢膜梭菌(Clostridium perfringens,13124)、脆弱擬桿菌(Bacaeroides fragilis,25285)的凍干粉4~8℃保存?zhèn)溆谩?/p>
1.3 方法
1.3.1 6 種標準菌株的復蘇、培養(yǎng) 取適量腦心浸液與標準菌株凍干粉充分混勻,長雙歧桿菌(接種于TPY瓊脂平板)、嗜酸乳桿菌(接種于改良MRS)、產氣莢膜梭菌(接種于血平板)及脆弱擬桿菌(接種于血平板)置入YQX-Ⅱ手套式厭氧培養(yǎng)箱中,大腸埃希菌(接種于營養(yǎng)瓊脂平板)及糞腸球菌(接種于營養(yǎng)瓊脂平板)置于恒溫培養(yǎng)箱,37℃恒溫培養(yǎng)24~72 h后挑單一菌落,接種于相應的培養(yǎng)基中連續(xù)培養(yǎng)1代(條件同上),培養(yǎng)完成后放置4℃保存。
1.3.2 6 種標準菌株DNA的提取 挑取單一菌落的細菌菌落,用比濁法使?jié)舛瓤刂圃?×1012cfu/L,再提取DNA,測其濃度后于-20℃保存。
1.3.3 糞便標本收集、DNA提取 排便后迅速收集糞便標本于無菌的培養(yǎng)皿中,并于2 h內置于-80℃保存。提取DNA,測其濃度后于-20℃保存。
1.3.4 6 種細菌 PCR 引物設計 參照文獻[3-4],根據大腸埃希菌、糞腸球菌、脆弱擬桿菌、產氣莢膜梭菌、乳酸桿菌及長雙歧桿菌16S rDNA基因序列設計各菌種特異性PCR引物,見表1。

表1 靶基因PCR擴增引物序列
1.3.5 6 種引物的特異性檢測 分別取6種標準菌株基因組DNA與1個正常對照者的糞便基因組DNA行普通PCR實驗。20 μl的反應體系,反應條件:94℃預變性3 min;94℃變性30 s、T℃(大腸埃希菌53℃,糞鏈球菌51.8℃,嗜酸乳桿菌52℃,長雙歧桿菌53.5℃,脆弱擬桿菌52℃,產氣莢膜梭菌51.8℃)退火30 s,72℃延伸1 min,共35個循環(huán),72℃復性5 min。以2 000 bp DNA Ladder為Marker,擴增產物在1.2%瓊脂糖凝膠中電泳。
1.3.6 6 種細菌標準品的制備 取6種標準菌株的DNA進行普通PCR實驗(反應體系和條件同上),接著在1.2%瓊脂糖凝膠中電泳,然后在紫外分光光度計下盡量完全切下含目的基因產物的條帶,按DNA切膠、回收試劑盒行標準菌株DNA擴增產物的純化、回收,測其濃度后于-20℃保存。
1.3.7 6 種細菌標準曲線制作 用上述純化、回收后的標準菌株DNA作為熒光定量PCR的標準品,按照測定的濃度,換算成各標準品1 μl的拷貝數(大腸埃希菌5.36×109、糞腸球菌1.27×1010、嗜酸乳桿菌5.34×109、長雙歧桿菌 7.51×109、脆弱擬桿菌1.04×1010、產氣莢膜梭菌7.02×109)用于制作標準曲線。將各菌株稀釋成為1×1010~1×103copies/ml作為標準品,進行SYBR GreenⅠ實時熒光定量 PCR 反應,20 μl反應體系:2×SYBR?PremixExTaqTM10 μl,DNA 模板 2 μl,ddH2O 7 μl,20 μmol/L上下游引物各0.5 μl;反應步驟:95℃預變性3 min;95℃變性10 s,T℃ (大腸埃希菌61℃,糞腸球菌60℃,嗜酸乳桿菌屬58℃,雙歧桿菌屬57.5℃,脆弱擬桿菌58℃,產氣莢膜梭菌55℃),退火30 s,65℃延伸10 s,共40個循環(huán)。反應完畢后讀取熒光定量PCR數據,分析溶解曲線。根據讀取的熒光數據,由系統(tǒng)軟件自動分析Ct值,同時生成標準曲線。
1.3.8 檢測糞便標本 兩組糞便提取的DNA分別進行6種細菌的16S rDNA熒光定量PCR反應,反應體系和條件與制備標準曲線時一致。所有標本實時熒光定量PCR反應均同時做3個平行復孔。將每個糞便標本檢測得到的結果轉換為靶細菌的基因組在1 g糞便中的平均估計值(濕重)。
1.4 統(tǒng)計學處理 采用SPSS 20.0統(tǒng)計軟件進行分析,數據以±s表示,兩獨立樣本比較采用t檢驗。
2 結果
2.1 PCR產物鑒定 用1.2%瓊脂糖凝膠電泳,分別分析6種標準菌株、正常對照者及IBS-D患者糞便中的普通PCR產物,可見6種標準菌株PCR擴增產物均為單一的條帶,與預期的DNA片段長度一致,能夠用于定量PCR反應。見圖1。
2.2 6 種細菌的擴增圖譜分析 各標準品被10倍稀釋后行實時熒光定量PCR反應,可得模板循環(huán)數(Ct值)與熒光強度的關系圖,6種細菌的定量分析在指數擴增期進行。見圖2。
2.3 6 種細菌的標準曲線分析 以實時熒光定量PCR反應過程中達到熒光閾值的初始循環(huán)數(Ct)作為橫坐標,不同拷貝數的標準品的對數作為縱坐標,為待測樣本的定量分析提供了參考標準,見圖3。
2.4 6 種細菌的溶解曲線分析 溶解曲線分析是在PCR從95~60℃(0.3℃/循環(huán))緩慢冷卻過程中進行的,同時檢測SYBR GreenⅠ信號強度,6種細菌的溶解曲線均為單一峰,說明與定量PCR熒光染料結合的為單一的目的片段DNA,見圖4。

圖1 6種細菌PCR產物凝膠電泳圖
2.5 實驗組與正常對照組糞便細菌的定量檢測及定值抗力(B/E)值的比較 與正常對照組比較,實驗組糞便中大腸埃希菌、產氣莢膜梭菌的數量明顯增多(P<0.05),而乳酸及雙歧桿菌屬的數量明顯減少(P<0.05),腸道定值力B/E<1,與正常對照組比較明顯減低(P<0.05),但糞腸球菌、脆弱擬桿菌在兩組之間比較差異無統(tǒng)計學意義,見表2。
表2 糞便標本目標細菌定量結果(log10±s,log10對數平均目標基因組拷貝數/克濕便)
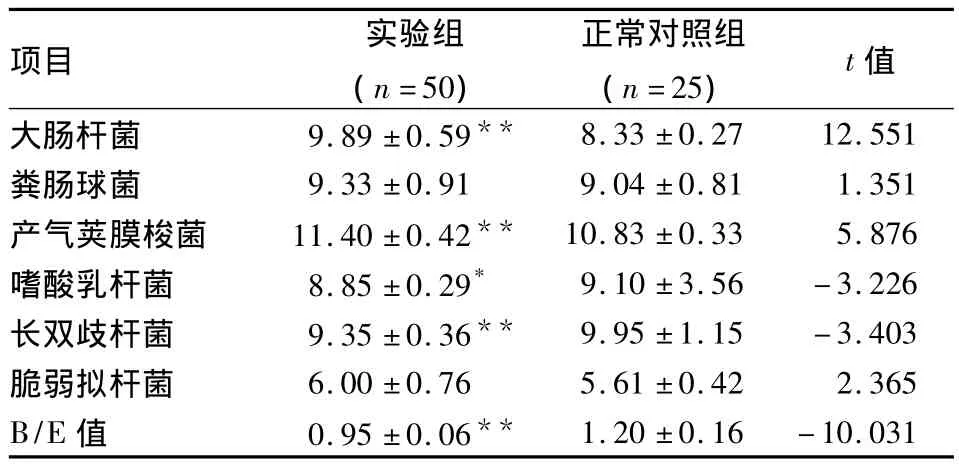
表2 糞便標本目標細菌定量結果(log10±s,log10對數平均目標基因組拷貝數/克濕便)
與正常對照組比較:*P <0.05,**P <0.01
項目 實驗組(n=50)正常對照組(n=25) t值大腸桿菌 9.89 ±0.59**8.33 ±0.27 12.551糞腸球菌 9.33 ±0.91 9.04 ±0.81 1.351產氣莢膜梭菌 11.40±0.42** 10.83±0.33 5.876嗜酸乳桿菌 8.85±0.29* 9.10±3.56-3.226長雙歧桿菌 9.35±0.36** 9.95±1.15-3.403脆弱擬桿菌 6.00 ±0.76 5.61 ±0.42 2.365 B/E 值 0.95 ±0.06**1.20 ±0.16-10.031
3 討論
腸道正常菌群對于宿主個體來說非常重要。然而,屬于正常菌群的細菌似乎也能夠在某些個體或情況下引起疾病。實驗[5-7]表明腸道正常菌群的改變在IBS發(fā)生發(fā)展中起著主要作用。本研究與國內外部分報道[8-10]的菌群變化趨勢一致,通過對IBSD患者腸道微生態(tài)菌群分析發(fā)現,相對于正常對照者腹瀉型IBS患者糞便中的雙歧桿菌、乳酸桿菌比例明顯降低,腸桿菌、產氣莢膜梭菌比例明顯升高;雙歧桿菌/腸桿菌(B/E)<1,這反映了微生物抗移植性降低,易使?jié)撛谛灾虏【巴鈦碇虏【L[11]。結果顯示IBS-D患者存在腸道菌群數量的增減和比例失調以及菌種性質的變化,表明IBS-D與腸道菌群失調有一定的相關性。
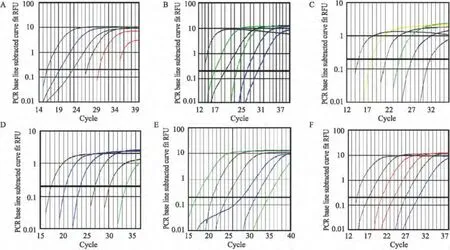
圖2 6種標準品實時熒光定量PCR擴增圖譜
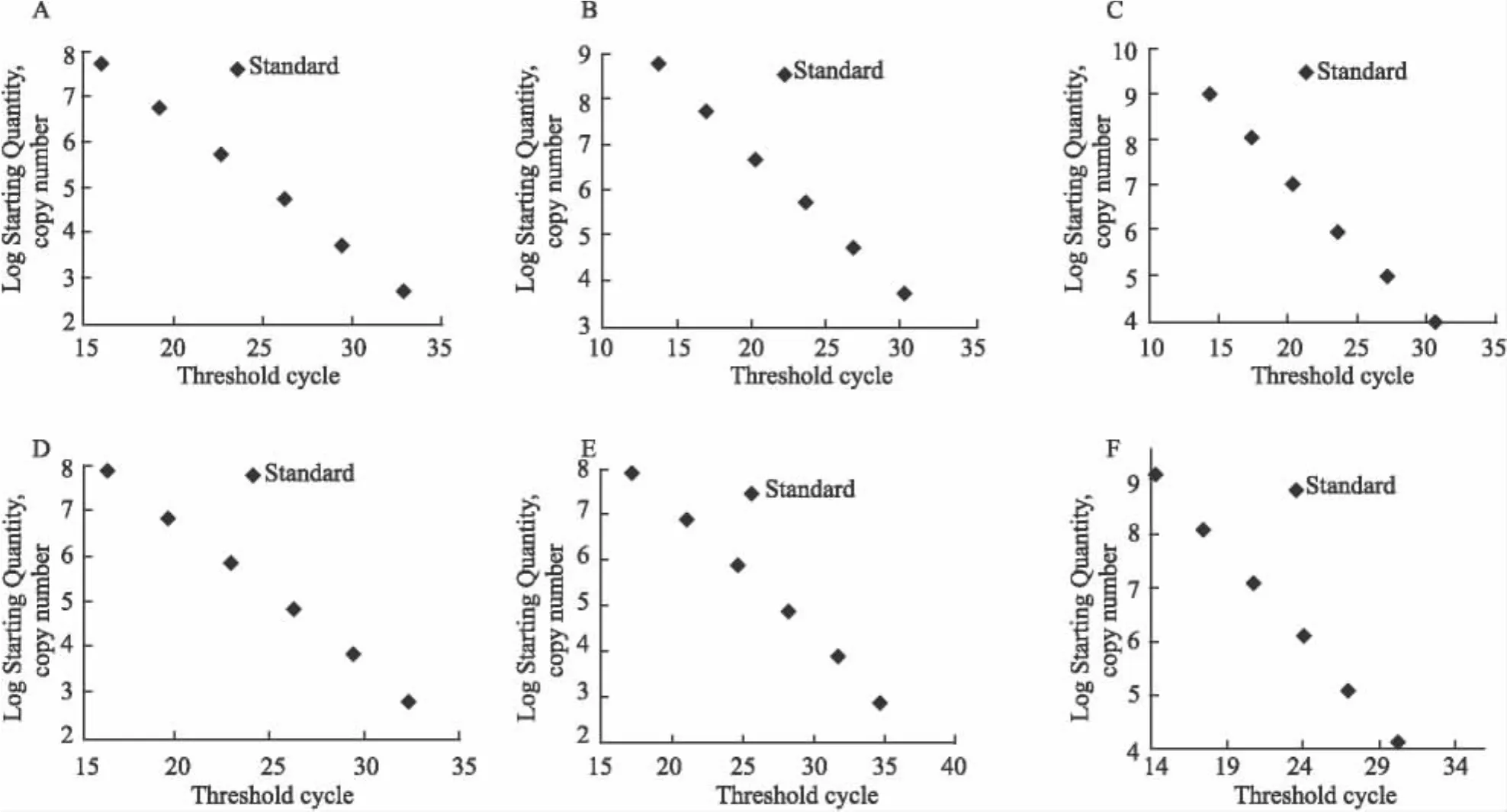
圖3 6種細菌的標準曲線
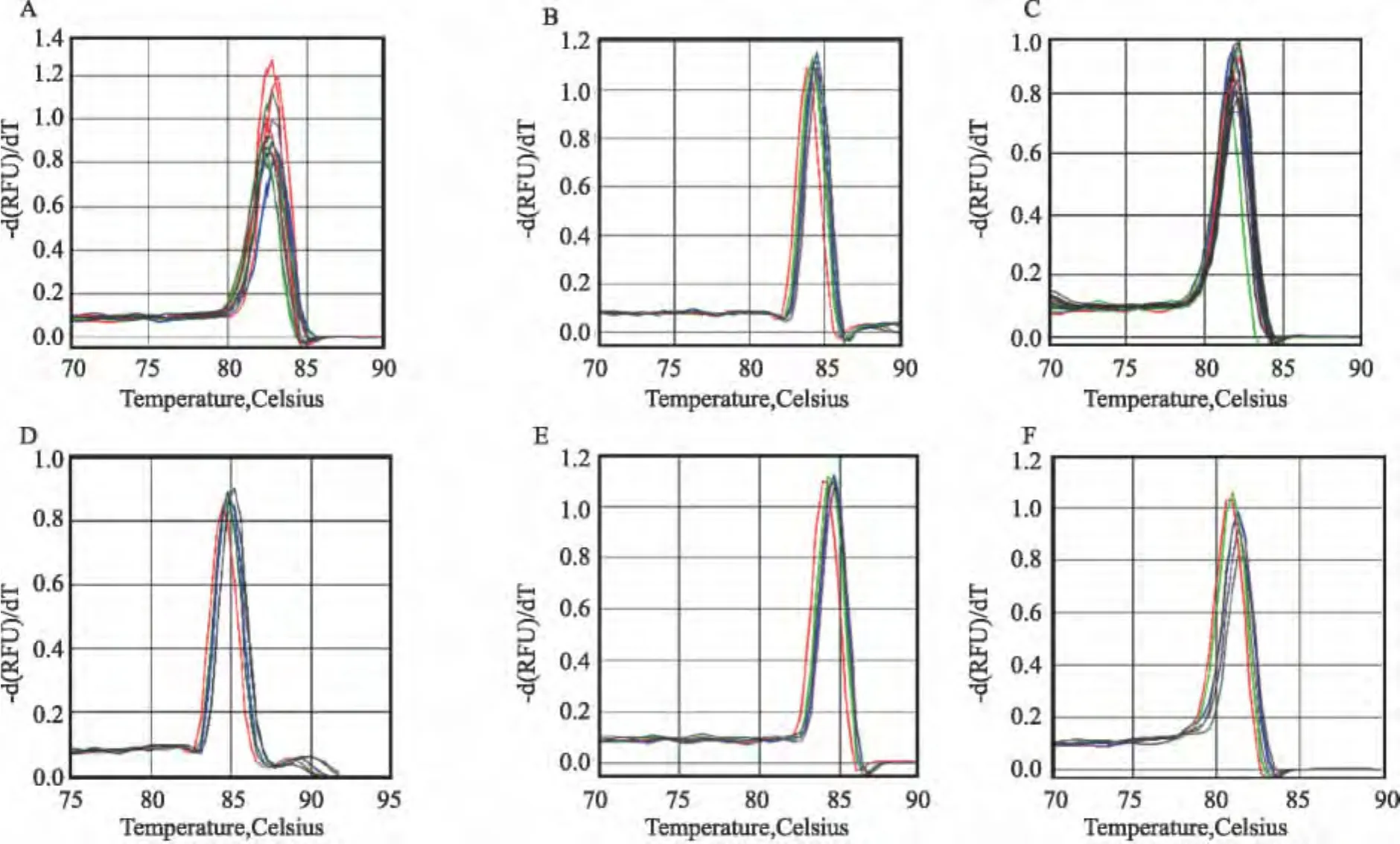
圖4 6種細菌產物的溶解曲線
人體腸道菌群在腸腔內形成3個生物層:深層的緊貼黏膜表面并與黏膜上皮細胞粘連形成細菌生物膜,該菌群稱為膜菌群,主要由雙歧桿菌和乳酸桿菌組成,這兩類菌是腸共生菌,是腸道菌中最具生理意義的兩種細菌,對機體有益無害;中層為糞桿菌、消化鏈球菌、韋榮球菌和優(yōu)桿菌等厭氧菌;表層的細菌可游動稱為腔菌群,主要是大腸埃希菌、腸球菌等好氧和兼性好氧菌。IBS患者腸道菌群包括腸腔內菌群即糞便菌群和黏膜相關菌群,目前的研究主要集中于糞便菌群,但腸道膜菌群亦在維持腸道功能中發(fā)揮重要作用,菌群與腸黏膜黏附、嵌合形成膜菌是產生腸道微生物B/E的重要因素,構成腸黏膜生物屏障,防止腸道上皮與致病菌接觸,維持腸道正常生理功能。Carroll et al[12]對10例IBS-D患者和10例健康自愿者的糞便和遠端結腸黏膜細菌進行比較,結果表明結腸黏膜上皮和腔內微生態(tài)環(huán)境有所差異。Kerckhoffs et al[13]采用PCR和變性梯度凝膠電泳法(DGGE)分析37例IBS患者和20例健康受試者的十二指腸黏膜刷片和糞便標本,結果顯示IBS患者的十二指腸黏膜刷片和糞便標本所含銅綠假單胞菌較健康受試者顯著升高。
由于腸道細菌的組成復雜,且腸道黏膜層的細菌與腸腔內和腸道細胞表面的細菌有很大不同,所以糞便菌群是否能代表結腸菌群的狀況以及腸道菌群改變與IBS的關系尚有待更深入的研究。
[1]Talley N J.Functional gastrointestinal disorders as a public health problem[J].Neurogastroenterol Motil,2008,20(Suppl1):121-9.
[2]陸再英,鐘南山,謝 毅,等.內科學[M].7版.北京:人民衛(wèi)生出版社,2008:426-7.
[3]Kanseng B,Kaldhusdal M,Rudi K.Comparison of chicken gut colonisation by the pathogensCampylobacter jejuniandClostridium perfringensby real-time quantitative PCR[J].Mol Cell Probes,2006,20(5):269-79.
[4]Rinttil T,Kassinen A,Malinen E,et al.Development of an extensive set of 16S rDNA-targeted primers for quantification of pathogenic and indigenous bacteria in faecal samples by real-time PCR[J].J Appli Microbiol,2004,97(6):1166-77.
[5]Parkes G C,Brostoff J,Whelan K,et al.Gastrointestinal microbiota in irritable bowel syndrome:their role in its pathogenesis and treatment[J].Am J Gastroenterol,2008,103(6):1557- 67.
[6]Gecse K,Róka R,Ferrier L,et al.Increased faecal serine protease activity in diarrhoeic IBS patients:a colonic lumenal factor impairing colonic permeability and sensitivity[J].Gut,2008,57(5):591-9.
[7]Tana C,Umesaki Y,Imaoka A,et al.Altered profiles of intestinal microbiota and organic acids may be the origin of symptoms in irritable bowel syndrome[J].Neurogastroenterol Motil,2010,22(5):512-9.
[8]崔舒晟,胡 穎.培菲康治療前后腸易激綜合征患者相關腸道益生菌群變化分析[J].徐州醫(yī)學院學報,2010,30(1):45-8.
[9]Carroll I M,Ringel-kulka T,siddle J P,et al.Alterations in composition and diversity of the intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome[J].Neurogastroenterol Motil,2012,24(6):521-30,e248.
[10]Krogius-Kurikka L,Lyra A,Malinen E,et al.Microbial community analysis reveals high level phylogenetic alterations in the overall gastrointestinal microbiota of diarrhoea-predominant irritable bowel syndrome sufferers[J].BMC Gastroenterol,2009,9(1):1-11.
[11]吳仲文,李蘭娟,馬偉航,等.腸道微生物定值抗力的新指標B/E 值[J].浙江預防醫(yī)學,2000,2(7):4-5.
[12]Carroll I M,Chang Y H,Park J,et al.Luminal and mucosal-associated intestinal microbiota in patients with diarrhea-predominant irritable bowel syndrome[J].Gut Pathogens,2010,2(1):19.
[13]Kerckhoffs A P,Ben-Amor K,Samsom M,et al.Molecular analysis of faecal and duodenal samples reveals significantly higher prevalence and numbers of Pseudomonas aeruginosa in irritable bowel syndrome[J].J Med Microbiol,2011,60(2):236-45.
Analysis of patients with intestinal target bacteria diarrhea type irritable bowel syndrome
Li Xiaoping,Wang Qiaomin,Chu Yuan,et al
(Dept of Gastroenterology,The Affiliated Provincial Hospital of Anhui Medical University,Hefei230001)
ObjectiveTo study on intestinal flora in diarrhea predominant irritable bowel syndrome(IBS-D)with differences between normal people.MethodsThe real-time fluorescence quantitative PCR assay was used in 50 patients with diarrhea predominant IBS and 25 normal control subjects in feces to detectBifidobacteria longum,Lactobacillus,Bacteroides,Clostridium perfringens,Escherichia coliandEnterococcus faecalisnumber.The target bacteria in the number in each group were compared,and calculated intestinal colonization resistance.Intestinal resistance value(coloniza-tion resistance,CR)was a potential aerobic intestine by intestinal pathogens in anaerobic inhibition ability of endogenous bifidobacteria value and the value as the ratio of intestinal Enterobacteriaceae micro-bial resistance value of the index,namely B/E values.ResultsCompared with the normal control group,feces of patients with diarrhea predominant IBS in numbers ofEscherichia coliand Clostridium perfringens increased significantly(P<0.05),while the number ofLactobacillusandBifidobacteriadecreased significantly(P<0.05),no statistically significant difference between the two groups inEnterococcus faecalisandBacteroides fragilis.Patients with intestinal diarrhea predominant IBS constant force B/E <1,compared with the control group decreased significantly(P<0.05).ConclusionDiarrhea predominant IBS patients of intestinal flora balance is broken,for gut setting value is reduced,and the feces ofEscherichia coliandClostridium perfringensincrease in number,number ofBifidobacterium,Lactobacillusdecreased.
irritable bowel syndrome;intestinal flora;real-time fluorescence quantitative PCR
R 574.4
A
1000-1492(2014)05-0653-06
2013-12-12接收
安徽省衛(wèi)生廳醫(yī)學科研課題(編號:13zc031)
安徽醫(yī)科大學附屬省立醫(yī)院1消化內科、2檢驗科,合肥230001
李小萍,女,碩士研究生;
王巧民,女,教授,主任醫(yī)師,碩士生導師,責任作者,E-mail:wqmin928@163.com

