巰嘌呤甲基轉移酶基因多態性對成人急性淋巴細胞白血病6-MP治療個體化的意義
葛 健,夏瑞祥,楊明珍,夏海龍,王永慶,曾慶曙
巰嘌呤甲基轉移酶基因多態性對成人急性淋巴細胞白血病6-MP治療個體化的意義
葛 健,夏瑞祥,楊明珍,夏海龍,王永慶,曾慶曙
目的 檢測使用6-巰基嘌呤(6-MP)維持治療的成人急性淋巴細胞白血病(ALL)患者巰嘌呤甲基轉移酶(TPMT)基因型和酶活性,并應用至臨床以指導6-MP維持治療。方法 提取白細胞基因組DNA,以PCR結合限制性片斷長度多態性(PCR-RFLP)等技術檢測TPMT基因型;以高效液相色譜法(HPLC)檢測TPMT酶活性,對使用6-MP和甲氨蝶呤(MTX)維持化療的69例成人ALL患者,監測化療藥物的臨床和血液學毒性。結果 69例成人ALL患者中有4例酶活性較低的TPMT*1/*3C雜合子,未發現TPMT*2、TPMT*3A、TPMT*3B。成人ALL患者使用6-MP治療后,TPMT酶活性較治療前上升。TPMT突變型組與野生型組觀察到的臨床藥物毒性反應相近,但前者維持治療期間6-MP的使用量明顯低于后者[42.17 mg/(m2·d)和69.36 mg/(m2·d),P<0.01]。結論 TPMT基因多態性對6-MP治療的藥物毒性有實質性影響。成人ALL患者使用6-MP治療前監測TPMT基因型和活性,有助于減少6-MP藥物不良反應,實現臨床治療個體化。
巰嘌呤甲基轉移酶;急性淋巴細胞白血病;6-巰嘌呤;基因多態性;維持治療
夏瑞祥,男,教授,主任醫師,博士生導師,責任作者,E-mail:xrx2041@163.com
6-巰基嘌呤(6-mercaptopurine,6-MP)是成人急性淋巴細胞白血病(acute lymphoblastic leukemia,ALL)維持治療中廣泛應用的巰嘌呤類藥物,在體內經過代謝轉變為巰嘌呤核苷酸(thioguanine nucleotides,TGNs),通過后者產生細胞毒作用;巰嘌呤甲基轉移酶(thiopurine S-methyltransferase,TPMT)是一種通過催化6-巰嘌呤S-甲基化、減少TGNs生成的胞質酶[1]。TPMT存在基因多態性,目前發現有24種和TPMT酶活性降低相關的突變型等位基因,最重要的4 種TPMT*2、TPMT*3A、TPMT*3B、TPMT*3C涵蓋了人群中95%的低及中等活性[2]。中國漢族人也存在TPMT基因多態性,TPMT*3C是其最主要的突變型等位基因[3]。TPMT缺乏(或低活性)的兒童ALL患者因紅細胞內TGNs濃度過高而對標準劑量6-MP不耐受[1]。該研究旨在探討漢族成人ALL患者進行6-MP治療時的耐受性,以及在6-MP治療前進行TPMT活性和基因型檢測對化療個體化的臨床意義。
1 材料與方法
1.1 病例資料 ALL患者來自安徽醫科大學第一附屬醫院血液內科,均為漢族,年齡均>18歲,經細胞形態學、免疫學和細胞遺傳學(MIC)分析明確診斷。初診成人ALL患者以DVP(或IVP)方案誘導化療,達完全緩解后,對于沒有合適供者無法行造血干細胞移植的患者,予以強化治療[方案1:大劑量甲氨蝶呤(HD-MTX)+VM26 與 VM26+Ara-c+NVT兩者交替進行共6療程;方案2:HyperCVAD/MA方案6療程]。強化治療間歇期及強化治療后,予以標準劑量6-MP每日75 mg/m2和MTX每周20 mg/m2聯合口服維持治療。最初入選90例,最終在維持治療期間接受試驗觀察的患者共69例(患者均知情同意,并堅持維持治療至少6個月)。另有12例患者6個月內疾病復發,9例患者選擇臍血干細胞移植或其他治療方案退出觀察。
1.2 儀器與試劑 蛋白酶K購自德國MERCK公司;TaqDNA聚合酶以及dNTPs購自上海華美生物工程公司;限制性內切酶AccⅠ購自大連寶生物公司;MwoⅠ購自美國NEB公司;常用化學試劑均為國產分析純級別;600E高效液相色譜儀、2996 PAD紫外檢測器、Empower Pro色譜數據工作站(美國Waters公司)。
1.3 DNA提取和TPMT基因型檢測 從肝素抗凝的成人ALL患者外周血分離單個核細胞,余紅細胞裂解凍存,采用酚/氯仿抽提法提取成人ALL患者基因組 DNA。采用等位基因特異性 PCR(ASPCR)和PCR結合限制性片斷長度多態性(PCRRFLP)技術對接受試驗觀察的成人ALL患者TPMT*2(G238C)、TPMT*3A(G460A/A719G)、TPMT*3B(G460A)和TPMT*3C(A719G)的等位基因頻率進行分析,具體步驟參照之前的研究[3]。
1.4 TPMT活性檢測 應用前期建立的HPLC方法[4],檢測成人ALL患者初次接受化療前外周血紅細胞中TPMT的活性。具體是將6-MP加入紅細胞裂解液中,利用 S-腺苷-L-甲硫氨酸提供甲基,經過孵育,6-MP 轉化為 6-甲基巰基嘌呤(6-methylmercatopurine,6-MeMP)。以高效液相色譜法(HPLC)檢測6-MeMP生成量。TPMT的活性(U/ml PRBC)用37℃孵育時,每毫升紅細胞每小時生成的6-MeMP量(nmol)來計算。為研究維持治療前后TPMT活性的變化,隨機選取30例患者,檢測其治療前與治療開始后(6-MP維持治療2周之后)血紅細胞中TPMT的活性。
1.5 維持治療期間藥物劑量調整方案及藥物毒性觀察指標
1.5.1 基因型指導6-MP起始用量 進行維持治療的成人ALL患者以TPMT基因型指導6-MP起始用量,具體為:TPMT野生型使用足量(75 mg/m2)起始,純合子突變型使用10%起始量(7.5 mg/m2),雜合子突變型使用50%起始量(37.5 mg/m2)。
1.5.2 白細胞計數指導6-MP劑量調整 維持治療在強化治療間歇期及強化治療后進行,治療過程中6-MP用量參照白細胞、中性粒細胞計數調整。每2周檢測1次血常規,以了解是否發生骨髓抑制,并予以調整6-MP劑量,保持白細胞計數(total leukocyte count,TLC)在(2.0~3.0)×109/L范圍,中性粒細胞絕對數(absolute neutrophil count,ANC)在(1.0~1.5)×109/L范圍。強化治療需等粒細胞計數恢復后進行。藥物劑量調整方案如下:①當外周血TLC<2.0×109/L(ANC <1.0×109/L),減少維持藥物總量的50%。②當外周血TLC<1.0×109/L(ANC <0.5×109/L)時,暫停維持治療。等待TLC/ANC恢復正常時,再次給予6-MP治療(以總藥量的50%、75%、100%的給藥過程逐周遞增),根據TLC/ANC調整6-MP至合適劑量。③ 如出現血小板(PLT)<50×109/L、黏膜炎、發熱或肝毒性≥Ⅱ度等其他毒性反應時,予減量或暫停維持化療。④ 足量使用6-MP(75 mg/m2)后,如 TLC>3.0×109/L,不予增量使用。⑤ 除非前述嚴重藥物毒性導致維持治療停止,MTX劑量維持不變。
1.5.3 藥物毒性觀察指標 患者維持治療過程中觀察和記錄以下指標進行分析:血常規(TLC/ANC/Hb/PLT)與生化指標(肝、腎功能);藥物毒副反應評價參考抗癌藥物不良反應的WHO分度標準(如黏膜炎、藥物性發熱、骨髓抑制等);TPMT基因型;6-MP和MTX藥物劑量。其中,每位患者的6-MP處方劑量的均數被定義為治療期間每平方米體表面積藥物劑量的總和除以總的維持化療的天數。隨后,各組患者使用6-MP劑量的均數得以計算。
1.6 統計學處理 使用SPSS 13.0軟件進行數據分析,計量資料以±s表示,組間比較采用t檢驗;兩種基因型之間的定性資料比較采用χ2檢驗。
2 結果
2.1 成人ALL患者TPMT基因型 對接受觀察的69例成人ALL患者進行TPMT*1(野生型)、TPMT*2、TPMT*3(A-C)檢測,共檢測到 TPMT*3C突變型(A719G)雜合子(TPMT*1/*3C)4例(圖1所示擴增產物長373 bp,被AccⅠ酶切后得到373、283、90 bp 3個片段),余65例為野生型純合子(TPMT*1/*1),未發現TPMT*3C純合子(TPMT*3C/*3C)、TPMT*2、TPMT*3A 和 TPMT*3B。
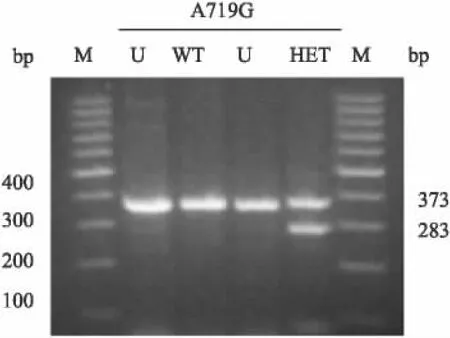
圖1 TPMT*3C突變型雜合子電泳分析結果
2.2 成人ALL患者初次診斷時TPMT活性 4例TPMT*3C雜合子(TPMT*1/*3C)ALL患者TPMT平均酶活性為(7.25±1.22)U/ml PRBC,而65例野生型TPMT基因純合子(TPMT*1/*1)ALL患者平均活性為(13.40±2.57)U/ml PRBC。TPMT*1/*3C成人ALL患者TPMT平均酶活性低于TPMT*1/*1患者(P<0.01)。見圖2。
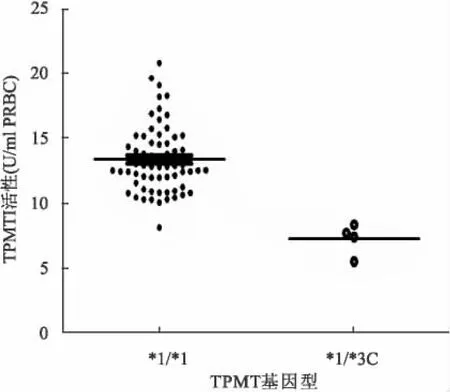
圖2 不同基因型ALL患者TPMT活性
2.3 成人ALL患者6-MP維持治療前后TPMT活性變化 隨機抽取的30例成人ALL患者未治療前(初次診斷)TPMT平均活性為(13.59±2.56)U/ml PRBC;服用6-MP等藥物維持治療開始后2周TPMT平均活性為(16.81±3.19)U/ml PRBC。成人ALL患者使用6-MP維持治療后TPMT平均酶活性高于治療前(P<0.01)。
2.4 維持治療中6-MP劑量個體化調整及毒性觀察 對TPMT*3C雜合子組的4例成人ALL患者,僅給予50%劑量6-MP起始維持治療2周后,均出現不同程度骨髓抑制(發生率100%,表現為外周血TLC、ANC減少)。其中1例發生粒細胞缺乏合并肺部感染,減量至停用6-MP。血象恢復后再次按藥物劑量調整方案先使用50%劑量6-MP治療,仍因迅速發生嚴重血液學毒性無法耐受停藥,后經調整僅能耐受20%劑量6-MP維持治療;余3例患者可耐受50%劑量6-MP,按藥物調整方案加量至100%量6-MP治療,但均因血液學毒性無法耐受100%量,再次減至50%劑量維持治療。65例使用100%量6-MP起始維持治療的TPMT*1純合子組ALL患者中,20例出現骨髓抑制(發生率30.8%),其中有7例無法耐受足量6-MP治療,根據白細胞計數調整為50%量后長期維持治療。兩組患者能夠耐受100%足量6-MP化療的人數有明顯差異(P<0.01),見表1。治療中MTX始終予以足量。兩組患者維持治療中TLC及ANC均數無明顯差異(P>0.05),見表1。兩組TLC及ANC平均數均高于方案設計時的骨髓抑制目標[維持TLC在(2.0~3.0)×109/L;ANC在(1.0~1.5)×109/L]。但TPMT*3C雜合子組患者6-MP維持治療平均劑量[42.17±5.92 mg/(m2·d)]明顯低于TPMT*1純合子組[(69.36±10.57)mg/(m2·d)](P<0.01),見表1。
對兩組患者維持治療期間的其它常見化療藥物毒副反應(如感染、肝損、藥物性發熱、黏膜炎、嘔吐及腹瀉等)發生率進行觀察,差異均無統計學意義(P>0.05),見表1。
表1 成人ALL患者維持治療中臨床資料比較(±s)
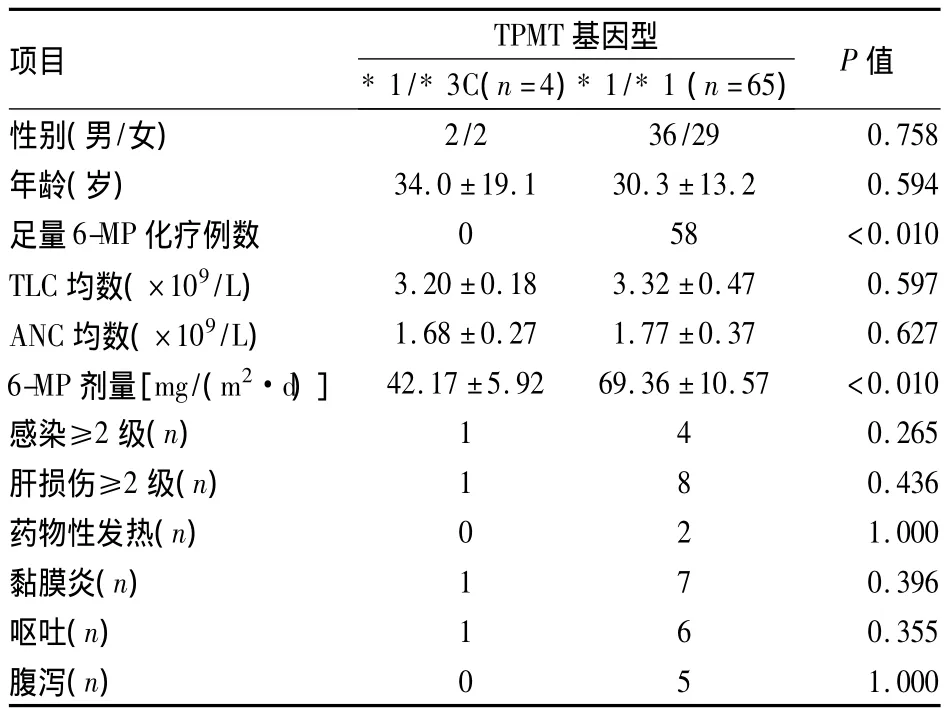
表1 成人ALL患者維持治療中臨床資料比較(±s)
TPMT項目 基因型*1/*3C(n=4)*1/*1(n=65)P值2/2 36/29 0.758年齡(歲) 34.0±19.1 30.3±13.2 0.594足量6-MP化療例數 0 58 <0.010 TLC均數(×109/L) 3.20±0.18 3.32±0.47 0.597 ANC均數(×109/L) 1.68±0.27 1.77±0.37 0.627 6-MP劑量[mg/(m2·d)]42.17±5.92 69.36±10.57 <0.010感染≥2級(n) 1 4 0.265肝損傷≥2級(n) 1 8 0.436藥物性發熱(n) 0 2 1.000黏膜炎(n) 1 7 0.396嘔吐(n) 1 6 0.355腹瀉(n)性別(男/女)0 5 1.000
3 討論
6-MP和硫唑嘌呤等巰嘌呤類藥物一直用于治療ALL、自身免疫性疾病和器官移植受者。6-MP和硫唑嘌呤均為無活性的藥物前體,須在體內代謝為TGNs,以發揮細胞毒性。6-MP的另一重要代謝途徑是由TPMT催化的甲基化反應合成無活性的6-MeMP,這一途徑減少了 TGNs的合成[5]。TPMT 存在遺傳多態性,至少發現24種突變型等位基因和TPMT酶活性降低相關[2-3]。個體如存在2個突變型等位基因會出現TPMT酶活性缺失,人群中約10%因存在一種突變型雜合子而導致TPMT酶活性降低[3]。研究[1]顯示TPMT缺失的患者服用標準劑量6-MP后,因為生成過多TGNs導致嚴重的血液學毒性,這些患者僅需使用6-MP標準劑量的1/10進行治療。
對于中等TPMT酶活性的突變型雜合子患者,使用6-MP維持治療是否需要調整起始藥物劑量,之前尚無研究論證。本研究和之前的研究[3]顯示中國健康漢族人也存在TPMT基因多態性,TPMT*3C雜合子突變(TPMT*1/*3C)是中國健康漢族人和成人ALL患者最主要的突變型等位基因。本研究顯示TPMT*1/*3C成人ALL患者TPMT酶活性低于TPMT*1/*1,提示TPMT*1/*3C患者酶活性和基因型具有相關性。TPMT*1/*3C組患者在使用了50%起始量6-MP作為起始維持化療量后,仍出現明顯骨髓抑制。且TPMT*1/*3C組能夠耐受的6-MP維持治療平均劑量明顯低于TPMT*1/*1組,這提示雜合子成人ALL患者較野生型更不耐受6-MP毒性而難以完成標準劑量化療。這與 Vannaprasaht et al[6]的研究一致,該研究報道TPMT*1/*3C雜合子突變型的腎移植患者,使用硫唑嘌呤治療導致骨髓抑制的風險明顯高于野生型患者。本研究顯示,成人ALL患者在開始6-MP維持治療前均需檢測TPMT基因型,根據基因型調整6-MP起始用藥劑量會減少臨床治療過程中藥物毒副反應。
本研究中,6-MP后續維持治療劑量是根據血常規檢測中TLC/ANC數據進行調整,期望達到輕度骨髓抑制。最終兩組TLC及ANC平均數均高于方案設計時的骨髓抑制目標,可能因為臨床醫師在維持治療門診給藥中盡力避免粒細胞嚴重減少和感染。兩組患者治療過程中TLC/ANC平均數相近,這解釋了兩組患者(除初始血液學毒性外)其他化療藥物毒副反應發生率相近的原因,也使得可以比較兩組對于6-MP用量的耐受性。TPMT*1/*3C組能夠耐受的6-MP平均劑量[42.17 mg/(m2·d)]遠遠低于TPMT*1/*1組[69.36 mg/(m2·d),P<0.01],提示雜合子突變組使用較低的藥物劑量也可達到野生型組骨髓抑制程度,也印證了藥物基因組學研究和應用在現代化療中的意義。
Fakhoury et al[7]發現,兒童 ALL 患者 TPMT 酶活性在維持治療開始后會較治療前明顯上升。本研究顯示,成人ALL患者TPMT酶活性在初次診斷時與基因型存在相關性,而在6-MP維持治療后較前上升。Lennard et al[8]研究認為ALL患者經過誘導緩解化療后的造血恢復過程,造血生成更多相對“年輕”的紅細胞;后者TPMT酶活性比“成熟”的紅細胞高。患者在化療過程中的輸血治療也會對TPMT 活性有影響。而 Wennerstrand et al[9]的研究認為,大劑量的 MTX通過蛋白結合過程,會使TPMT酶活性短期內迅速降低。正因為TPMT活性在6-MP治療前后會發生變化,應以治療前TPMT酶活性結果判斷6-MP可能的不良反應。
與檢測患者TPMT基因型比較,酶活性的檢測過程復雜,花費較大,且酶活性易受多種因素干擾發生變化。在本研究中,ALL患者初次診斷時簡單的基因型檢測能夠可靠的預知酶活性。因此,對于成人ALL患者使用6-MP維持治療,推薦以初次治療前的基因型結果制定起始6-MP治療的用量,結合6-MP治療后藥物毒性監測結果調整后續用量,以期達到治療用藥個體化。
[1]Relling M V,Gardner E E,Sandborn W J,et al.Clinical Pharmacogenetics Implementation Consortium guidelines for thiopurine methyltransferase genotype and thiopurine dosing[J].Clin Pharmacol Ther,2011,89(3):387-91.
[2]Albayrak M,Konyssova U,Kaya Z,et al.Thiopurine methyltransferase polymorphisms and mercaptopurine tolerance in Turkish children with acute lymphoblastic leukemia[J].Cancer Chemother Pharmacol,2011,68(5):1155-9.
[3]葛 健,夏瑞祥,卜麗佳,等.成人急性淋巴細胞白血病巰嘌呤甲基轉移酶基因多態性研究[J].安徽醫科大學學報,2006,41(2):185-8.
[4]葛 健,夏瑞祥,曾慶曙,等.高效液相色譜法測定急性淋巴細胞白血病患者巰嘌呤甲基轉移酶活性[J].中國醫院藥學雜志,2006,26(5):520-2.
[5]Adam de Beaumais T,Fakhoury M,Medard Y,et al.Determinants of mercaptopurine toxicity in paediatric acute lymphoblastic leukemia maintenance therapy[J].Br J Clin Pharmacol,2011,71(4):575-84.
[6]Vannaprasaht S,Angsuthum S,Avihingsanon Y,et al.Impact of the heterozygous TPMT*1/*3C genotype on azathioprine-induced myelosuppression in kidney transplant recipients in Thailand[J].Clin Ther,2009,31(7):1524- 33.
[7]Fakhoury M,Andreu-Gallien J,Mahr A,et al.Should TPMT genotype and activity be used to monitor 6-mercaptopurine treatment in children with acute lymphoblastic leukaemia?[J].J Clin Pharm Ther,2007,32(6):633-9.
[8]Lennard L,Cartwright C S,Wade R,et al.Thiopurine methyltransferase genotype-phenotype discordance and thiopurine active metabolite formation in childhood acute lymphoblastic leukaemia[J].Br J Clin Pharmacol,2013,76(1):125- 36.
[9]Wennerstrand P,M?rtensson L G,S?derh?ll S,et al.Methotrexate binds to recombinant thiopurine S-methyltransferase and inhibits enzyme activity after high-dose infusions in childhood leukaemia[J].Eur J Clin Pharmacol,2013,69(9):1641- 9.
Significance of TPMT gene polymorphism for individualizing 6-MP chemotherapy in adults with acute lymphoblastic leukemia
Ge Jian,Xia Ruixiang,Yang Mingzhen,et al
(Dept of Hematology,The First Affiliated Hospital of Anhui Medical University,Hefei230022)
ObjectiveTo observe thiopurine S-methyltransferase(TPMT)genotype and phenotype in adult patients with acute lymphoblastic leukemia(ALL)who had been given maintenance treatment with 6-mercaptopurine(6-MP)and to assess their clinical management for individualizing 6-MP chemotherapy.MethodsGenomic DNA was extracted from peripheral blood leukocytes.PCR-restriction fragment length polymorphism(RFLP)technique was used to determine the TPMT genotype.TPMT activity was quantitated by reversed-phase high-performance liquid chromatography(HPLC)assay.Clinical and hematological toxicities were detected during the first 6 months of maintenance therapy with oral 6-MP and methotrexate(MTX)in the 69 adults with ALL.ResultsThe heterozygous TPMT*1/*3C genotype with low activity was found in 4 of the 69 adults with ALL;TPMT*2,TPMT*3A and TPMT*3B were not.We found a higher TPMT activity during maintenance treatment with 6-MP than at diagnosis.The median 6-mercaptopurine dose administered during the maintenance therapy was lower among patients with heterozygous TPMT alleles versus the rest[2.17 mg/(m2·d)and 69.36 mg/(m2·d),P<0.01],though the clinical toxicities were similar in both groups.ConclusionTPMT gene polymorphism has a substantial impact on mercaptopurine toxicity.Identification of TPMT genotype and activity appears to be important in making the ALL treatment less toxic and individualizing 6-MP chemotherapy.
thiopurine methyltransferase;acute lymphocytic leukemia;6-mercatopurine;genetic polymorphism;main tenance treatment
R 733.71;R 979.1;R 394.6
A
1000-1492(2014)05-0665-05
2013-12-20接收
國家自然科學基金(編號:81200371);高等學校博士學科點專項科研基金聯合資助課題(新教師類聯合,編號:20123420120011);安徽省自然科學基金(編號:1208085QH154、1308085MH157)
安徽醫科大學第一附屬醫院血液內科,合肥 230022
葛 健,男,博士,副主任醫師;

