西妥昔單抗聯合塞來昔布對肺腺癌細胞KDR和AQP1表達的影響
陳 明 劉鳳華
(滄州市運河區醫院外科,河北 唐山 063000)
肺癌治療失敗和死亡的主要原因肺癌的侵襲和轉移,新生血管的生成在肺癌的侵襲和轉移中起著極其重要的作用〔1,2〕。近年來研究表明水通道蛋白1(AQP1)和血管內皮生長因子受體Ⅱ激酶功能區受體(VEGFR2/KDR)在許多腫瘤及其血管內皮細胞均有表達升高,在促進血管生成和腫瘤細胞增殖中起著關鍵作用〔3~6〕。本研究觀察西妥昔單抗、塞來昔布單獨及聯用時體外對肺腺癌A549細胞增殖和凋亡及KDR、AQP1基因和蛋白表達的影響。
1 材料與方法
1.1主要試劑和儀器 肺腺癌細胞株A549購自中國科學院上海細胞究所。RPMI 1640培養液、胎牛血清和胰蛋白酶均購自美國Gibco公司。塞來昔布(江蘇恒瑞制藥有限公司),西妥昔單抗(德國默克公司),青霉素(100 U/ml) (北京化工廠),鏈霉素(100 U/ml) (Peprotech),5%四甲基偶氮唑鹽(MTT 溶液,上海華美生物工程公司);流式細胞儀(COULTER XL;Coulter);550酶標儀(美國Biorad公司),生物倒置顯微鏡(Olympus CKX4)。
1.2細胞培養和實驗分組 肺腺癌細胞株A549培養在含10%胎牛血清的RPMI 1640培養液中,置飽和濕度5% CO2,37℃恒溫培養箱中培養。細胞以1×106/100 ml培養瓶,常規培養24 h后如下分組進行藥物處理,實驗分為對照組(PBS液1 ml處理組)、西妥昔單抗1 nmol/L組、塞來昔布25 μmol/L組、西妥昔單抗1 nmol/L+塞來昔布25 μmol/L組,藥物濃度見參考文獻〔7,8〕。
1.3MTT比色實驗 在96孔板上按5×104個/孔接種A549細胞,如1.2分組,每組設三個平行重復孔,置于37℃、5% CO2的培養箱中培養48 h后,棄去培養液,生理鹽水漂洗一遍,每孔加MTT 20 μl(濃度為5 mg/ml),放置孵箱內4 h后棄上清加入10%的十二烷基磺酸鈉(SDS)200 μl,過夜。震蕩15 min,用全自動酶標儀(美國Biorad公司)檢測570 nm處的吸光度值(A值)。抑制率(%)=(A對照-A實驗)/(A對照-A空白)×100%。
1.4流式細胞儀檢測細胞周期 收集如1.2分組的不同處理組細胞,調整細胞濃度為1×106/L,冷PBS洗滌2次,加入70%的冷乙醇(4℃) 固定24 h。洗滌細胞,與含10 μg/ml RNA 酶的Tris-Hcl緩沖液(pH7.4) 共同孵育30 min。50 μg/ml 碘化丙啶(PI)進行細胞DNA 染色,1 h內通過流式細胞儀分析細胞DNA含量分布,計算出各個周期細胞的百分率。
1.5Transwell小室侵襲實驗 在聚碳酸酯微孔濾膜上鋪Matrigel 50 μg/孔,在聚合好的小室下室加入10%的胎牛血清做條件培養液,在上室加入按如1.2分組處理過的A549細胞懸液100 μl(細胞總數為3×105/L),置于培養箱中20 h后取出,用濕棉簽仔細擦掉上室中未穿過的瘤細胞,95%的乙醇固定5 min,PBS輕輕漂洗三遍,進行HE染色,自然晾干,將上室的聚碳酸酯濾膜沿邊緣用手術刀片小心取下,用樹脂膠固定于玻片上(膜內面朝上),封片;高倍顯微鏡下記數穿膜的A549細胞數,每膜記數上、下、左、右、中5個視野的侵襲細胞數,計算平均值,每組設三個濾膜。
1.6RT-PCR 將各組處理后的細胞懸液分別經離心半徑16 cm,800 r/min,離心5 min,收集細胞,棄去上清后置于1 ml勻漿器中,加入1 ml Trizol試劑后研磨(冰盒上操作)。進行RT-PCR分析。采用Trizol(Takara公司)試劑說明書介紹的方法提取組織總RNA,紫外分光光度計測定RNA含量,利用 以總RNA 為模板、Oligo(dT) 為引物,應用RT-PCR兩步法試劑盒(TaKaRa公司)將mRNA逆轉錄成cDNA,反應參數:30℃,10 min→2℃,30 min→99℃,5 min→5℃,5 min。所得cDNA-20℃保存。以反轉錄所得cDNA為模板,相關引物序列見(表1)。上游引物0.5 μl、下游引物0.5 μl,40 μl體系。擴增參數:94℃,2 min,→(94℃,30 s→55℃,30 s→72℃,30 s)×45循環→72℃,5 min。取PCR產物經瓊脂糖電泳后用FR200圖像分析系統分析。

表1 引物序列
1.7Western印跡 在RT-PCR提取后剩余物中,加入適量裂解液及蛋白酶抑制劑,4℃ 、以1 500 r/min 離心30 min,取上清液。用考馬斯亮藍法測定蛋白含量后。將5%濃縮膠40 V衡壓1 h,10%分離膠60 V恒壓3.5 h,濕轉14 V恒壓14 h,37℃搖床封閉2 h,洗膜10 min,3次,轉印后加入一抗:KDR多克隆抗體(1∶1 000)或AQP1多克隆抗體4℃過夜(1∶1 000);抗鼠β-actin(1∶5 000)4℃過夜。次日加入二抗山羊抗兔抗體(1∶700),37℃搖床孵育1.5 h,TTBS洗3次×5 min,TBS液洗3次×5 min。將硝酸纖維素膜用發光液(Pierce,A、B各100 ml)充分潤濕后作用5 min,保鮮膜覆蓋,置暗盒中曝光5 min。顯影、水洗、定影后觀察結果,Quantity one圖像分析。目的條帶灰度值除以β-actin灰度值進行結果分析。
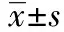
2 結 果
2.1細胞形態學觀察 肺腺癌A549細胞在光學顯微鏡觀察,可見細胞生長旺盛,分布密集,大多呈多角形,細胞走向趨于一致,多角形細胞的胞體飽滿、有2~3個扁平而長的突起,細胞核較大,呈卵圓形且多居中(圖1)。

圖1 A549細胞光學顯微鏡下形態(×200)
2.2各組A549細胞經處理后的OD490值 西妥昔單抗+塞來昔布組抑制率明顯高于單用藥組(P均<0.05),說明兩者聯合作用具有協同效應。見表2。

表2 西妥藥單和塞米昔布抑制A549細胞后的OD490值
2.3流式細胞術測定細胞周期分布 G1期細胞用藥明顯多于對照組(P<0.05),西妥昔單抗+塞來昔布組明顯多于西妥西單抗和塞來昔布組,而S期細胞相應減少,差異有顯著性(P<0.05),M期細胞無明顯變化,表明兩藥聯用的效果優于單獨用藥。見表3。

表3 西妥藥單和塞米昔布對A549細胞周期的影響
2.4A549細胞體外侵襲力的變化 對照組A549細胞穿過濾膜的細胞數量較多(107.54±10.14),西妥昔單抗組、塞米昔布組穿膜細胞數明顯減少(75.65±7.84,77.73±9.89),西妥昔單抗+塞來昔布組穿膜細胞數最少(46.24±5.37)。表明西妥昔單抗+塞來昔布組兩藥聯用能更有效地降低A549細胞的侵襲力。見圖2。

圖2 不同處理組處理后A549細胞侵襲能力的影響(×200)
2.5AQP1、KDR mRNA及蛋白表達 經過相關處理后,AQP1 mRNA、KDR mRNA及蛋白在西妥昔單抗+塞來昔布組表達量較西妥昔單抗組、塞來昔布組降低(P<0.05)。用藥組較對照組顯著降低(P<0.05),見圖3,表4。


1~4:對照組、西妥昔單抗組、塞米昔布組、西妥昔單抗+塞來昔布組

表4 AQP1 、 KDR mRNA蛋白在各組表達量
3 討 論
肺癌是一種臨床常見的肺部惡性腫瘤,其死亡率已占癌癥死亡率之首,可分為小細胞肺癌和非小細胞肺癌,其中非小細胞肺癌占了到肺癌的85%以上。肺癌的侵襲和轉移是肺癌患者治療失敗和死亡的主要原因。而腫瘤血管的生成在腫瘤的浸潤和轉移過程中起著至關重要的作用〔9〕。因為腫瘤的持續生長必須依賴新生血管生成,大量的新生血管形成是體積>2 mm3的腫瘤繼續生長不可缺少的因素,沒有足夠的新生血管提供充足的養分,腫瘤的生長潛能將嚴格受到限制〔10,11〕。
近年來的研究表明KDR及AQP1與腫瘤血管生成關系密切,不僅在血管內皮細胞表達KDR及AQP1,而且腫瘤細胞亦能表達〔12,13〕。其中AQP1是腫瘤血管生成的一種新的促進因子,被認為是血管增生的一種標記物。目前大量研究表明許多腫瘤組織、癌細胞系及微血管內皮細胞中AQP1 呈高度表達〔14,15〕,并且其表達量與腫瘤惡性程度有直接關系,惡性程度越高,AQP1 表達量越高〔16〕,提示應用AQP的抑制劑或抗AQP抗體降低AQP1的表達將會是新的治療肺腺癌手段。KDR也是腫瘤血管生成過程中主要的調控因子之一〔17〕。腫瘤細胞分泌VEGF,除了以旁分泌的形式作用于血管內皮上的KDR,促進血管形成外,還以自分泌的方式作用于自身細胞上的KDR,直接促進腫瘤細胞生長。另外研究發現阻斷KDR表達可誘導腫瘤細胞凋亡。因此,抑制KDR表達,不僅可抑制腫瘤血管生成,而且也可阻止腫瘤細胞的生長從而阻斷肺癌的生長和轉移。故以KDR為靶點抑制血管生成進而控制腫瘤生長,對腫瘤治療和防止腫瘤遠處轉移也有重要意義。
近年來研究表明,選擇性環氧化酶(COX)-2抑制劑塞來昔布對多種腫瘤細胞有抑制增殖、誘導分化、促進凋亡作用〔18〕;西妥昔單抗是一種腫瘤分子靶向藥物,也廣泛應用于基礎和臨床研究〔19〕。本實驗將兩者聯合應用于于A549細胞的體外培養,研究發現在A549細胞系的體外作用中,西妥昔單抗和塞來昔布都具有一定的抑瘤效應,聯合應用時,二者具有明顯的協同效應,可進一步抑制細胞的生長和遷移。西妥昔單抗和塞來昔布單藥作用于A549細胞能夠明顯降低AQP1 和KDR基因和蛋白的表達水平,兩藥聯合時降低AQP1 和KDR基因和蛋白表達的作用更加明顯,提示降低AQP1 和KDR基因和蛋白的表達可能是兩者協同作用的分子機制之一。故將西妥昔單抗和塞來昔布聯合應用于肺腺癌的治療,能夠為臨床提供有益思路。
4 參考文獻
1Donnem T,Andersen S,Al-Saad S,etal.Prognostic impact of angiogenic markers in non-small-cell lung cancer is related to tumor Size〔J〕.Clin Lung Cancer,2011;12(2):106-15.
2Kim J,Koyanagi T,Mochly-Rosen D.PKCδ activation mediates angiogenesis via NADPH oxidase activity in PC-3 prostate cancer cells〔J〕.Prostate,2011;71(9):946-54.
3Wang D,Owler BK.Expression of AQP1 and AQP4 in paediatric brain tumours〔J〕.J Clin Neurosci,2011;18(1):122-7.
4Jiang Y.Aquaporin-1 activity of plasma membrane affects HT20 colon cancer cell migration〔J〕.IUBMB Life,2009;61(10):1001-9.
5Gershtein ES,Dubova EA,Shchegolev AI,etal.Vascular endothelial growth factor and its type 2 receptor in hepatocellular carcinoma〔J〕.Bull Exp Biol Med,2010;149(6):749-52.
6Waldner MJ,Wirtz S,Jefremow A,etal.VEGF receptor signaling links inflammation and tumorigenesis in colitis-associated cancer〔J〕.J Exp Med,2010;207(13):2855-68.
7陳智偉,虞永峰,李子明,等.吉非替尼和西妥昔單抗聯合治療非小細胞肺癌的體外實驗研究〔J〕.中國癌癥雜志,2010;20(4):275-80.
8王亞麗,牟曉燕,白小燕,等.吉非替尼聯合塞來昔布對肺腺癌細胞凋亡和EGFR、COX-2表達的影響〔J〕.山東大學學報(醫學版),2009;47(8):37-41.
9Hada MM,Horiuchi T.A case report of chemotherapy with thalidomide,celecoxib and gemcitabine in the treatment of patients with brain metastases〔J〕.J Clin Oncol,2005;33(10):1021-6.
10Siemann DW,Chaplin DJ,Horsman MR.Vascular-targeting therapies for treatment of malignant disease〔J〕.Cancer,2004;100(12):2491-9.
11Folkman J.Antiangiogenesis in cancer therapy-endostatin and its mechanisms of action〔J〕.Expt Cell Res,2006;312(5):594-607.
12Li Q,Zhang B.Expression of aquaporin-1 in nasopharyngeal cancer tissues〔J〕.J Otolaryngol Head Neck Surg,2010;39(5):511-5.
13F?rkkil? A,Anttonen M,Pociuviene J.Vascular endothelial growth factor(VEGF) and its receptor VEGFR-2 are highly expressed in ovarian granulosa cell tumors〔J〕.Eur J Endocrinol,2011;164(1):115-22.
14劉彥賓,呂 智,郭貴明.AQP1在骨肉瘤中的表達和意義〔J〕.中國骨腫瘤骨病,2008;7(3):142-5.
15牛文斌,王春玲,秦迎春,等.TSP1與AQP1在前列腺癌中的表達及與血管生成的關系〔J〕.中國老年學雜志,2010,30(24):3797-8.
16Moon C,Soria JC,J ang SJ,etal.Involvement of aquaporins in colorectal carcinogenesis〔J〕.Oncogene,2003;22(43):6699-703.
17Pander J,Wessels JA,Gelderblom H.Pharmacogenetic interaction analysis for the efficacy of systemic treatment in metastatic colorectal cancer〔J〕.Ann Oncol,2011;22(5):1147-53.
18夏 曙,劉 飛,劉細友,等.COX-2抑制劑塞來昔布提高人結腸癌細胞SW480的放射敏感性〔J〕.世界華人消化雜志,2010;18(19):1990-4.
19林穗玲,李德銳,林英城,等.西妥昔單抗對人鼻咽癌細胞抑制作用的體外研究〔J〕.中華腫瘤防治雜志,2009;16(12):897-901.

