激活δ阿片受體對大鼠腦缺血再灌注損傷中白介素-6和腫瘤壞死因子-α的影響
龐桂珍
(承德護理職業學院,河北 承德 067000)
白細胞介素(IL)-6、腫瘤壞死因子(TNF)-α是腦缺血再灌注(I/R)損傷中主要的炎性細胞因子,由于其趨化作用,使白細胞由血管內向缺血區腦組織遷移,加重腦組織損傷。IL-6、TNF-α介導腦缺血再灌注(I/R)的炎性反應以及與之相關的毒性氧自由基、酸中毒等反應,這些共同作用下,導致神經細胞壞死、腦組織損傷。有報道稱,應用δ阿片受體激動劑D-丙(2)-D亮(5)腦非肽(DADLE)可以改善這種I/R損傷,而應用δ阿片受體拮抗劑可以阻斷這種效應〔1〕。至于δ阿片受體激動劑對缺血性腦損傷的作用和機制,至今仍然不能定論。本研究觀察DADLE對腦缺血的作用及機制。
1 材料與方法
1.1試劑與儀器 美國產420藍色單股心血管外科尼龍絲線作為血管內栓塞用線,頭端燙成光滑球形,直徑約0.12 mm,消毒備用。DADLE、納曲吲哚、氯化三苯四氮唑(TTC) 購自Sigma公司,用磷酸緩沖液(PBS) 0.12 mol/L配制成2%TTC溶液(pH值保持在7.15),避光保存。IL-6和TNF-α試劑盒購自武漢博士德試劑公司。
1.2模型制備 SD雄性大鼠24只,體質量225~275 g,實驗動物機構許可證號:SCXK(京)2002-0003,購自北京維通利華實驗動物有限公司。采用改進的Longa線栓法〔2〕。大鼠經水合氯醛(35 mg/100 g)腹腔注射麻醉后,手術鈍性分離右側頸總動脈,充分顯露頸總動脈分叉處、頸內動脈和頸外動脈,在近心端距離分叉處大約4 mm處,做一小的切口,插入血管內栓塞線,繼而進入頸內動脈,插入長度為22.5~23.5 mm,直至大腦前動脈的近端,完全阻斷大腦中動脈的血液供應。再灌注時,輕柔回抽血管內栓塞線,直至頸總動脈分叉處。手術操作過程中,保持室溫25 ℃左右,白熾燈照射動物,維持肛溫在36℃~38℃,直至大鼠恢復活動。模型成功的標志:①右側Horner征(眼球下陷);②左側出現以前肢為重的偏癱。除了僅插入血管內栓塞線大約10 mm外,假手術組手術過程同上,不會導致大腦中動脈的閉塞。
1.3動物分組 24只大鼠隨機分為四組,分別為假手術組、模型組、DADLE組、DADLE+納曲吲哚組,每組6只。其中假手術組不阻斷頸總動脈血流、不給藥;模型組缺血1 h,回抽栓線,再灌注6 h;DADLE組在缺血1 h后,靜脈注射DADLE 3 mg/kg〔3~5〕,然后繼續再灌注直至6 h;DADLE+納曲吲哚組在缺血1 h后,靜脈注射DADLE 3 mg/kg+納曲吲哚 15 mg/kg,然后繼續再灌注直至6 h。再灌注達到6 h后,各組動物斷頭處死,進行各項指標的檢測。
1.4神經功能評分 根據6個神經功能等級進行評分〔6〕。5分:將大鼠尾部輕輕提起,懸至距離地面大約1 m處,雙前肢伸向地面,并且沒有其他神經病學特征;4分:對側前肢保持持續性彎曲狀態,表現為由輕度前肢彎曲、肩關節內收到完全的前肢彎曲、肩關節內旋等不同程度的癥狀;3分:將大鼠置于軟塑封紙上,使大鼠前爪可以牢牢抓住,拉住大鼠尾部,輕輕側推其肩膀,使前肢側劃,重復數次,癱瘓側抵抗側推的能力下降;2分:大鼠置于地面上,拉其尾部時,大鼠向癱瘓側旋轉;1分:大鼠置于地面上自由行動時,向癱瘓側旋轉;0分:大鼠置于地面上,沒有自發活動。每組對應分值為每組各個動物神經功能評分的平均值。
1.5腦梗死體積測定 各組大鼠缺血1 h,再灌6 h后,過度麻醉后,迅速斷頭取腦,置-70 ℃冰箱速凍10 min。從前腦額極到枕極切成5片等厚的冠狀腦片,每片厚度約2 mm,立即置于含有2%TTC的PBS中,37%恒溫孵育30 min,孵育期間注意保持避光狀態,然后用4%多聚甲醛固定2 h。正常腦組織被染成鮮紅色,而梗死區則被染成蒼白色。根據切片順序,將固定的腦片排列,應用Motic Med 610型病理圖像分析儀,測量前腦總面積和腦梗死面積,根據公式V=t(A1+A2+A3+A4+A5+A6)-t(A1+A6)/2,計算前腦總體積和梗死體積。其中t為切片厚度,A為梗死面積〔2〕。
1.6IL-6和TNF-α的測定 應用ELISA檢測血清IL-6、TNF-α水平。大鼠斷頭取血5 ml,低溫離心15 min,分離血清,-20℃保存待測。檢測時,室溫下解凍,并確保樣品均勻地充分解凍,然后按試劑盒說明檢測IL-6,TNF-α水平。
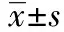
2 結 果
2.1不同濃度DADLE對I/R大鼠神經功能評分的影響 DADLE 0.3,1,3 mg/kg對I/R大鼠的神經功能評分具有劑量依賴性,隨著劑量增加,評分降低(分別為4.19±0.62、3.84±0.47、2.51±0.30);而DADLE 3~27 mg/kg對缺血再灌大鼠的神經功能評分隨著劑量增加(9、27 mg/kg DADLE組神經功能評分為3.77±0.38、4.21±0.55),神經功能評分相應增加。說明DADLE的最佳作用劑量為3 mg/kg。
2.2DADLE對I/R大鼠神經功能評分的影響 與假手術組相比,模型組神經功能評分明顯降低(2.69±0.21、5.00±0.05,P<0.01);與模型組相比,DADLE組的神經功能評分升高了42.0%(3.82±0.18,P<0.01),而納曲吲哚可以抑制DADLE的作用,明顯降低神經功能評分(2.51±0.12,P<0.01),同時加重造模損傷。說明DADLE通過δ阿片受體,升高神經功能評分。
2.3DADLE對I/R大鼠腦梗死體積的影響 正常腦組織被染成鮮紅色,而梗死區則被染成蒼白色。與假手術組相比,模型組的腦梗死灶體積和與前腦總體積的體積比明顯增大(P<0.01);與模型組相比,DADLE組的腦梗死灶體積減少了60.9%,體積比降低了40.0%(P<0.01),而納曲吲哚可以抑制DADLE的作用,明顯增加了腦梗死灶體積和體積比(P<0.01),同時加重造模損傷。說明DADLE通過δ阿片受體,減少腦梗死灶的體積。見圖1,表1。
2.4DADLE對I/R大鼠細胞因子IL-6和TNF-α水平的影響 與假手術組相比,模型組IL-6、TNF-α水平明顯升高(P<0.01);與模型組相比,DADLE組IL-6、TNF-α水平分別降低了33.8%和25.8%(P<0.01),而納曲吲哚可以抑制DADLE的作用,明顯降低IL-6、TNF-α水平(P<0.01),同時加重造模損傷。說明DADLE通過δ阿片受體,降低IL-6和TNF-α水平。見表2。

表1 DADLE對I/R大鼠腦梗死體積的影響

表2 DADLE對I/R大鼠細胞因子IL-6和TNF-α水平的影響

圖1 TTC染色DADLE對I/R大鼠腦梗死的影響
3 討 論
本研究結果表明,激活δ阿片受體,對腦I/R大鼠的腦損傷具有保護作用,而阻斷δ阿片受體則對保護作用起到抑制,從而加重腦損傷。DADLE通過激活δ阿片受體,抑制炎性細胞因子的作用,對腦缺血再灌注損傷具有保護作用。δ阿片受體激動劑DADLE可以延長外周器官存活,保護中樞系統的神經細胞〔7〕。研究表明,δ阿片受體激動劑DADLE與多器官的I/R損傷有密切的關系〔8〕。有報道稱,DOR的神經保護作用可能與調節PKC-MAPK通路有關〔9〕。然而,DADLE對腦I/R注的保護作用的作用機制還不是很清楚,需進一步研究。
4 參考文獻
1柳洪勝,張允嶺,劉雪梅.從句造腦缺血再灌注炎性因子的動態變化探討內毒形成及作用〔J〕.北京中醫藥大學學報,2007;30(4):246-8.
2李 姣,王永華,黃 芳,等.環磷腺苷注射液對大鼠腦缺血再灌注損傷的保護作用〔J〕.實用醫學雜志,2009;25(21):3583-5.
3韓潔韻,梁子敬,黃偉青,等.δ阿片受體激動劑DADLE對全腦缺血再灌注大鼠大腦組織病理影響〔J〕.廣州醫學院學報,2008;36(5):1-3.
4June HK,Kook JC,Park YH,etal.Morphine-induced postconditioning modulates mitochondrial permeability transition pore opening via delta-1 opoid receptors activation in isolated rat hearts〔J〕.Exp Res Article,2011;61(1):69-74.
5Tian XS,Zhou F,Yang R,etal.Effects of intracerebroventricular injection of δ-opioid receptor agonist TAN-67 or antagonist naltrindole on acute cerebral ischemia in rat〔J〕.Acta Physiola Sin,2008;60(4):475-84.
6Yang ZJ,Shen DH,Guo X,etal.Electroacupunctrue enhances striatal neurogenesis in adult rat brains after a transient cerebral middle artery occlusion〔J〕.Acupunct Electrother Res,2005;30(3-4):185-99.
7范彥琦,梁子敬,韓潔韻.δ阿片受體在急性全腦缺血再灌注中的表達變化〔J〕.嶺南急診醫學雜志,2008;13(2):91-2.
8韓潔韻,梁子敬,黃偉青,等.δ阿片受體激動劑DADLE對全腦缺血再灌注大鼠大腦組織病理影響〔J〕.廣州醫學院學報,2008;5(2):1320-2.
9Narita M,Kuzumaki N,Miyatake M,etal.Role of delta-opioid receptor function in neurogenesis and neuroprotection〔J〕.J Neurochem,2006;97(5):1494-505.

