體外聯合培養體系中人臍靜脈內皮細胞對人骨髓間充質干細胞成骨分化的影響及機制
劉之川 簡華剛 王麗華 梅 英
(重慶醫科大學附屬第二醫院創傷燒傷科,重慶 400010)
本實驗著重研究人臍靜脈內皮細胞(hUVECs)在人骨髓間質干細胞(hBMSCs)體外聯合培養中,對于hBMSCS的生長、形態以及細胞分化所產生的影響,并且對hUVECs在聯合培養體系中對hBMSCs的Runx2與Bmi-1基因表達的作用。
1 實驗方法
1.1骨髓間充質干細胞(BMSCs)與臍靜脈內皮細胞(UVECs)的培養 將hBMSCs進行分離,并將其培養至第3代,然后在顯微鏡下倒置觀察其細胞的形態結構。選擇ATCC人臍靜脈血管的內皮細胞系來作為hUVECs的來源,并在低血清培養基當中,放置在37℃,5%CO2飽和濕度的培養箱中進行培養,將其培養至第3代,并對各細胞的形態結構進行觀察。
1.2建立聯合培養裝置 選用培養至第3代的人hBMSCs和hUVECs,準備6孔板,將6孔板置入插入式的培養皿當中,建立培養液和使細胞因子能夠互相通連的聯合培養裝置,設單獨hBMSCs組、單獨hUVECs組及hUVECs組與hBMSCs1∶1聯合培養,分別將其編號為1、2、3。在每孔中置入含有10%胎牛血清的L-DMEM液2 ml,并于隔日對液體進行置換,將樣本放置于37℃,5%CO2飽和的濕度培養箱當中進行培養。分別在第4、6、8、10天在顯微鏡下對聯合培養的細胞形態的變化進行倒置觀察。
1.3細胞的生長曲線 分別在進行培養后的第1、2、3、4、5、6、7、8、9、10天各取每組1孔,用胰酶進行消化之后對1套聯合培養裝置中hBMSCs計數,并描繪出hBMSCs的生長曲線。
1.4對Bmi-1、Runx2基因的定量檢測 分別在第4、6、8、10天對1.2中的各組6孔板各取6孔,采用熒光定量PCR(FQ-PCR)的方法,對各組中的Bmi-1、Runx2基因的相對表達量進行檢測。具體的檢測步驟操作如下。
1.4.1標本的收集 將Trizol試劑在6孔培養板當中的每孔中加入1 ml,然后對細胞使用移液槍進行反復的吹打之后裝入1.5 ml的離心管中,保持在-80℃的冰箱當中。
1.4.2總RNA提取 ①在每毫升的Trizol當中加入0.2 ml的氯仿,vortex以15 s進行混勻或是晃動,在室溫下放置2 min到3 min;②進行15 min的12 000 r/min 4℃離心,然后將含總RNA的上層水相吸取至一個新的離心管當中,每毫升的Trizol大約可以吸取到0.5~0.55 ml;③按照最初的每毫升的Trizol當中加入0.5 ml的異丙醇,并進行數次的顛倒以混勻,再在室溫下進行10 min的沉淀;④在進行10 min的12 000 r/min 4℃離心,可在管底見RNA的沉淀,將上清棄掉;⑤將1 ml的75%乙醇加入每毫升最初的Trizol當中,vortex或是進行顛倒以將液體混勻,在進行5 min的7 500 r/min 4℃離心,將上清棄掉。再使用離心機將其輕甩一下,并將液體小心的吸盡;⑥待到RNA略微干了之后,加入20 L DEPC水溶解,并在-70℃條件下進行凍存。值得注意的是,要避免RNA過分的干燥,否則會不利于進行溶解,同時測出的A260/280的值也會比1.6低。
1.4.3逆轉錄 分別從兩組的細胞當中對總RNA進行提取,并將其合成為cDNA。嚴格按照用逆轉錄試劑的說明書來進行操作。
1.4.4引物設計 β-actin、 Runx2、Bmi-1基因的引物以及PCR擴增的產物的長度的具體數據如下表1中所示。

表1 Bmi-1、Runx2、β-actin引物
1.4.5對樣本的cDNA純度與濃度的檢測 對各樣本的純度與濃度采用核酸蛋白檢測儀進行檢測。
1.4.6對引物及模板的驗證 在每次進行操作之后,對樣本進行隨機的抽取,選取5~8例,對樣本采用電泳分析法,以檢測看家基因-actin、Bmi-1、Runx2的PCR擴增的產物。
1.4.7PCR擴增 對所有的單管樣本全部復設3孔。并根據具體的擴增反應對溶解曲線進行分析,以對擴增反應的特異性進行檢測。
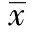
2 結 果
2.1細胞形態觀察 當第3代的hBMSCs與HUVECs進行聯合培養到第4天時,細胞的形態呈現出多樣化的變化,出現梭形與多角形的混合生長,梭形多如圖1所示;培養到第6天時細胞的體積如圖1中所示表現有明顯的增大;培養到第8天的時候有部分細胞如圖1中所示開始出現連接的現象;培養到第10天的時候細胞如圖1中所示失去了接觸抑制進而形成了細胞的團塊。
2.2兩組中hMSCs生長曲線 hMSCs組與聯合培養組相比其數據具有統計學意義(P<0.05),見表2。
2.3對堿性磷酸酶(ALP)的定量檢測 各組檢測的ALP的量隨著時間的延長呈現出先增高而后逐漸減低的趨勢,在第8天聯合培養組的ALP量達到最高;而hBMSCs組與單獨hUVECs組在各個時間點所檢測到的ALP的量并沒有明顯的變化,見表3。
2.4熒光定量PCR擴增結果 聯合組Bmi-1檢測量隨時間的延長先增高后降低,第8天時聯合培養組Bmi-1最高;聯合組與單獨hMSCs組在各時間點差異較明顯;單獨hMSCs組Bmi-1在各時間點沒有明顯變化。

第4天

第6天

第8天

第10天


組別時間(d)1 2 3 4 5時間(d)6 7 8 9 10聯合培養組3.0±0.133.4±0.345.7±0.097.7±0.1916.9±0.1520.6±0.2123.7±0.2224.6±0.4125.4±0.2425.1±0.11單獨hMSCs組3.1±0.223.4±0.254.0±0.205.5± 0.2612.1±0.17117.0±0.3220.0±0.1522.9±0.3024.4±0.2124.3±0.22

表3 各細胞培養各時間點ALP含量(n=6,±s)

表4 各細胞培養組各個時間的Bmi-1含量(n=6,±s)
聯合組Runx2檢測量隨時間延長先增高后降低,第8天時聯合培養組Runx2最高;聯合組與單獨hMSCs組在各時間點差異較明顯;單獨hMSCs組Runx2在各時間點沒有明顯變化。見表5。

表5 各細胞培養組各個時間點的Runx2含量(n=6,±s)
3 討 論
在體內由于hBMSCs所定居的位置的不同,同時又由于在微環境當中的細胞因子、生長因子等起調控作用物質的不同,可以使hBMSCs向不同的譜系進行分化,并且可以跨胚層進行分化。研究hBMSCs細胞周期表明,有大約20%的hBMSCs是處于G0期,表明hBMSCs是具有著十分強大的增殖能力與分化能力〔1〕。經研究表明,hBMSCs在進行了12代的體外培養之后仍然能夠保持著正常的端粒酶活性以及染色體表型,在經過15代的培養之后仍然能夠保持其自身的成骨分化的潛能。在對hBMSCs進行深入研究之后表明,在動物體內的骨祖細胞存在2種類型:一是僅僅在骨髓中存在的,不需要誘導物就可以自動進行分化的成骨干細胞,因此而被稱為定向性成骨母細胞,定向性成骨母細胞的特點是處于胚胎期的間充質祖細胞存留在骨內;其二是必須由外源性的誘導物對其發生作用才可以被誘導分化成為成骨間充質干細胞,因此稱為誘導型成骨母細胞〔2〕。誘導型成骨母細胞不能夠自發形成骨組織,它必須在外源性的誘導物持續的作用之下才能夠定向的分化成為骨組織。hBMSCs分化成為成骨細胞中的定向誘導既能夠通過化學藥物來實現,同時也可以通過細胞因子或是生長因子的作用來實現〔3〕。
多梳基因家族在果蠅發育是發揮使同源異形基因維持穩定表現的重要因子〔4〕。Bmi-1基因中有一個環指模序,它主要存在于N-末端環指結構域之中,同抑癌基因C-Myc在腫瘤形成和細胞增殖中發揮著協同的作用〔5〕。Bmi-1基因通過其環指結構同其他的環指蛋白相互結合,例如dinG等所形成的異源二聚體,進而對其靶基因的轉錄發揮抑制的作用。在Bmi-1基因中心還存在著一個保守DNA結合模序,螺旋-轉角-螺旋-轉角(H-T-H-T),也發揮著轉錄抑制的作用〔6〕。本研究結果提示Bmi-1基因兩個結構在細胞生存期的延長和抑制p16上都發揮著不可或缺的作用,若將這兩個結構敲除,那么Bmi-1基因將會失去其活性,進而導致早衰的現象出現〔7〕。在多細胞生物整個生命周期中,干細胞將會產生分化細胞的類型,進而對生物體最終的壽命起決定作用。經研究表明,經過純化的鼠與人造血干細胞同樣對Bmi-1的表達都具有十分高的水平〔8〕。Qiao等〔9〕在從臍帶中分離出的間質干細胞上同樣也發現了Bmi-1的表達。通過Bmi-1對能夠決定干細胞命運的基因如干細胞、抗增殖基因以及生存基因等相關基因發揮控制作用從而對HSC的自我更新發揮調節的作用。
Runx2屬于轉錄因子RUNXX家族中的成員之一,它作為成骨細胞特異轉錄因子,對于骨組織的形成以及重建發揮著十分重要的作用。Runx2具有3種類型的異構體〔10〕,它們分別具有不同的N-端序列。這3種類型分別是以MRIPVD作為起始的氨基酸序列的Ⅰ型,和以MASNSL作為起始的氨基酸序列的Ⅱ型以及以MLHSPH作為起始的氨基酸序列的Ⅲ型。Runx2對多能干細胞分化成為成骨細胞起著決定性的作用,Komori等〔11〕采取將目的基因敲除的方法發現,由于在敲除之后不能有效的分化成為成骨細胞,使得具有RUNX2缺陷的小鼠膜內軟骨和內骨不能分化成骨,由此證實了RUNX2在成骨細胞分化的過程中是所一個必不可少的因子。RUNx2的表達比軟骨細胞分化成為肥大軟骨細胞要早〔12〕,由此說明了RUNXX蛋白能夠在軟骨形成的早期階段參與。
體外聯合培養體系中,hBMSCs同hUVECs具有良好的相容性,且hUVECs能夠對hBMSCs的增殖起到促進的作用。
4 參考文獻
1Du ZH,Wang HL,Song J,etal.Biological characteristics and application of adult bone marrow mesenchymal stem cells in tissue engineering and regenerative medieine〔J〕.J Clin Rehab Tissue Eng Res,2009;13(33):6553-4.
2Mauney JR,Sjostorm S,Blumberg J,etal.Mechanical stimulation promotes ostcogenic differentiation of human bone marrow stromal cells on 3-D partially demineralized bone scaffold in vitro〔J〕.Calcif Tissue Int,2004;74(5):458-68.
3Velazquez OC,Snyder R,Liu ZJ,etal.Fibroblast-dependent differentiation of human Microvascular endothelial cells into capillary-like 3-dimensional networks〔J〕.Faseb J,2002;16(10):1316-8.
4Villars F,Bordenave L,Bareille R.Effect of human endothelial cells on human bone Marrow stromal cell phenotype:role of VEGF〔J〕.J Cell Bio chem,2000;79(4):672-85.
5Finkenzeller G,Arabatzis G,Geyer M,etal.Gene expression profiling reveals platelet-derived growth factor receptor alpha as a target of cell contact-dependent gene regulation in an endothelial cell-osteoblast co-culture model〔J〕.Tissue Eng,2006;12(10):2889-903.
6Dimri GP,Martinez JL,Jacobs JJ,etal.The Bmi-1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells〔J〕.Cancer Res,2002;62(16):4336-45.
7Itahana K,Zou Y,Itahana Y,etal.Control of the replicative life span of human fibroblasts by p16 and the poly comb protein Bmi-1〔J〕.Mol Cell Biol,2003;23(1):389-401.
8Park IK,Qian D,Kiel M,etal.Bmil is required for maintenance of adult self-renewing haematopoietic stem cells 〔J〕.Nature,2003;423(6937):302-5.
9Qiao C,Xu W,Zhu W,etal.Human mesenchymal stem cells isolated from the umbilical cord〔J〕.Cell Biol Int,2008;32(1):8-15.
10Stock M,Otto F.Control of RUNX2 isoform expression:The role of promoters and enhancers〔J〕.J Cell Biochem,2005;95(3):506-17.
11Komori T.Regulation of skeletal development by the RUNX family of transcription factors〔J〕.J Cell Biochem,2005;95(3):445-53.
12Terry A,Kilbey A,Vaillant F,etal.Conservation and expression of an alternative 3' exon of RUNX2 encoding a novel proline-rich C-terminal domain〔J〕.Gene,2004;336(1):115-25.

