測試條件對Ni催化劑的金屬分散度的影響
滿 毅,黃文氫
(中國石化 北京化工研究院,北京 100013)
測試條件對Ni催化劑的金屬分散度的影響
滿 毅,黃文氫
(中國石化 北京化工研究院,北京 100013)
采用靜態(tài)H2化學(xué)吸附法在選定壓力下測定了不同測試條件下的Ni催化劑的金屬分散度,通過H2-TPR實(shí)驗(yàn)研究了Ni催化劑中Ni的氧化態(tài),考察了還原溫度、還原時間、抽真空時間和吸附溫度對Ni催化劑的金屬分散度的影響。H2-TPR實(shí)驗(yàn)結(jié)果表明,Ni催化劑中含有兩種氧化態(tài)Ni,分別在300,800 ℃下可被還原。靜態(tài)H2化學(xué)吸附法的實(shí)驗(yàn)結(jié)果表明,高還原溫度和長還原時間會使Ni金屬發(fā)生高溫?zé)Y(jié);長時間抽真空可去除還原過程中殘留在體系內(nèi)和Ni金屬表面物理吸附的H2;H2在Ni金屬上的化學(xué)吸附不需經(jīng)過高溫活化即可發(fā)生。測試Ni催化劑的金屬分散度的適宜條件為:還原溫度650 ℃,還原時間1 h,抽真空時間大于16 h,吸附溫度50 ℃。在此條件下,Ni催化劑的金屬分散度為5.46%。
鎳催化劑;金屬分散度;化學(xué)吸附;測試
Ni催化劑是一種重要的工業(yè)催化劑,廣泛應(yīng)用于化工生產(chǎn)。金屬分散度是催化劑重要的表面性質(zhì)之一,Ni催化劑的金屬分散度是其表面活性Ni金屬原子數(shù)與催化劑上總Ni金屬原子數(shù)之比。測定金屬分散度常用的方法是化學(xué)吸附法[1]。20世紀(jì)人們就開始采用各種方法[2-4]測定負(fù)載型催化劑的金屬分散度,并對不同測試方法進(jìn)行了比較[5-6],研究了吸附的探針分子與金屬的對應(yīng)關(guān)系[7],比較了不同吸附質(zhì)的性質(zhì)[8],不同類型金屬負(fù)載催化劑的測試條件不同[9-13],但有關(guān)測試條件對金屬分散度的影響未見報道。
采用化學(xué)吸附法測定金屬分散度,通常先要在一定溫度下用H2還原試樣,然后用惰性氣體吹掃或抽真空去除體系中的H2及物理吸附的H2,最后在一定溫度下進(jìn)行吸附測定,測試條件顯著影響吸附效果,從而影響金屬分散度。
本工作通過H2-TPR實(shí)驗(yàn)研究了Ni催化劑中Ni的氧化態(tài),并采用靜態(tài)H2化學(xué)吸附法測定了不同條件下Ni催化劑的金屬分散度,考察了還原溫度、還原時間、抽真空時間、吸附溫度等測試條件對Ni催化劑的金屬分散度的影響。
1 實(shí)驗(yàn)部分
1.1 試樣和儀器
Ni催化劑(Ni含量20%(w),載體為Al2O3):中國石化北京化工研究院。
ASAP2020M+C型全自動物化吸附分析儀和Autochem 2920型全自動化學(xué)吸附儀:美國Micromeritics公司。
1.2 實(shí)驗(yàn)條件
H2-TPR實(shí)驗(yàn):準(zhǔn)確稱取一定量試樣,通入體積組成為10%H2-90%Ar的混合氣,吹掃10 min,待基線穩(wěn)定后開始計(jì)數(shù),以10 ℃/min的速率升至某一溫度。
靜態(tài)H2化學(xué)吸附法:準(zhǔn)確稱取0.5 g試樣,對試樣進(jìn)行抽真空處理后升溫至某一定值,連續(xù)通入H2,還原一定時間后,對試樣進(jìn)行抽真空處理,然后溫度降至某一定值,在一定壓力范圍內(nèi),測定H2的吸附等溫線,然后再抽真空,重復(fù)測定H2的吸附等溫線。根據(jù)測得的H2吸附量與相對壓力的關(guān)系,通過差值法計(jì)算H2的化學(xué)吸附量,再計(jì)算Ni的分散度。
2 結(jié)果與討論
2.1 H2-TPR實(shí)驗(yàn)結(jié)果
金屬Ni化學(xué)性質(zhì)比較活潑,在催化劑中Ni通常以氧化態(tài)的形式保存和運(yùn)輸,所以在測定金屬分散度前,先要對氧化態(tài)Ni進(jìn)行還原。根據(jù)文獻(xiàn)[14]的報道,高溫下,即使H2氣氛下,金屬也能發(fā)生燒結(jié),分散度降低。Agostini等[15]認(rèn)為在H2氛圍下升溫會毒化金屬表面,從而降低金屬分散度。因此,選擇合適的還原溫度對于準(zhǔn)確測定金屬分散度非常重要。為考察還原溫度的影響,首先對Ni催化劑進(jìn)行H2-TPR表征。
圖1是Ni催化劑的H2-TPR曲線。由圖1可見,Ni催化劑有2個還原峰,還原溫度分別為192,708℃。這表明Ni催化劑中含有兩種氧化態(tài)Ni,一種是易還原的氧化態(tài)Ni,在300 ℃以下即可還原,另一種氧化態(tài)Ni需在800 ℃時才能被還原。
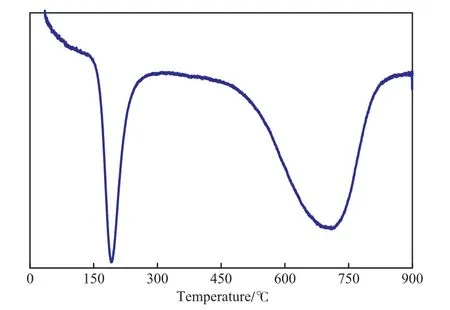
圖1 Ni催化劑的H2-TPR曲線Fig.1 H2-TPR curve of Ni catalyst.
由圖1還可見,選擇450 ℃及更低的還原溫度只能將第一種形態(tài)的氧化態(tài)Ni還原,另一種Ni還是以氧化態(tài)形式存在,因此探針分子進(jìn)行吸附時,只能吸附在第一種形態(tài)的Ni上,另一種形式的氧化態(tài)Ni不會發(fā)生探針分子吸附。但選擇800 ℃以上的還原溫度則可將兩種形式的氧化態(tài)Ni還原,但高溫還原會發(fā)生高溫?zé)Y(jié),對金屬分散度有影響。
2.2 靜態(tài)H2化學(xué)吸附法壓力的選擇
靜態(tài)H2化學(xué)吸附法是通過差值法來測定H2的化學(xué)吸附量,其原理是用H2作為探針分子,在不同壓力下進(jìn)行吸附,測量H2的吸附量,此時H2的吸附量包括吸附在材料表面的物理吸附的H2、化學(xué)吸附的H2以及可能吸附在載體表面的溢流氫,然后對試樣進(jìn)行抽真空處理,將材料表面物理吸附的H2和可能吸附在載體表面的溢流氫吹掃掉,再用H2作為探針分子進(jìn)行吸附,測量H2吸附量,此時H2的吸附量為吸附在材料表面的物理吸附H2和溢流氫的總和,兩次吸附量的差值即為H2的化學(xué)吸附量。因?yàn)镠2的物理吸附量會隨吸附壓力的變化而變化,但H2的化學(xué)吸附量不隨吸附壓力的變化而改變,所以不同壓力下H2的化學(xué)吸附量應(yīng)為定值。本實(shí)驗(yàn)分別選取13.3,20.0,26.7,33.3,40.0 kPa 5個壓力,采用靜態(tài)H2化學(xué)吸附法測定Ni催化劑的吸附等溫線,實(shí)驗(yàn)結(jié)果見圖2。由圖2可見,不同壓力下,兩次H2吸附量的差值(見圖2(c))幾乎相同,與上述原理相吻合。將這5個H2吸附量的差值連成一條直線,該直線與縱坐標(biāo)軸的交點(diǎn)即為H2的化學(xué)吸附量。由此可見,選擇壓力分別為13.3,20.0,26.7,33.3,40.0 kPa來計(jì)算H2的化學(xué)吸附量較適宜。
2.3 測定條件對Ni催化劑的金屬分散度的影響
2.3.1 還原溫度的影響
為研究還原溫度對金屬分散度的影響,采用靜態(tài)H2化學(xué)吸附法在250~850 ℃的還原溫度下對Ni催化劑進(jìn)行還原,測得的分散度見圖3。
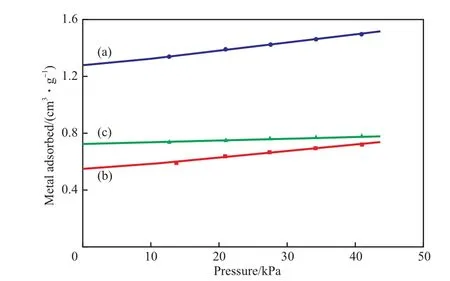
圖2 靜態(tài)H2化學(xué)吸附法測得的Ni催化劑的吸附等溫線Fig.2 H2 adsorption isotherm plot on the Ni catalyst measured by H2 chemisorption.
2.3.2 還原時間的影響
采用靜態(tài)H2化學(xué)吸附法,測定不同還原時間下Ni催化劑的金屬分散度,實(shí)驗(yàn)結(jié)果見圖4。由圖4可見,隨還原時間的延長,Ni催化劑的金屬分散度呈現(xiàn)先略微增大后降低的趨勢,表明短時間的還原并不能將氧化態(tài)Ni還原完全,而長時間的還原會使Ni金屬發(fā)生高溫?zé)Y(jié),但由于Ni催化劑中Ni分散在載體表面,分散度下降得不明顯,故在選擇還原時間時,在保證金屬氧化物達(dá)到基本相同的還原程度時,應(yīng)盡量選擇短的還原時間。因此,選擇還原時間為1 h較適宜。
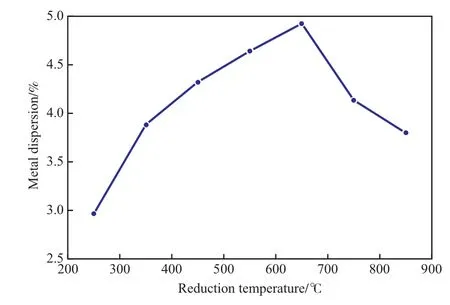
圖3 不同還原溫度下測得的Ni催化劑的金屬分散度Fig.3 Metal dispersion on the Ni catalyst measured at different reduction temperature.
由圖3可見,隨還原溫度的升高,Ni催化劑的金屬分散度呈現(xiàn)先增大后降低的趨勢。在還原溫度較低時,根據(jù)H2-TPR實(shí)驗(yàn)結(jié)果可知,氧化態(tài)的Ni沒有完全還原成金屬Ni,氧化態(tài)Ni不會與H2發(fā)生吸附作用,所以金屬分散度偏低;但當(dāng)還原溫度較高時,高溫會將更多的氧化態(tài)Ni還原成金屬Ni,同時高溫還原會使Ni金屬發(fā)生高溫?zé)Y(jié)[14],二者的綜合作用導(dǎo)致Ni催化劑的金屬分散度隨還原溫度的升高先增大后減小。對于Ni催化劑,還原溫度為650℃時,金屬分散度最大,基本對應(yīng)于H2-TPR曲線中第二種氧化態(tài)Ni的還原峰位(見圖1),這表明在還原峰位的溫度下進(jìn)行還原,可最大限度的將氧化態(tài)Ni還原,同時受高溫?zé)Y(jié)的影響相對較小。因此,選擇還原溫度650 ℃較合適。
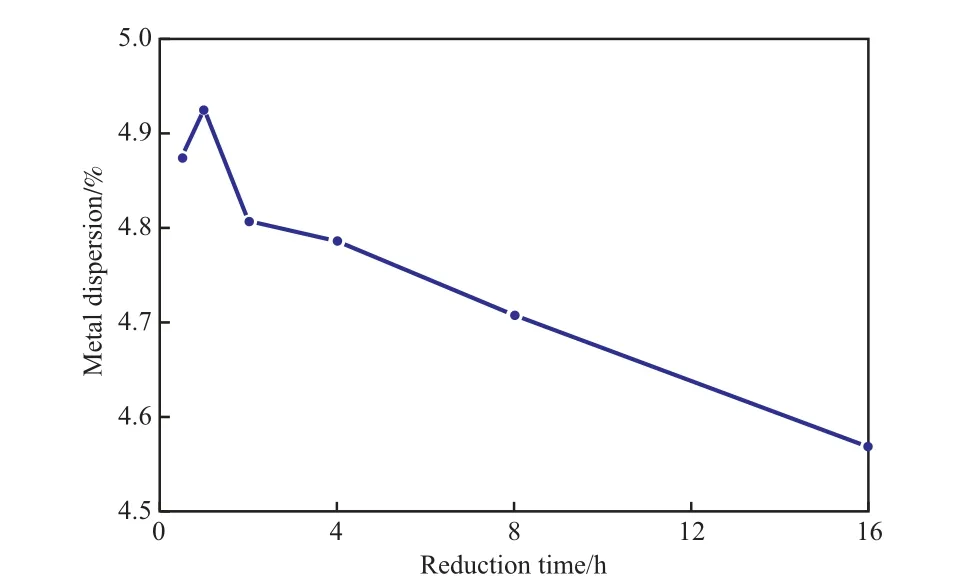
圖4 不同還原時間下測得的Ni催化劑的金屬分散度Fig.4 Metal dispersion of the Ni catalyst measured at different reduction time.
2.3.3 抽真空時間的影響
采用靜態(tài)H2化學(xué)吸附法,測定不同抽真空時間下Ni催化劑的金屬分散度,實(shí)驗(yàn)結(jié)果見圖5。
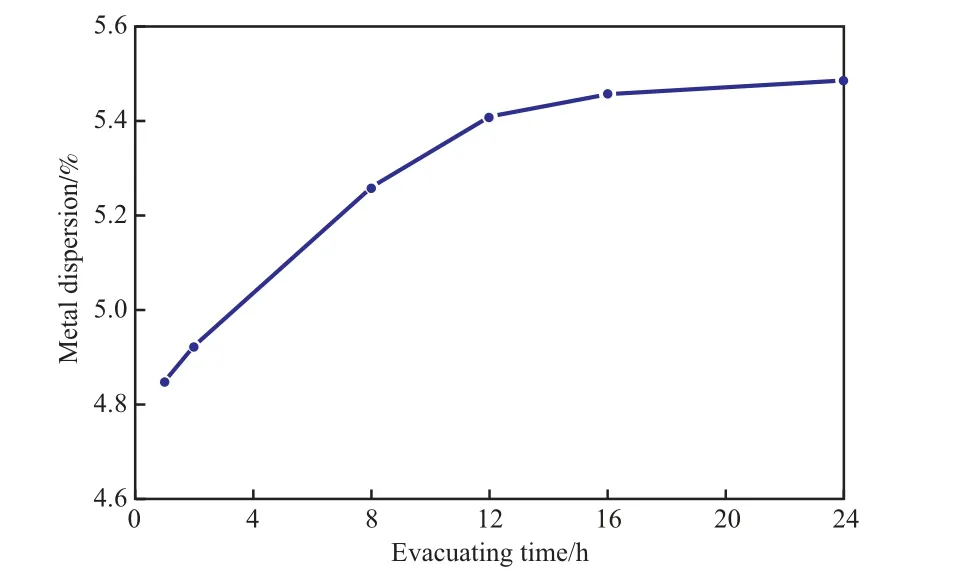
圖5 不同抽真空時間下測得的Ni催化劑的金屬分散度Fig.5 Metal dispersion of the Ni catalyst at different evacuating time.
由圖5可見,隨抽真空時間的延長,Ni催化劑的金屬分散度呈小幅上升的趨勢。這表明長時間抽真空會將還原過程中殘留在體系內(nèi)的H2和Ni金屬表面物理吸附的H2去除干凈,且長時間的抽真空不會降低金屬分散度。因此,在選擇抽真空時間時,可選擇盡量長的抽真空時間。對于該Ni催化劑,選擇抽真空時間大于16 h較合適。
2.3.4 吸附溫度的影響
吸附溫度同樣是測定金屬分散度的重要參數(shù),有些氣體的吸附需要活化能,需要在一定溫度下才能發(fā)生。采用靜態(tài)H2化學(xué)吸附法,測定不同吸附溫度下Ni催化劑的金屬分散度,實(shí)驗(yàn)結(jié)果見圖6。由圖6可見,隨吸附溫度的升高,Ni催化劑的金屬分散度呈明顯的下降趨勢,表明H2在Ni催化劑上的化學(xué)吸附在50 ℃下即可發(fā)生,不需經(jīng)過高溫活化,高溫下反而會明顯降低Ni催化劑上的H2化學(xué)吸附量。因此,選擇吸附溫度為50 ℃較適宜,此時Ni催化劑的金屬分散度為5.46%。
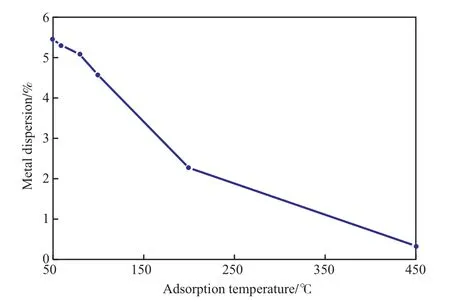
圖6 不同吸附溫度下測得的Ni催化劑的金屬分散度Fig.6 Metal dispersion of the Ni catalyst at different adsorption temperature.
3 結(jié)論
1)H2-TPR實(shí)驗(yàn)結(jié)果表明,Ni催化劑中有兩種氧化態(tài)Ni:一種氧化態(tài)Ni在300 ℃下即可還原,另一種氧化態(tài)Ni需在800 ℃時才能被還原。
2)采用靜態(tài)H2化學(xué)吸附法,在選定壓力下研究測試條件對Ni催化劑的金屬分散度的影響。實(shí)驗(yàn)結(jié)果表明,高還原溫度和長還原時間會使Ni金屬發(fā)生高溫?zé)Y(jié);長時間抽真空可去除殘留在體系內(nèi)和Ni金屬表面物理吸附的H2;H2在Ni金屬上的化學(xué)吸附不需經(jīng)過高溫活化即可發(fā)生。
3)采用靜態(tài)H2化學(xué)吸附法測定Ni催化劑的金屬分散度的適宜條件為:還原溫度650 ℃,還原時間1 h,抽真空時間大于16 h,吸附溫度50 ℃。在此條件下,Ni催化劑的金屬分散度為5.46%。
[1] 楊春雁,楊衛(wèi)亞,凌鳳香,等. 負(fù)載型金屬催化劑表面金屬分散度的測定[J]. 化工進(jìn)展,2010,29(8):1468 - 1473,1501.
[2] 劉君佐,史佩芬. 氣體脈沖色譜法測定負(fù)載催化劑上金屬的分散度:Ⅰ.應(yīng)用于Pt/Al2O3催化劑[J]. 石油化工,1978,7(5):454 - 461.
[3] 楊錫堯,裴站芬,白瑞琴,等. 脈沖氫氧滴定法測定Pt/Al2O3催化劑的分散度[J]. 石油化工,1978,7(4):352 - 355.
[4] Brooks C S,Christopher G L M. Measurement of the State of Metal Dispersion on Supported Nickel Catalysts by Gas Chemisorption[J].J Catal,1968,10(3):211 - 223.
[5] Smith J S,Thrower P A,Vannice M A. Characterization of Ni/ TiO2Catalysts by TEM,X-Ray Diffraction and Chemisorption Techniques[J].J Catal,1981,68(2):270 - 285.
[6] 史雪芳. 負(fù)載型催化劑中金屬分散度的測定[J]. 黎明化工,1993(1):21 - 26.
[7] Anderson J A. Supported Metals in Catalysis[M]. London:Imperial College Press,2005:143 - 145.
[8] 陳誦英,孫予罕,丁云杰,等. 吸附與催化[M]. 鄭州:河南科學(xué)技術(shù)出版社,2001:124 - 125.
[9] Velu S,Gangwal S. Synthesis of Alumina Supported Nickel Nanoparticle Catalysts and Evaluation of Nickel Metal Dispersions by Temperature Programmed Desorption[J].Solid State Ionics,2006,177(7/8):803 - 811.
[10] Pechimuthu N A,Pant K K,Dhingra S C,et al. Characterization and Activity of K,CeO2,and Mn Promoted Ni/Al2O3Catalysts for Carbon Dioxide Reforming of Methane[J].Ind Eng Chem Res,2006,45(22):7435 - 7443.
[11] Mohamed I Z,Muhammad A H,Lata P. In Situ FTIR Spectroscopic Study of 2-Propanol Adsorptive and Catalytic Interactions on Metal-Modif ed Aluminas[J].Langmuir,2001,17(13):4025 - 4034.
[12] Kelf n M H,Cyrus G C,Adesoji A A. Multivariate Analysis of the Role of Preparation Conditions on the Intrinsic Properties of a Co-Ni/Al2O3Steam-Reforming Catalysts[J].Ind Eng Chem Res,2004,43(19):6006 - 6013.
[13] 紀(jì)敏,周美娟,畢穎麗,等. La2O3-Ni/SrAl12O19催化劑上甲烷與二氧化碳重整反應(yīng)的研究[J]. 分子催化,1997,11(1):13 - 20.
[14] Aben P C. Palladium Areas in Supported Catalysts:Determination of Palladium Surface Areas in Supported Catalysts by Means of Hydrogen Chemisorptions[J].J Catal,1968,10(3):224 - 229.
[15] Agostini G,Pellegrini R,Leofanti G,et al. Determination of the Particle Size, Available Surface Area, and Nature of Exposed Sites for Silica-Alumina-Supported Pd Nanoparticles:A Multitechnical Approach[J].J Phys Chem C,2009,113(24): 10485 - 10492.
(編輯 李明輝)
Effect of Measuring Conditions on Metal Dispersion on Ni Catalyst
Man Yi,Huang Wenqing
(SINOPEC Beijing Research Institute of Chemical Industry,Beijing 100013,China)
The metal dispersion on Ni catalyst was measured by static H2chemisorption under different measuring conditions. The oxidation state of Ni on the Ni catalyst was measured by means of H2-TPR experiment. The effects of reduction temperature,reduction time,evacuating time and adsorption temperature on the metal dispersity on the Ni catalyst were investigated. The H2-TPR results showed that there were two oxidation states of Ni in the Ni catalyst,which could be reduced at 300 ℃and 800 ℃,respectively. The static H2chemisorption isotherm results showed that the Ni metal was sintered at high reduction temperature and in long reduction time. The hydrogen which was adsorbed physically on the Ni surface and remained in the system could be removed by evacuating with long time. The hydrogen could be adsorbed chemically on the Ni surface without activation. The metal dispersion on the Ni catalyst was 5.46% under the suitable conditions of reduction temperature 650 ℃,reduction time 1 h,evacuating time more than 16 h and adsorption temperature 50 ℃.
nickel catalyst;metal dispersion;chemisorption;measuring
1000 - 8144(2014)09 - 1087 - 04
TQ 426.81
A
2014 - 04 - 11;[修改稿日期] 2014 - 06 - 30。
滿毅(1983—),男,山東省青島市人,碩士,工程師,電話 010 - 59202148,電郵 many.bjhy@sinopec.com。
進(jìn)展與述評

