以胰島新生相關蛋白啟動子為靶點的基因表達上調劑篩選模型的建立與初步應用
張許萌,王林林,任浩,何琪楊,陳汝賢,解云英
?
以胰島新生相關蛋白啟動子為靶點的基因表達上調劑篩選模型的建立與初步應用
張許萌,王林林,任浩,何琪楊,陳汝賢,解云英
100050 北京,中國醫學科學院北京協和醫學院醫藥生物技術研究所微生物化學室
建立以胰島新生相關蛋白啟動子為靶點的高通量篩選模型,用于胰島新生相關蛋白基因表達上調劑的篩選。
以敘利亞金黃地鼠基因組 DNA 為模板擴增胰島新生相關蛋白核心啟動子序列,克隆至pGL4.17 質粒載體構建重組質粒。采用脂質體介導的方法將重組質粒和內參質粒 pRL-TK 共轉染金黃地鼠胰島 β 細胞 HIT-T15,雙熒光素酶報告基因系統檢測熒光素酶的表達活性。對瞬時轉染條件進行優化,以豆蔻酸-佛波醇-乙酸酯作為陽性對照來評價模型的有效性,并利用該細胞模型對本研究所的化合物庫進行篩選。
構建了重組熒光素酶報告基因質粒 pGL4.17-INGAP,并成功轉染 HIT-T15 細胞株。對模型進行優化后,應用陽性對照對其進行評價,Z' 因子為 0.57,適用于進行高通量篩選。用該模型篩選了本所化合物庫,其中白藜蘆醇顯示出較好的上調作用,EC50為 1.6 μg/ml。
成功建立了以胰島新生相關蛋白啟動子為靶點的基因表達上調劑篩選模型。
轉錄啟動子; 藥物評價,臨床前; 胰島新生相關蛋白
糖尿病是以高血糖為主要特征的代謝性疾病,并伴有嚴重的并發癥,降低了患者的生活質量[1],胰島 β 細胞過度凋亡、功能減退是糖尿病發病的重要環節[2]。研究發現,在胰腺發生發育過程中,將健康胰腺部分切除或胰管結扎后,某些誘發因子能夠刺激胰腺導管前體細胞分化成胰島 β 細胞,胰島功能可以通過 β 細胞再生得以部分恢復,這一過程即胰島新生[3-4]。
基礎研究已發現了一些誘發胰島新生的先導物,其中胰島新生相關蛋白(islet neogenesis associated protein,INGAP)是在尋找具有胰島新生活性的內源性分子過程中發現的第一個治療性候選物[5],在胰島新生過程中發揮著重要作用。已有動物實驗表明,INGAP 能夠促進 β 細胞的增殖,逆轉I型糖尿病大鼠的高血糖癥狀[5-6];另外,相關II期臨床研究證明,INGAP 能夠促進內源性胰島素分泌,改善血糖控制[7]。因此,INGAP 是一個潛在的安全有效的糖尿病治療新靶點。
本研究以 INGAP 基因啟動子為靶點,建立以細胞為基礎的、能夠檢測其轉錄活性的篩選模型,以期發現能夠特異性上調 INGAP 表達的活性化合物,為糖尿病的治療提供新的候選藥物。
1 材料與方法
1.1 材料
1.1.1 細胞株和質粒 金黃地鼠胰島 β 細胞株 HIT-T15(ATCC CRL-1777)購自中國科學院昆明細胞庫;DH5α 感受態細胞購自寶生物工程(大連)有限公司;pGM-T 購自天根生化科技(北京)有限公司;pGL4.17(luc2/Neo)和 pRL-TK 由本所生物工程室惠贈。
1.1.2 工具酶和主要試劑 Ex Taq 酶、T4 DNA連接酶等購自寶生物工程(大連)有限公司;RPMI 1640 培養基為美國 Thermo 產品;胎牛血清為美國 Gibco 公司產品;血液/細胞/組織基因組 DNA 提取試劑盒、質粒小提試劑盒(離心柱型)、普通瓊脂糖凝膠 DNA 回收試劑盒等購自天根生化科技(北京)有限公司;Dual-Glo 雙熒光素酶檢測試劑盒(E2920)為美國 Promega 公司產品;豆蔻酸-佛波醇-乙酸酯(PMA)購自美國 Sigma 公司。
1.1.3 儀器 TC-312 型基因擴增儀購自英國 Techne 公司;ChemiImager5500 化學發光成像儀購自美國 Biorad 公司;Q5000 微量紫外分光光度計為美國 Quawell Technology Inc 公司產品;EnVision 多功能微孔板檢測儀為美國 Perkin Elmer 公司產品。
1.2 方法
1.2.1 DNA 目的片段的體外擴增 從敘利亞金黃地鼠肝組織抽提基因組DNA,并以此為模板,根據 GenBank 收錄的 INGAP 基因全序列(AY184211.1)和啟動子調控元件所在位置[8]設計引物,上游引物5'CTGTAACCAGATGA TACGATGC 3'(下劃線表示 XhoI酶切位點),下游引物5' AGTTTCAGAGTGCTGCCTTG 3',擴增位于 2177 ~ 3256 bp 區域的 INGAP 基因啟動子序列 1080 bp。PCR 體系反應條件為 94 ℃變性4 min;94 ℃變性 30 s,52 ℃退火 30 s,72 ℃延伸 70 s(30 個循環);72 ℃延伸 10 min。
將 PCR 擴增產物純化回收,與 pGM-T 載體連接,轉化至DH5α 感受態細胞進行擴增,藍白斑法挑選陽性轉化子。擴增質粒,提取并測序鑒定,選取與 GenBank AY184211.1 序列同源性 100% 的克隆,命名為 pGM-INGAP。
1.2.2 重組質粒的構建和鑒定 限制性內切酶I與II酶切pGM-INGAP 和 pGL4.17,將目的片段與線性 pGL4.17 連接,即把 INGAP 基因啟動子序列定向插入到 pGL4.17 載體的熒光素酶報告基因上游,命名為 pGL4.17-INGAP。重組質粒轉化DH5α 進行擴增,提取質粒并鑒定。
1.2.3 瞬時轉染條件的建立與優化 HIT-T15 細胞在含 10% 胎牛血清的RPMI 1640 培養基中培養,每隔 2 ~ 3 天用 0.25% 胰酶消化傳代。在96 孔板中接種細胞,隔天待細胞貼壁生長融合度達到 90% 時,按照 Lipofectamine 2000 說明書將 pGL4.17-INGAP 和內參質粒 pRL-TK 共轉染細胞,6 h 后用全培養基換掉轉染液,繼續培養 12 ~ 48 h 檢測熒光素酶的表達活性,并對影響轉染效率的因素如質粒與脂質體比例等條件進行優化。
1.2.4 雙熒光素酶活性測定 采用雙熒光素酶報告基因系統,以組成性活性的pRL-TK 作為內對照,使重組質粒的測量結果正態化。具體方法是:將檢測試劑置于室溫平衡后,按照說明書混合配制,待測板中棄去上清,用 PBS 洗 3 次后每孔加20 μl 細胞裂解液(PLB)裂解細胞 20 min,加入螢火蟲熒光素酶 50 μl,通過 Envision 微孔板多功能檢測儀讀取熒光素酶活性數值。然后每孔加海腎熒光素酶混合液 50 μl,立即檢測,讀數。
1.2.5 陽性對照的建立、模型評價及藥物篩選 為評價所構建模型的有效性,在轉染 6 h 后,將已知的陽性化合物 PMA 作用于細胞模型,12 ~ 48 h 后檢測熒光素酶的表達活性,以此來考察 PMA 在該模型上的作用。
采用 Z'因子法評價該模型對高通量篩選的可用性,根據公式Z' = 1 – 3(σc++ σc-)/(μc+– μc-)計算 Z'因子值,其中 μc-和 σc-分別為陰性對照的平均值和標準差,μc+和 σc+分別為陽性對照的平均值和標準差。Z' ≥ 0.5 認為適用于高通量篩選。按照建立的方法對本實驗室保存的 100 余個天然產物進行初步篩選,篩選濃度為 10 μg/ml,并對陽性化合物進行評價。
1.3 統計學處理
2 結果
2.1 DNA 目的片段的體外擴增
以敘利亞金黃地鼠基因組 DNA 為模板擴增目的片段,擴增產物經瓊脂糖凝膠電泳檢測,獲得了預期大小的目的片段(圖 1A),將其克隆至 pGM-T 載體,擴增并提取純化質粒后測序,測序結果與 GenBank(AY184211.1)中收錄的序列有 100% 同源性。
2.2 pGL4.17-INGAP 報告基因重組質粒的構建
對構建的 pGL4.17-INGAP 進行酶切鑒定,結果表明,INGAP 基因上游調控序列定向插入到 pGL4.17 載體的熒光素酶報告基因上游(圖1B),成功構建了重組質粒 pGL4.17-INGAP。
2.3 瞬時轉染條件的建立與優化
以轉染 pGL4.17-basic 質粒的 HIT-T15 細胞作為陰性對照,檢測轉染了重組質粒 pGL4.17-INGAP 的細胞熒光素酶活性,結果表明,后者的熒光素酶表達活性明顯增高,說明該啟動子片段能夠促進熒光素酶的表達。同時對質粒濃度和重組質粒與內參質粒比例進行優化,當DNA:Lipofectamine 2000 比例為 1:3(w:V)、pGL4.17-INGAP:pRL-TK 比例為 100:1 時,轉染效率最高(圖2,n = 3)。
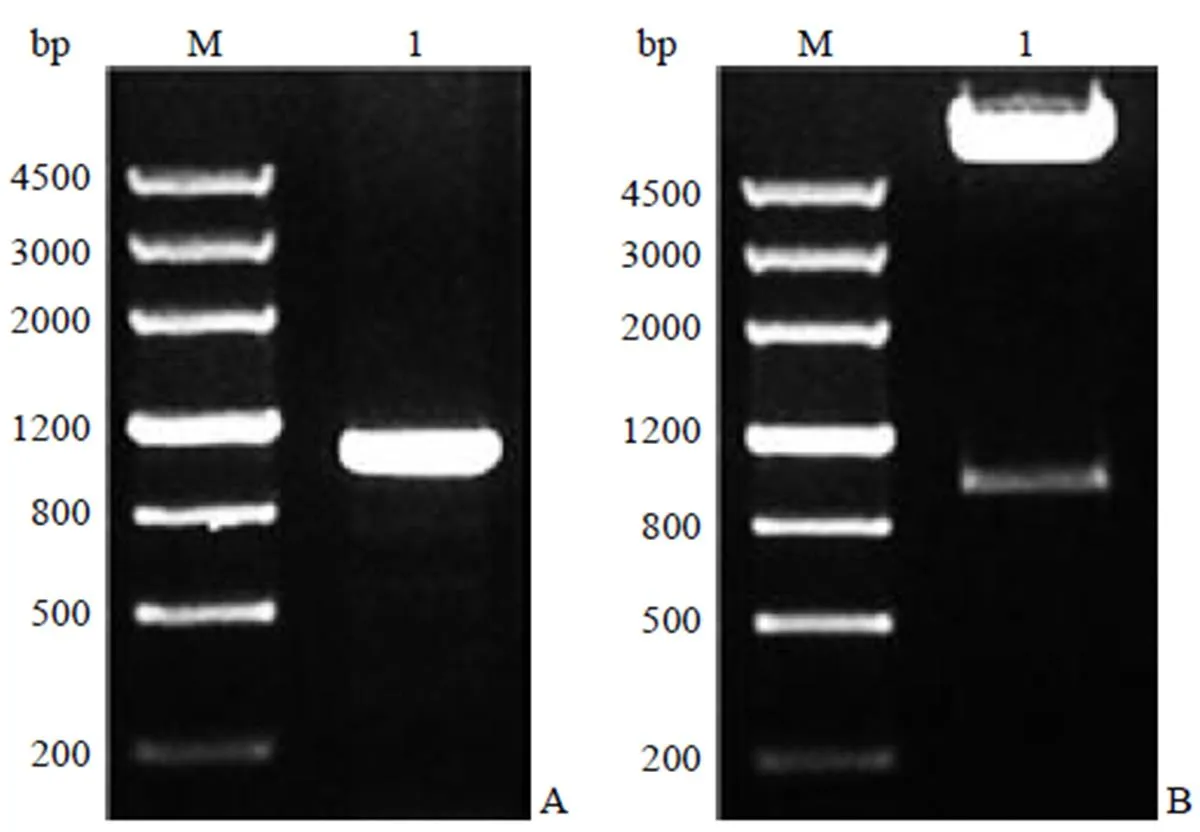
A:M:DNA 分子量標準;1:INGAP 啟動子序列PCR 擴增產物 B:M:DNA 分子量標準;1:pGL4.17-INGAP 經Xho I和Bgl II雙酶切電泳結果
Figure 1 PCR product of INGAP promoter (A) and restriction enzymatic analysis of recombinant plasmid pGL4.17-INGAP (B)
2.4 陽性對照的建立及模型評價
2.4.1 溶劑對熒光素酶活性的影響 在化合物篩選過程中,樣品一般溶解在 DMSO 中。實驗結果表明,當 DMSO 濃度小于 0.1% 時,基本不會對本模型產生明顯影響(圖 3A),因此,DMSO 的終濃度不能高于0.1%。
2.4.2 陽性化合物濃度對熒光素酶活性的影響 由于目前沒有能夠特異上調INGAP 的陽性藥物的報道,根據文獻選擇化合物 PMA 作為陽性對照[8],并對PMA 在該篩選模型上的最佳作用濃度進行探索。結果表明,當 PMA 濃度小于100 ng/ml 時,相對熒光素酶活性值隨著 PMA 濃度的增加而升高,呈現濃度依賴性(圖 3B),與文獻[8]報道一致,說明 PMA 能有效作用于該模型,提示 PMA 對 INGAP 基因表達的上調作用可以通過熒光素酶的表達活性反映出來。
2.4.3 化合物作用時間對熒光素酶活性的影響 轉染后 6 h 加入 PMA,分別在加藥后 20、24、30、42、72 h 檢測熒光素酶的表達活性。結果顯示,加藥后 30 h,熒光素酶表達活性隨著時間延長而升高,超過 30 h 后隨著時間延長活性降低,因此選擇最佳作用時間為 30 h(圖 3C)。
2.4.4 模型評價 以 PMA 為陽性對照,以 Z'因子為指標對模型進行評價,結果表明,本研究建立的模型 Z'因子為 0.57,優于進行高通量篩選試驗所要求的大于 0.5 的標準,說明本研究建立的以 INGAP 啟動子為靶點的基因表達上調劑篩選模型穩定可靠,適用于進行高通量篩選。
2.5 化合物初步篩選結果
應用該模型對本實驗室保存的天然產物進行篩選,上調率 150% 視為陽性,發現白藜蘆醇對 INGAP 啟動子上調作用明顯。用不同濃度的白藜蘆醇作用于 pGL4.17-INGAP-HIT 細胞,結果顯示,白藜蘆醇對啟動子的上調作用呈現濃度依賴性,半數有效濃度為 1.6 μg/ml(圖 4A)。MTT 比色法檢測白藜蘆醇對 HIT-T15 細胞增殖活力的影響,發現其對細胞毒性較小,IC50= 34.27 μg/ml(圖 4B)。
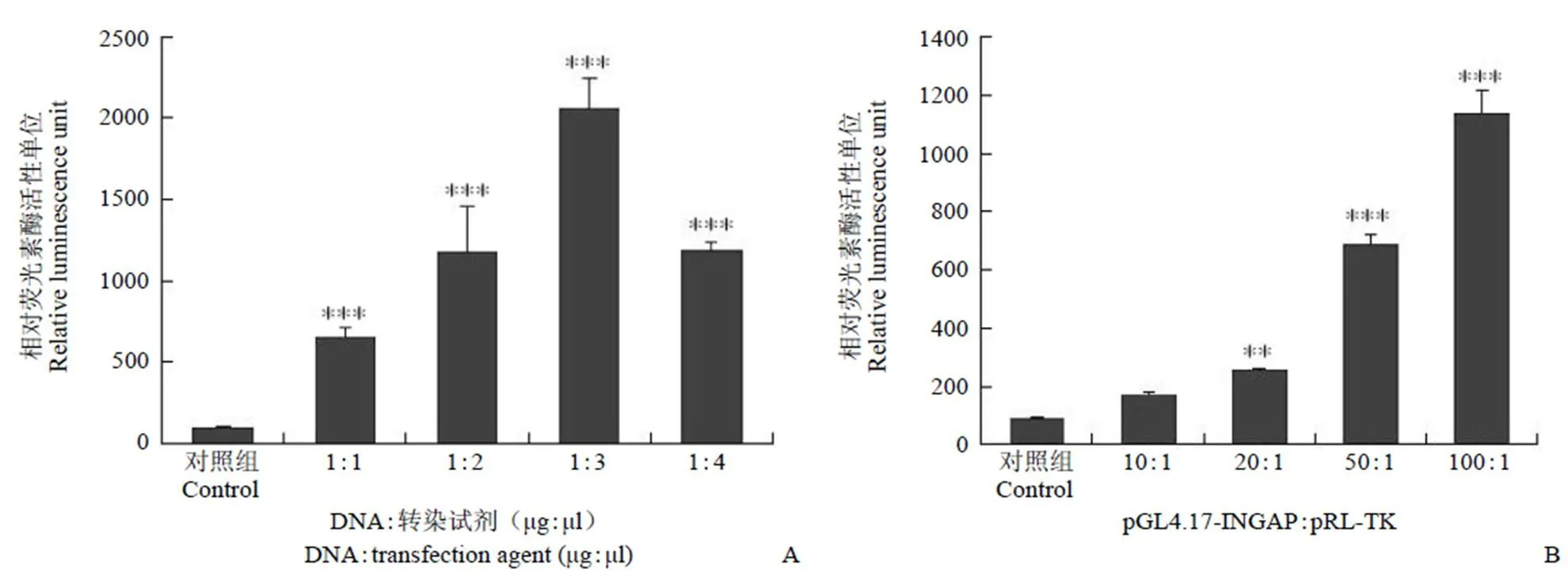
A:轉染試劑濃度對熒光素酶活性的影響(***P < 0.001 vs 對照組);B:重組質粒與內參質粒比例對熒光素酶活性的影響(**P < 0.05 vs 對照組;***P < 0.001 vs 對照組)
Figure 2 Establishment and optimization of the transient transfection model
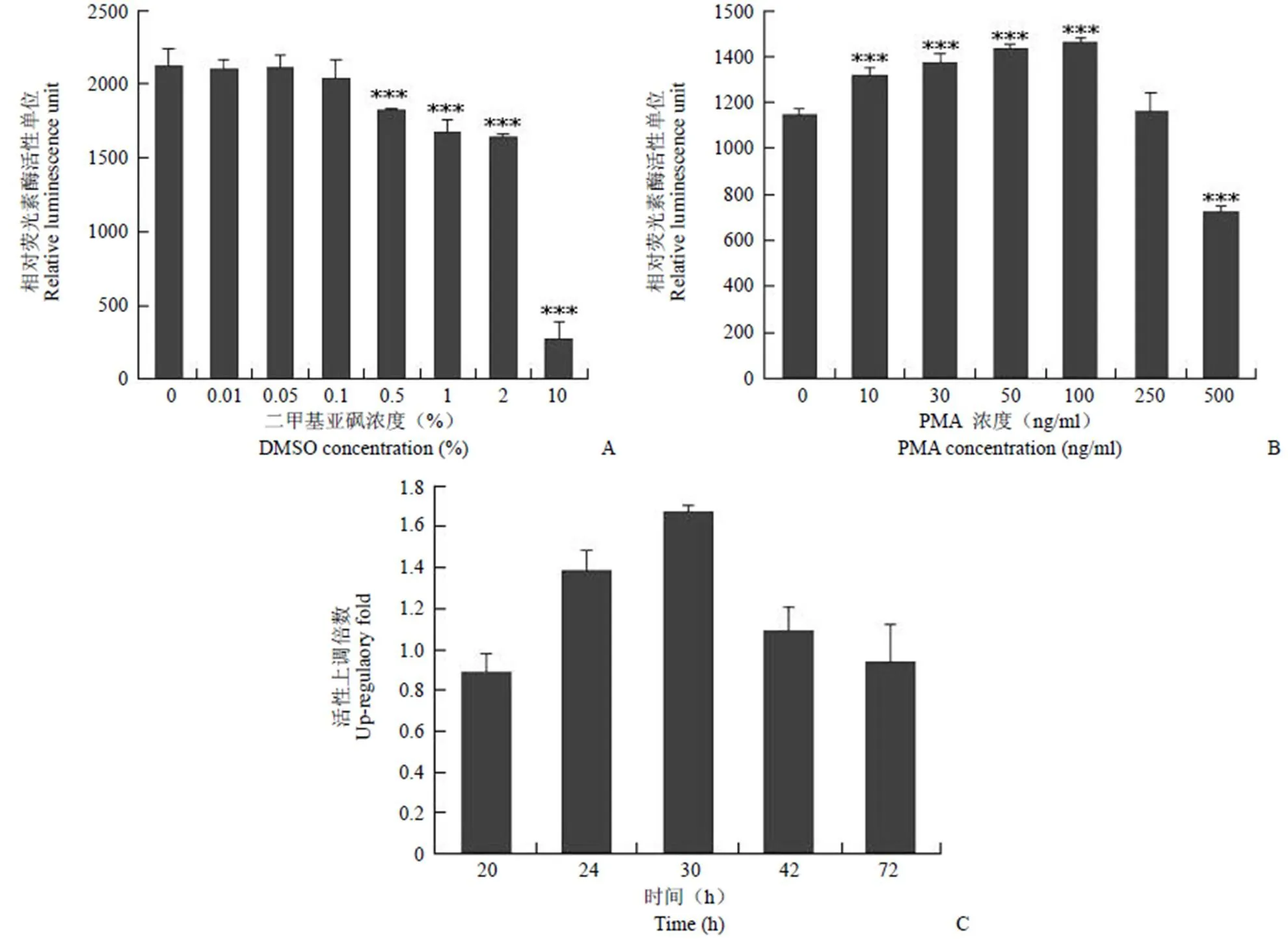
A:DMSO 濃度對熒光素酶活性的影響(***P < 0.001 vs 對照組);B:PMA 濃度對熒光素酶活性的影響(***P < 0.001 vs 對照組);C:化合物作用時間對熒光素酶活性的影響
Figure 3 The establishment and optimization of the positive control
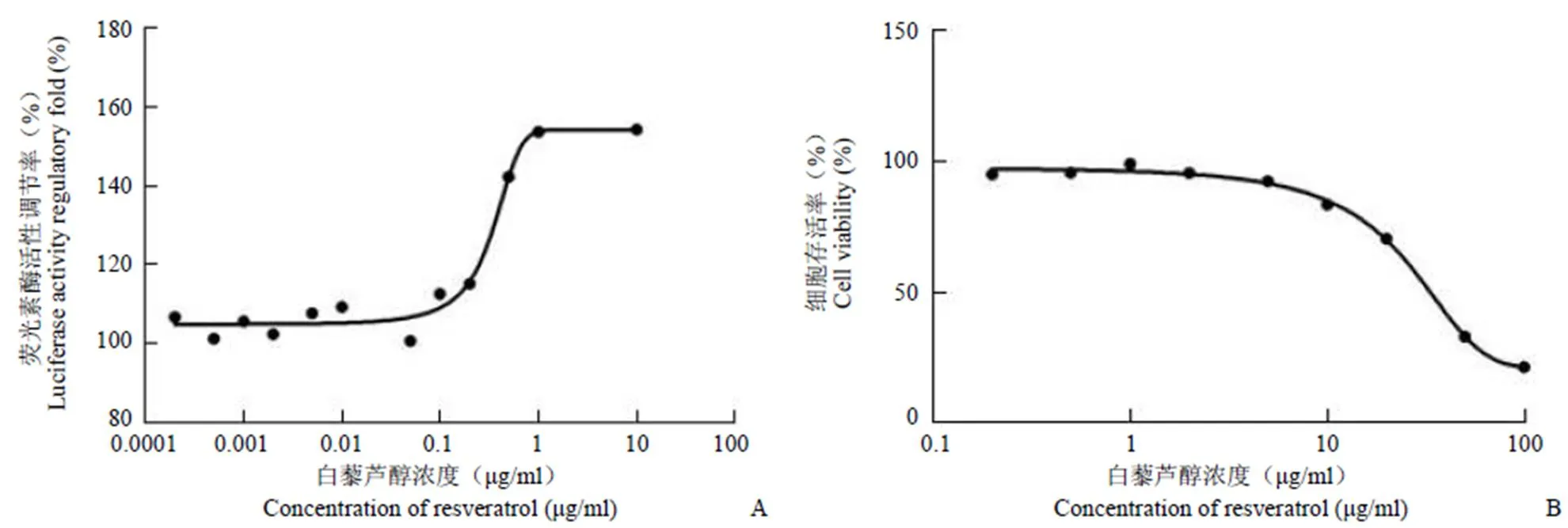
A:白藜蘆醇對pGL4.17-INGAP-HIT 細胞熒光素酶活性的影響;B:白藜蘆醇的細胞毒性檢測
Figure 4 Related bioactive research of resveratrol
3 討論
INGAP 是一個由 175 個氨基酸組成的、分子量為 16.8 kD 的分泌蛋白,屬于C 型凝集素超家族中的 Reg-III家族,主要在胰腺和小腸表達,在肝臟中也有少量表達[6]。INGAP 啟動子序列長約3 kb,包括了 TATA-box、CAAT box、AP-1 等通用轉錄因子結合位點,還包括胰腺特有的轉錄因子結合位點,這些轉錄因子包括 PDX-1、PAN-1、Isl-1、Ngn3、NeuroD 等,在胰腺細胞分化過程中起到重要的指向作用,直接影響 INGAP 啟動子的活性[8-9]。我們選擇 HIT-T15 細胞作為載體,該細胞雖然高度分化,但仍保留了正常胰島細胞的很多功能,能夠內源性表達 PDX-1、NeuroD 和 PAN-1等相關轉錄因子[10],提供了比較真實的 INGAP 在胰腺中表達的天然環境。另外,本研究選取的 INGAP 基因啟動子序列,包括了轉錄起始位點和若干重要的順式作用調控元件等核心啟動子區域,能夠較好地反映活性物質在體內的綜合作用效果。
構建的模型采用雙熒光素酶檢測系統作為檢測手段,以海腎熒光素酶質粒作為內參,通過內參的校正能夠把影響細胞瞬時轉染準確性的內在因素的變化降到最小,并且利用該模型進行篩選時,只需關注相對熒光素酶活性的變化,方法簡便、快捷、準確、靈敏性高[11]。
利用該研究建立的模型對本研究所化合物庫進行篩選,發現白藜蘆醇對INGAP 啟動子有明顯上調作用,EC50= 1.6 μg/ml,具有深入研究的價值。白藜蘆醇是天然的多酚類化合物,多存在于葡萄和紅酒中,具有抗氧化、抗炎、激活抗衰老酶 sirtuin 等多種藥理特性[12]。已有研究表明,白藜蘆醇能夠促進葡萄糖攝取、提高肝糖耐受量和對胰島素的敏感性,可能的機制是白藜蘆醇激活 SIRT-1,通過影響機體代謝水平來發揮降血糖作用,也可能是通過抑制胰島 β 細胞 KATP通道或者激活 GLP-1 途徑以促進胰島素分泌[12-15],但其與 INGAP 的關系尚無報道,那么,白藜蘆醇的抗糖尿病作用是否與上調 INGAP 有關,我們將繼續進行深入的研究。
綜上所述,本研究構建了以 INGAP 啟動子為靶點的基因表達上調劑篩選模型,并篩選到了一個具有明顯上調作用的化合物白藜蘆醇。此模型的建立對探討基于 INGAP 藥物的分子作用機制以及探索開發新型糖尿病治療藥物都具有重要的意義。
[1] Al-Baharna MM, Whitford DL. Clinical audit of diabetes care in the bahrain defence forces hospital. Sultan Qaboos Univ Med J, 2013, 13(4):520-526.
[2] Bell GI, Polonsky KS. Diabetes mellitus and genetically programmed defects in beta-cell function. Nature, 2001, 414(6865):788-791.
[3] Pittenger GL, Taylor-Fishwick D, Vinik AI. The role of islet neogeneis-associated protein (INGAP) in pancreatic islet neogenesis. Curr Protein Pept Sci, 2009, 10(1):37-45.
[4] Lee CS, De León DD, Kaestner KH, et al. Regeneration of pancreatic islets after partial pancreatectomy in mice does not involve the reactivation of neurogenin-3. Diabetes, 2006, 55(2):269-272.
[5] Lipsett M, Hanley S, Castellarin M, et al. The role of islet neogenesis-associated protein (INGAP) in islet neogenesis. Cell Biochem Biophys, 2007, 48(2-3):127-137.
[6] Borelli MI, Del Zotto H, Flores LE, et al. Transcription, expression and tissue binding in vivo of INGAP and INGAP-related peptide in normal hamsters. Regul Pept, 2007, 140(3):192-197.
[7] Dungan KM, Buse JB, Ratner RE. Effects of therapy in type 1 and type 2 diabetes mellitus with a peptide derived from islet neogenesis associated protein (INGAP). Diabetes Metab Res Rev, 2009, 25(6): 558-565.
[8] Taylor-Fishwick DA, Rittman S, Kendall H, et al. Cloning genomic INGAP: a Reg-related family member with distinct transcriptional regulation sites. Biochim Biophys Acta, 2003, 1638(1):83-89.
[9] Taylor-Fishwick DA, Shi W, Pittenger GL, et al. PDX-1 can repress stimulus-induced activation of the INGAP promoter. J Endocrinol, 2006, 188(3):611-621.
[10] Taylor-Fishwick DA, Shi W, Hughes L, et al. Pdx-1 regulation of the INGAP promoter involves sequestration of NeuroD into a non-DNA-binding complex. Pancreas, 2010, 39(1):64-70.
[11] Alcaraz-Pérez F, Mulero V, Cayuela ML. Application of the dual-luciferase reporter assay to the analysis of promoter activity in Zebrafish embryos. BMC Biotechnol, 2008, 8:81.
[12] Yu W, Fu YC, Wang W. Cellular and molecular effects of resveratrol in health and disease. J Cell Biochem, 2012, 113(3):752-759.
[13] Pollack RM, Crandall JP. Resveratrol: therapeutic potential for improving cardiometabolic health. Am J Hypertens, 2013 Sep 11. [Epub ahead of print]
[14] Timmers S, Hesselink MK, Schrauwen P. Therapeutic potential of resveratrol in obesity and type 2 diabetes: new avenues for health benefits? Ann N Y Acad Sci, 2013, 1290:83-89.
[15] Jimenez-Gomez Y, Mattison JA, Pearson KJ, et al. Resveratrol improves adipose insulin signaling and reduces the inflammatory response in adipose tissue of rhesus monkeys on high-fat, high-sugar diet. Cell Metab, 2013, 18(4):533-545.
Establishment and preliminary application of a screening model for identifying up-regulators of INGAP expression
ZHANG Xu-meng, WANG Lin-lin, REN Hao, HE Qi-yang, CHEN Ru-xian, XIE Yun-ying
To establish a screening model for identifying up-regulators of INGAP expression and screen active compounds.
Syrian golden hamster genome was used as template to amplify the core promoter sequence of INGAP. Then the obtained promoter fragment was cloned into pGL4.17 vector to construct the recombinant plasmid which subsequently was co-transfected into HIT-T15 cell line together with the internal reference plasmid pRL-TK using Lipofectamine 2000. The luciferase activity was detected using dual-luciferase reporter assay system in 96-well format. After optimizing the conditions of transient transfection, PMA was used as positive control to assess the validation of the model. The compounds in the library of our institute were then screened.
The recombinant plasmid named pGL4.17-INGAP was constructed and successfully transfected into HIT-T15 cell strain. The model was evaluated by positive control after optimization, and Z' factor is 0.57, showing that the model was able to use for screening up-regulators. Among the screened compounds, resveratrol showed up-regulated activity with EC50value of 1.6 μg/ml.
The cellular screening model for identifying up-regulators of INGAP expression was established.
Transcription initiation site; Drug evaluation, preclinical; Islet neogenesis associated protein
XIE Yun-ying, Email: xieyy@imb.pumc.edu.cn
10.3969/cmba.j.issn.1673-713X.2014.05.003
國家自然科學基金面上項目(81072556);十二五“重大新藥創制”國家科技重大專項(2012ZX09301-002-001-018)
解云英,Email:xieyy@imb.pumc.edu.cn
2013-12-03
Author Affiliation: Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China

