糖尿病大鼠血糖波動下SOD、MDA、NO變化及丹蛭降糖膠囊的干預作用
吳元潔,鄭書國,方朝暉,吳元波,吳傳云,王玉鳳,劉曉麗,張曉軍
(1.安徽中醫藥大學,安徽合肥 230038;2.皖南醫學院,安徽蕪湖 241002;3.安徽中醫藥大學第一附屬醫院,安徽合肥 230031;4.安徽醫科大學附屬省立醫院,安徽合肥 230001)
近年來,血糖波動已日益成為糖尿病及其慢性并發癥研究的新熱點,研究表明糖尿病慢性并發癥的發生發展與血糖波動密切關聯,血糖波動是氧化應激的可能參與機制[1-2]。中藥復方以其整體調治,療效穩定,副作用小的優勢,在糖尿病防治上的作用日趨受到重視,臨床研究發現益氣養陰活血中藥丹蛭降糖膠囊對糖尿病有良好的療效[3],該藥是否對血糖波動存在影響尚值得進一步研究。本實驗擬從超氧化物歧化酶 (SOD)、丙二醛(MDA)、一氧化氮 (NO)等指標探討丹蛭降糖膠囊對波動血糖的影響,為糖尿病波動血糖的防治研究提供一定的實驗依據。
1 材料與方法
1.1 實驗動物 Sprague-Dawley雄性大鼠120只,體質量 (180±20)g,由安徽省實驗動物中心提供,動物質量合格證號:scxk(皖)2011-002。實驗過程中對動物處置符合動物倫理學要求。
1.2 藥物與試劑 丹蛭降糖膠囊由太子參、生地黃、牡丹皮、菟絲子、澤瀉、水蛭等藥物組成,是安徽中醫藥大學第一附屬醫院院內制劑 (皖藥制字Z20050066),批號為20061215,為該院制劑中心按照成熟的水提工藝生產,檢測標準為以HPLC法測定丹皮酚和芍藥苷,每1粒膠囊中兩成分的量分別不低于1.0 mg和0.1 mg;臨用時以蒸餾水加適量CMC-Na配置成一定質量濃度。每粒相當于生藥0.5 g,成人用量6 g/d;鏈脲佐菌素 (streptozotocin,STZ)購自美國Sigma公司,4℃保存,新鮮配制使用;檸檬酸及檸檬酸鈉購自天津市津宏化工有限公司;血糖儀及同批號血糖試紙購自德國貝朗公司;普通胰島素購自江蘇萬邦生化醫藥公司;125I胰島素放免試劑盒購自中國原子能科學研究院同位素研究所;超氧化物歧化酶、丙二醛、一氧化氮、蛋白定量試劑盒購自南京建成生物工程研究所。
1.3 糖尿病大鼠血糖波動模型的建立方法 大鼠自由飲水,在22℃,相對濕度50%的飼養環境中適應性喂養1周。隨機取15只作為正常組,其余大鼠禁食12 h后,用檸檬酸緩沖液 (0.1 mmol/L,pH 4.4)溶解配制成含1%STZ溶液,以50 mg/kg STZ腹腔注射誘發糖尿病。注射STZ 72 h取大鼠尾靜脈血,用血糖儀測定隨機血糖值 (最大血糖值為33.3 mmol/L,更高的血糖值儀器顯示為High,按33.3 mmol/L計算),造模10 d血糖穩定后,隨機血糖水平≥16.7 mmol/L為造模成功的大鼠,作為糖尿病模型大鼠。造模成功率約80%。取糖尿病模型大鼠80只,按血糖分層隨機分為持續高血糖組、波動血糖組、波動血糖+中藥高劑量組、波動血糖+中藥低劑量組,每組20只,波動血糖模型及用藥組大鼠每周檢測2次8∶00和18∶00的血糖值,并根據這兩個時間點的血糖水平,每日于8∶00和18∶00根據血糖情況分別皮下注射普通胰島素或灌胃葡萄糖,即當血糖值≥16.7 mmol/L時皮下注射1~3 U普通胰島素,當血糖值<16.7 mmol/L時,則灌胃葡萄糖2 g/kg體質量,造成1日內大鼠血糖濃度大幅波動模型。正常組和持續高血糖組大鼠以相同給藥方式給予同體積生理鹽水。共6周。
1.4 給藥方法 波動血糖+中藥高劑量組、波動血糖+中藥低劑量組大鼠按人與大鼠單位體質量折算系數 (以大鼠200 g與人70 kg比較,折算系數為0.018),給予丹蛭降糖膠囊灌胃,以體質量60 kg成人用量6 g/d計算,則波動血糖+中藥高劑量組、波動血糖+中藥低劑量組大鼠分別予以丹蛭降糖膠囊0.63 g/(kg·d)、1.26 g/(kg·d)灌胃,其他3組灌胃等體積生理鹽水。給藥6周。
1.5 標本采集 實驗末次給藥后禁食12 h,各組大鼠按40 mg/kg體質量以1%戊巴比妥鈉溶液行腹腔注射麻醉,腹主動脈抽血,離心取血清保存;處死大鼠后切取部分胰尾組織,以10%中性甲醛液固定,行HE檢測;取0.4 g胰腺組織制備成10%勻漿,離心取上清液保存。
1.6 觀察指標及檢測方法
1.6.1 一般情況觀察 觀察各組大鼠精神狀態,毛色,體質量,進食,尿量等。
1.6.2 各組大鼠1日5次血糖水平及血糖穩定性每周1次,測1 d內8∶00、10∶00、16∶00、18∶00、20∶00血糖水平,并描繪血糖波動6周后各組大鼠1 d內8∶00、10∶00、16∶00、18∶00、20∶00血糖變化趨勢曲線。用血糖日平均水平(MBG)、日平均血糖的標準差 (SDBG)、最大血糖波動幅度 (LAGE,日內血糖最高值與最低值之差)量化血糖穩定性,計算血糖波動6周后各組大鼠MBG、SDBG、LAGE值。
1.6.3 血清及胰腺組織SOD、MDA、NO檢測以酶標儀測定血清和胰腺SOD、MDA、NO。勻漿蛋白濃度采用微量雙縮脲法,MDA采用TBA比色法,SOD采用黃嘌呤氧化酶法,NO采用硝酸還原酶法測定。
1.6.4 空腹血清胰島素 (FINS) 采用放免法測定。
1.6.5 胰腺形態學變化 胰尾組織經10%中性甲醛液固定后常規石蠟包埋,4 μm切片,行HE染色。光鏡下觀察胰腺形態學變化。
1.7 統計學分析 采用SPSS 20.0軟件進行統計。數據行正態分布檢驗,符合正態分布用單因素多水平設計定量資料的方差分析,并進行方差齊性分析,方差齊用LSD檢驗,方差不齊用Tamhane's T2檢驗,數據以表示;非正態分布進行多個獨立樣本非參數檢驗,數據以中位數 (M)與四分位間距 (Q)表示;大鼠1日血糖變化用兩因素重復測量設計定量資料的方差分析。相關分析采用Pearson相關分析。各種檢驗的顯著性水平設定為P <0.05。
2 結果
2.1 一般情況 造模后持續高血糖組大鼠精神萎靡,行動遲緩,對外界反應遲鈍,毛色無光澤,易臟,進食減少,飲水量、尿量增加,尿液腥臊味加重,多數大鼠體質量明顯降低,部分大鼠尿路感染,皮膚出現潰爛、膿腫,波動血糖組較持續高血糖組癥狀更明顯,部分大鼠出現白內障表現。波動血糖+中藥高劑量組、波動血糖+中藥低劑量組大鼠較兩模型組精神明顯好轉,活動力較強,反應較靈敏,毛色較光澤,尿液腥臊味減輕,體質量較兩模型組亦明顯增加。波動6周后,正常組、持續高血糖組、波動血糖組、波動血糖+中藥高劑量組、波動血糖+中藥低劑量組大鼠因感染、嚴重并發癥、灌胃操作不當等原因分別死亡2只、7只、7只、6只、7只。
2.2 血糖波動6周后各組大鼠1日5點時間血糖變化及血糖日平均水平、日平均血糖的標準差、最大血糖波動幅度 見圖1、表1。圖1可看出,波動血糖組大鼠血糖在8∶00較高,然后呈下降趨勢至10∶00血糖降至最低,之后血糖持續上升至18∶00達高峰,然后下降。在1日內形成2個明顯的血糖波動高峰和低谷;兩用藥組大鼠血糖波動趨勢基本和波動血糖組一致,但血糖變化趨勢相對平緩;持續高血糖組血糖變化趨勢較波動血糖組亦相對平緩,在8∶00最高,然后下降,至10∶00血糖降至最低,之后持續呈上升趨勢至20∶00達最高。正常組血糖1日內血糖變化幅度最小,基本保持穩定低值。單因素多水平方差分析顯示:與正常組比較,其他4組MBG、SDBG、LAGE明顯升高,差異有統計學意義 (P<0.01);與持續高血糖組比較,波動血糖組大鼠SDBG、LAGE明顯增高,MBG降低,差異有統計學意義 (P<0.01);兩用藥組MBG、SDBG、LAGE與波動血糖組比較均有減少的趨勢,但差異無統計學意義。

圖1 血糖波動6周后各組大鼠1日5點血糖變化趨勢Fig.1 Intraday variation of blood glucose in diabetic rats
表1 血糖波動6周后各組大鼠血糖日平均水平、日平均血糖標準差、最大血糖波動幅度變化 ()Tab.1 Changes in MBG,SDBG and LAGE in rats after blood glucose fluctuation for 6 weeks()

表1 血糖波動6周后各組大鼠血糖日平均水平、日平均血糖標準差、最大血糖波動幅度變化 ()Tab.1 Changes in MBG,SDBG and LAGE in rats after blood glucose fluctuation for 6 weeks()
注:與正常組比較,*P <0.05,**P <0.01;與持續高血糖組比較,△P <0.05,△△P <0.01
組別 動物數 血糖日平均水平/(mmol·L-1) 日平均血糖標準差/(mmol·L-1)最大血糖波動幅度/(mmol·L-1)13 5.77±0.21 0.41±0.13 0.50±0.28持續高血糖組 13 29.83±1.97** 2.58±0.85** 5.29±2.24**波動血糖組 13 22.31±5.97**△△ 8.86±1.63**△△ 16.22±5.14**△△波動血糖+中藥高劑量組 14 21.38±4.05**△△ 7.10±2.02**△△ 9.61±4.60**波動血糖+中藥低劑量組 13 21.74±4.01** 8.09±1.38**△△ 10.89±4.56正常組**△△
2.3 血糖波動6周后各組大鼠空腹血清胰島素水平 見表2。經多個獨立樣本比較的Kruskal-Wallis H檢驗,血糖波動6周后5組大鼠FINS水平χ2=14.179,P=0.007,FINS水平總體分布存在顯著性差異,其中正常組大鼠FINS水平最高 (平均秩45.50),波動血糖組大鼠FINS水平最低 (平均秩19.13)。持續高血糖組、波動血糖組、波動血糖+中藥低劑組與正常組FINS水平差異有統計學意義 (P<0.05,P<0.01);波動血糖+中藥高劑組FINS與波動血糖組相比,差異有統計學意義(P<0.05);波動血糖組與持續高血糖組FINS水平比較,差異則無統計學意義 (P>0.05)。

表2 血糖波動6周后各組大鼠空腹血清胰島素水平Tab.2 Levels of FINS in rats after blood glucose fluctuation for 6 weeks
2.4 各組大鼠氧化應激相關指標變化比較 見表3。單因素多水平方差分析顯示:與正常組比較,持續高血糖組、波動血糖組大鼠血清SOD、胰腺SOD水平明顯降低,血清MDA、胰腺MDA水平明顯升高 (P<0.01);持續高血糖組血清NO水平明顯升高 (P<0.05),持續高血糖組、波動血糖組胰腺NO水平明顯升高 (P<0.05,P<0.01)。與波動血糖組比較,波動血糖+中藥高劑量組、波動血糖+中藥低劑量組血清SOD水平明顯升高(P<0.01);而中藥兩組血清MDA、NO以及胰腺MDA、NO水平較波動血糖組有降低趨勢,胰腺SOD水平有上升趨勢,其中,波動血糖+中藥低劑量組血清MDA和胰腺SOD與波動血糖組之間差異有統計學意義 (P<0.05)。
表3 各組大鼠血清及胰腺SOD、MDA、NO比較 ()Tab.3 Levels of SOD,MDA,NO in serum and pancreatic tissue of rats()
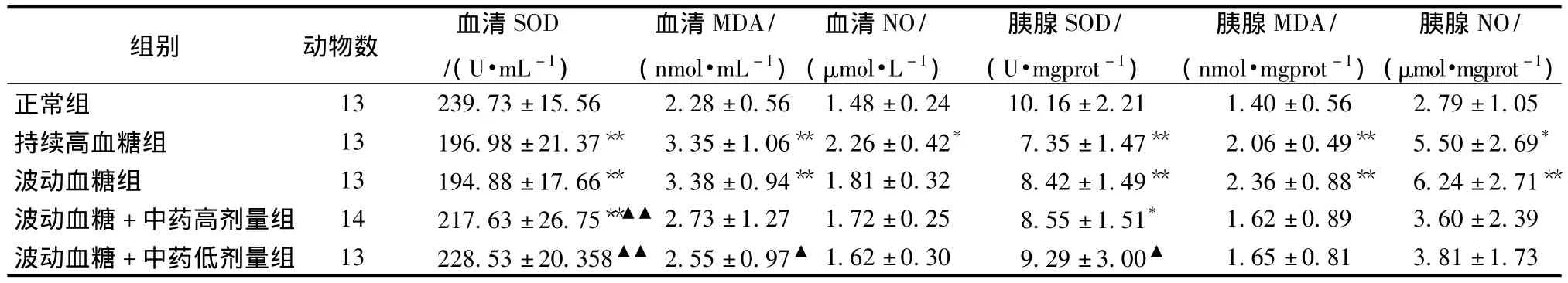
表3 各組大鼠血清及胰腺SOD、MDA、NO比較 ()Tab.3 Levels of SOD,MDA,NO in serum and pancreatic tissue of rats()
注:與正常組比較,*P <0.05,**P<0.01;與波動血糖組比較,▲P <0.05,▲▲P <0.01
組別 動物數 血清SOD/(U·mL-1)血清MDA/(nmol·mL-1)血清NO/(μmol·L-1)胰腺SOD/(U·mgprot-1)胰腺MDA/(nmol·mgprot-1)胰腺NO/(μmol·mgprot-1)正常組 13 239.73±15.56 2.28±0.56 1.48±0.24 10.16±2.21 1.40±0.56 2.79±1.05持續高血糖組 13 196.98±21.37** 3.35±1.06**2.26±0.42* 7.35±1.47** 2.06±0.49** 5.50±2.69*波動血糖組 13 194.88±17.66** 3.38±0.94**1.81±0.32 8.42±1.49** 2.36±0.88** 6.24±2.71**波動血糖+中藥高劑量組 14 217.63±26.75**▲▲ 2.73±1.27 1.72±0.25 8.55±1.51* 1.62±0.89 3.60±2.39波動血糖+中藥低劑量組 13 228.53±20.358▲▲ 2.55±0.97▲ 1.62±0.30 9.29±3.00▲1.65±0.81 3.81±1.73
2.5 相關性分析 Pearson相關分析顯示血清SOD與血清NO(r=-0.317,P<0.05)、胰腺NO(r=-0.408,P<0.01)呈負相關,血清MDA與血清NO呈正相關 (r=0.330,P<0.01),胰腺MDA與胰腺NO呈正相關 (r=0.574,P<0.01);SDBG與FINS呈負相關 (r=-0.328,P<0.01),SDBG與胰腺NO呈正相關 (r=0.250,P<0.05),LAGE與FINS負相關 (r=-0.303,P<0.05)。
2.6 各組大鼠胰島組織形態學變化 見圖2。正常組大鼠胰島形態規則呈圓形,數量較多,細胞核呈圓形藍色著染,胞質豐富淺粉色著染;持續高血糖組和波動血糖組大鼠均可見胰島萎縮,β細胞數量減少,顆粒脫失,空泡變性,部分β細胞體積代償性增大等,波動血糖組病理表現尤為嚴重;波動血糖+中藥高劑量組、波動血糖+中藥低劑量組大鼠仍有部分β細胞體積代償性增大,但較持續高血糖組和波動血糖組胰島明顯增大,形狀較規則。
3 討論

圖2 各組大鼠胰島組織形態學變化 (HE×400)Fig.2 Morphologic variations of rat pancreatics islets(HE×400)
與糖調節正常人群相比,糖尿病患者由于胰島β細胞功能缺陷、胰島素抵抗等因素,導致血糖調節機制障礙,從而引起持續性或間歇性的血糖波動。本研究在腹腔注射鏈脲佐菌素建立糖尿病持續高血糖模型的基礎上,通過每日2次皮下注射普通胰島素或灌服葡萄糖誘導糖尿病血糖波動模型,采用MBG、SDBG、LAGE等量化指標評價血糖的穩定性。實驗發現糖尿病持續高血糖模型和血糖波動模型組大鼠MBG、SDBG、LAGE較正常組明顯增高 (P<0.05,P<0.01),而血糖波動模型組SDBG、LAGE顯著高于持續高血糖模型組 (P<0.01),說明糖尿病波動血糖模型成功,同時也反映了糖尿病高血糖狀態較糖調節正常狀態而言,本身也存在著一定的血糖波動。
血糖波動狀態較持續性高糖更能誘導胰島和INS-1細胞分泌胰島素功能損傷。Guerra等[4]體外實驗研究發現,與正常血糖 (5.5 mmol/L)培養的人胰島β細胞相比,波動葡萄糖刺激處理 (5.5與16.7 mmol/L隔日交替)的β細胞胰島素釋放功能受損,細胞凋亡增加;體內實驗研究[5]亦證實波動性高血糖較持續性高血糖更能抑制GK大鼠胰島素釋放功能和胰島素相關基因表達,對β細胞損害更為明顯。本實驗發現血糖波動6周后持續高血糖組和血糖波動組SD大鼠FINS水平明顯低于正常組 (P<0.05,P<0.01),其中血糖波動組FINS水平最低;大鼠胰島組織形態學顯示糖尿病模型組大鼠胰島萎縮,β細胞數量減少,部分β細胞體積代償性增大,細胞凋亡,以血糖波動模型組病理表現尤為嚴重。相關分析顯示SDBG、LAGE與FINS呈負相關。提示血糖波動與胰島素相關,且較持續高血糖對胰島素的損傷更加嚴重。
活性氧簇 (ROS)如超氧陰離子和過氧化氫和活性氮基團 (RNS)如一氧化氮、過氧亞硝酸鹽的生理信號功能的紊亂被認為是糖尿病的重要特征[6]。有研究表明血糖波動易引發氧化應激,Stadler等[7]研究認為氧化應激是糖尿病慢性并發癥的主要發病機制之一。Monnier等[8]發現尿中8-iso-PGF(2α)排出率與血糖波動強度呈高度正相關。氧化應激狀態下產生了過量的ROS,引起DNA、蛋白質、脂質氧化的損傷,胰島β細胞由于氧自由基清除酶水平很低而最易被損傷。Bian等[9]通過多元線性逐步回歸分析發現住院糖尿病患者平均血糖波動幅度 (MAGE)是精氨酸刺激試驗C肽增值 (ACP)的獨立影響因素,認為血糖波動對胰島β細胞功能的損傷較持續性的高血糖更嚴重。另外,活性氧 (ROS)與NO關系亦較密切。NO是由L-精氨酸在一氧化氮合成酶 (NOS)催化下合成的。一經產生,NO即能迅速與超氧陰離子()產生強大的有毒氧化劑過氧化亞硝酸鹽(ONOO-),由于NO與超氧陰離子反應形成ONOO-的速度比銅/鋅超氧化物歧化酶與超氧陰離子的反應速度快6倍[10],且胰島β細胞本身的氧自由基清除酶水平很低,所以過氧化亞硝酸鹽對線粒體功能和DNA合成造成嚴重的毒性作用,不僅能直接氧化和損傷胰島細胞DNA、蛋白質、脂質,還可能影響蛋白激酶C和B,磷脂酰肌醇3'-激酶,細胞外信號調節激酶催化的酶/基因調控的細胞內信號傳導,導致胰島素基因表達障礙[7]。有實驗通過外源性的一氧化氮對大鼠胰島細胞、肝細胞、居民活化的巨噬細胞、主動脈內皮細胞和小鼠腫瘤細胞系等不同細胞的毒性作用比較,證實胰島細胞是上述細胞中對NO最敏感的細胞,推斷NO可在胰島炎導致的胰島素依賴型糖尿病中發揮著重要作用[11]。本實驗發現糖尿病大鼠較正常組血清和胰腺SOD水平明顯降低,MDA水平明顯升高 (P<0.01);MDA為脂質過氧化產物的標志,SOD是評價抗氧化能力的經典指標,SOD水平明顯降低,MDA水平明顯升高說明糖尿病持續高血糖和波動血糖狀態下均存在明顯的氧化應激。實驗亦發現持續高血糖組血清和胰腺NO水平明顯升高,波動血糖組胰腺 NO水平明顯升高 (P<0.05,P<0.01),相關分析顯示血清SOD與血清NO以及胰腺NO均呈負相關;血清MDA與血清NO呈正相關;胰腺MDA與胰腺NO呈正相關。說明糖尿病持續高血糖和波動血糖狀態下抗氧化能力減低以及脂質過氧化產物的增加均與NO有關。
糖尿病病機復雜,中醫整體觀念的認識觀符合糖尿病的診治模式。糖尿病屬于中醫“消渴”范疇,以“氣虛陰虧血瘀”為基本病機,丹蛭降糖膠囊以太子參補益脾腎之氣,生地黃滋養脾腎之陰,菟絲子補腎固精;丹皮、水蛭行氣化瘀通絡;澤瀉清熱瀉濁。共奏益氣養陰,活血化瘀之功,在改善糖尿病癥狀、胰島細胞功能及氧化應激等方面有良好作用[12-14]。為研究其對糖尿病血糖波動大鼠的影響,本實驗對糖尿病血糖波動大鼠進行了6周的丹蛭降糖膠囊治療,發現中藥高低劑量組的大鼠胰島較兩組模型組明顯增大,血清胰島素水平高于血糖波動組,其中,與波動血糖組比較,中藥高劑量組提高FINS水平顯著 (P<0.05);中藥高低劑量組血清SOD水平明顯升高 (P<0.01),中藥低劑量組血清MDA水平明顯減低,胰腺SOD水平明顯升高 (P<0.05);此外,中藥高低劑量組MBG、SDBG、LAGE以及血清 NO和胰腺 MDA、NO水平較血糖波動組均有降低趨勢,但差異無統計學意義 (P>0.05)。說明丹蛭降糖膠囊能夠提高胰島β細胞數量,促進其再生而提高胰島素水平,從而改善糖尿病癥狀,并能有效抑制糖尿病波動血糖狀態下的氧化應激,其作用主要在抗氧化方面。由于糖尿病波動血糖的影響因素和機制復雜,因此,關于丹蛭降糖膠囊影響β細胞分泌的機制及抗氧化機制尚有待進一步深入研究。
[1]Kilpatrick E S,Rigby A S,Atkin S L.The effect of glucose variability on the risk of microvascular complications in type 1 diabetes[J].Diabetes Care,2006,29(7):1486-1490.
[2]Chang C M,Hsieh C J,Huang J C,et al.Acute and chronic fluctuations in blood glucose levels can increase oxidative stress in type 2 diabetes mellitus[J].Acta Diabetol,2012,49(Suppl 1):S171-177.
[3]劉懷珍,劉 劍,鮑陶陶,等.丹蛭降糖膠囊對2型糖尿病患者B細胞功能的影響[J].安徽中醫學院學報,2007,26(4):5-7.
[4]Del Guerra S,Grupillo M,Masini M,et al.Gliclazide protects human islet beta-cells from apoptosis induced by intermittent high glucose[J].Diabetes Metab Res Rev,2007,23(3):234-238.
[5]蔡 燕,劉翠萍,茅曉東,等.血糖波動對糖尿病大鼠胰島素釋放和胰島素敏感性的影響[J].南京醫科大學學報,2009,29(1):60-64.
[6]Afanas'evⅠ.Signaling of reactive oxygen and nitrogen species in diabetes mellitus[J].Oxid Med Cell Longev,2010,3(6):361-373.
[7]Stadler K,Jenei V,Von Bolcshazy G,et al.Role of free radicals and reactive nitrogen species in the late complications of diabetes mellitus in rats[J].Orv Hetil,2004,145(21):1135-1140.
[8]Monnier L,Mas E,Ginet C,et al.Activation of oxidative stress by acute glucose fluctuations compared with sustained chronic hyperglycemia in patients with type 2 diabetes[J].JAMA,2006,295(14):1681-1687.
[9]Bian H,Gao X,Gao J.Relationship between glucose fluctuation and beta cell function in patients with diabetes[J].Chin Med J,2009,89(10):664-668.
[10]Beckman J S,Koppenol W H:Nitric oxide,superoxide,and peroxynitrite:The good,the bad,and the ugly[J].Am J Physiol,1996,271(5 Pt 1):C1424-1437.
[11]Kr?ncke K D,Brenner H H,Rodriguez M L,et al.Pancreatic islet cells are highly susceptible towards the cytotoxic effects of chemically generated nitric oxide[J].Biochim Biophys Acta,1993,1182(2):221-229.
[12]吳元潔,方朝暉,鄭書國,等.丹蛭降糖膠囊聯合運動對糖尿病大鼠胰腺氧化應激及胰島功能的影響[J].中國中西醫結合雜志,2012,32(11):1531-1534.
[13]吳元潔,方朝暉,鄭書國,等.丹蛭降糖膠囊聯合運動對糖尿病大鼠胰腺JNK信號通路的影響研究[J].中西醫結合學報,2012,10(11):1279-1285.
[14]吳元潔,方朝暉,鄭書國,等.丹蛭降糖膠囊聯合運動對糖尿病大鼠NADPH氧化酶亞單位p22phox表達水平的影響[J].中國中西醫結合雜志,2013,33(5):641-645.

