補骨脂對小鼠肝細胞形態、肝功能及線粒體膜電位的影響
張秀娟,曹慧琪,邢志華,季宇彬*
(1.哈爾濱商業大學生命科學與環境科學研究中心生物安全評價研究所,黑龍江哈爾濱 150076;2.國家教育部抗腫瘤天然藥物教育部工程研究中心,黑龍江哈爾濱 150076;3.哈爾濱商業大學藥學院,黑龍江哈爾濱 150076)
補骨脂是中醫臨床治療脾腎陽虛的常用補虛藥物[1]。傳統醫學認為補骨脂具有補腎助陽,固精縮尿,暖脾止瀉,納氣平喘等功效,主治腎虛冷泄,遺尿尿頻,陽痿,遺精,虛寒喘咳,腰膝冷痛等病癥[2];現代藥理學研究表明該藥具有擴張冠狀動脈,抗菌,抗衰老的作用,對平滑肌有雙向調節作用,以及抗腫瘤等藥理活性[3-4]。補骨脂藥材、炮制、化學、藥理作用及臨床應用等在國內外都有了多方面的研究報道,但是長期使用補骨脂對機體損傷方面的研究甚少。故本課題旨在通過觀察肝臟病理組織、血清學、細胞學變化規律,分析補骨脂對小鼠肝損傷作用,并探討其安全用量范圍,為今后安全、合理、有效用藥提供理論基礎。
1 材料
1.1 藥物 補骨脂購自哈爾濱人民同泰藥店,經哈爾濱商業大學藥學院金哲雄教授鑒定為豆科補骨脂屬植物補骨脂Psoralea corylifolia的干燥成熟果實。
1.2 動物 昆明種小鼠 (20±2)g,雌雄各半,合格證為黑動字第POO101006號,由黑龍江中醫藥大學實驗動物中心提供。
1.3 試劑與儀器 谷丙轉氨酶 (ALT)、谷草轉氨酶(AST)、腫瘤壞死因子-α(TNF-α)試劑盒、白細胞介素-6(IL-6)試劑盒,南京建成生物工程研究所;Adventurer萬分之一電子天平,OHAUS公司;高速離心機,Beckman Coulter;超細勻漿器,德國FLUKU F6/10;低速離心機,北京醫用離心機廠 LD4-2A;SUNRISE酶標儀,瑞士TECAN公司;流式細胞儀,美國BECK-COULTER公司;OLYMPUS IX70倒置顯微鏡,Olympus公司。
2 方法
2.1 實驗動物分組及給藥 小鼠40只,隨機分成4組,分別為對照組、補骨脂組 (6.0、3.0、1.5 g/kg),灌胃,28 d。
2.2 補骨脂對小鼠肝臟組織形態學的影響 取小鼠肝臟適量切成小塊,PBS沖洗,石蠟包埋,H.E.染色。
2.3 補骨脂對小鼠血清ALT、AST的影響 眼球取血,3000 r/min離心10 min,分離血清,紫外分光光度法測定ALT、AST活性。
2.4 補骨脂對小鼠血清TNF-α、IL-6活性的影響 眼球取血,3000 r/min離心10 min,分離血清,酶聯免疫吸附試驗測定TNF-α、IL-6活性。
2.5 補骨脂對小鼠肝細胞線粒體膜電位的影響
2.5.1 肝細胞的分離純化 小鼠肝臟適量切成小塊,PBS沖洗,胰酶37℃消化15 min,小牛血清中止,300目尼龍網過濾,1000 r/min,10 min,棄上清,收集沉淀細胞,1000 r/min離心10 min,棄上清,調整細胞密度約為1×106個/mL。
2.5.2 線粒體膜電位的測定 取500 μL細胞懸液,加染色液500 μL,使其終質量濃度為10 μg/mL,37℃孵育30 min,加1 mL PBS,1000 r/min離心10 min,棄上清,加1 mL PBS,300目尼龍網過濾到流式管中,流式細胞儀檢測。激發波長488 nm,發射波長630 nm。
2.6 數據處理 所有數據用SPSS 19.0軟件進行方差分析。所有數據用表示,數據分析用方差檢驗。
3 結果
3.1 補骨脂對小鼠肝臟組織形態學的影響 如圖1所見,對照組肝小葉結構清晰,匯管區無擴大,肝索排列整齊,肝細胞結構完整,無腫大、脂變、壞死及明顯炎細胞浸潤;補骨脂各組則出現肝細胞輕度病變,1.5 g/kg組發現少量小壞死病灶;3.0 g/kg組不僅出現小壞死灶,且有肝細胞腫脹現象;6.0 g/kg組組織切片顯示為小壞死灶增多。
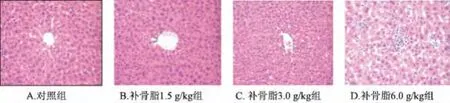
圖1 補骨脂對小鼠肝臟組織形態學的影響 (40×10)
3.2 補骨脂對小鼠血清ALT、AST的影響 6.0、3.0 g/kg組ALT和AST活性與對照組相比均有顯著的上升,說明補骨脂對小鼠肝功能具有明顯的損傷作用。見表1。
表1 補骨脂對小鼠血清ALT和AST活性的影響 )
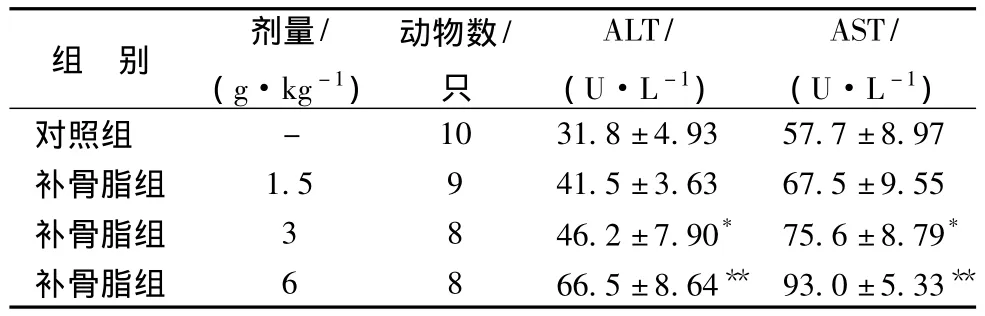
表1 補骨脂對小鼠血清ALT和AST活性的影響 )
注:與對照組比較,*P <0.05,**P <0.01
組 別 劑量/(g·kg-1)動物數/只ALT/(U·L-1)AST/(U·L-1)- 10 31.8±4.93 57.7±8.97補骨脂組 1.5 9 41.5±3.63 67.5±9.55補骨脂組 3 8 46.2±7.90* 75.6±8.79*補骨脂組 6 8 66.5±8.64** 93.0±5.33對照組**
3.3 補骨脂對小鼠血清TNF-α、IL-6活性的影響 與對照組比較,TNF-α活性6.0 g/kg組顯著升高;6.0、3.0 g/kg組IL-6活性與對照組相比均顯著升高,說明補骨脂對小鼠肝功能具有明顯的損傷作用。見表2。
表2 補骨脂對小鼠血清 TNF-α和 IL-6活性的影響
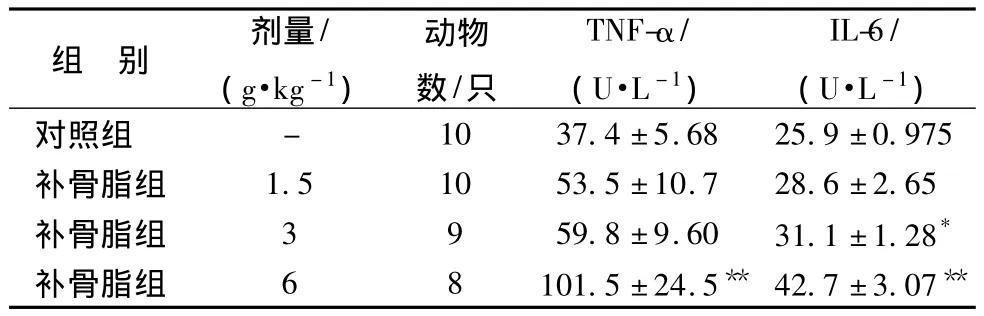
表2 補骨脂對小鼠血清 TNF-α和 IL-6活性的影響
注:與對照組比較,*P <0.05,**P <0.01
組 別 劑量/(g·kg -1)動物數/只TNF-α/(U·L -1)IL-6/(U·L -1)對照組 - 10 37.4±5.68 25.9±0.975補骨脂組 1.5 10 53.5±10.7 28.6±2.65補骨脂組 3 9 59.8±9.60 31.1±1.28*補骨脂組 6 8 101.5 ±24.5** 42.7±3.07**
3.4 補骨脂對小鼠肝細胞線粒體膜電位的影響 如圖2所示。肝細胞中強熒光部分細胞所占百分比逐漸減少,隨著藥物劑量的升高其比例的減少更加顯著,并呈一定的劑量依賴關系,說明補骨脂可使小鼠肝細胞內線粒體膜電位明顯下降,致肝細胞損傷。
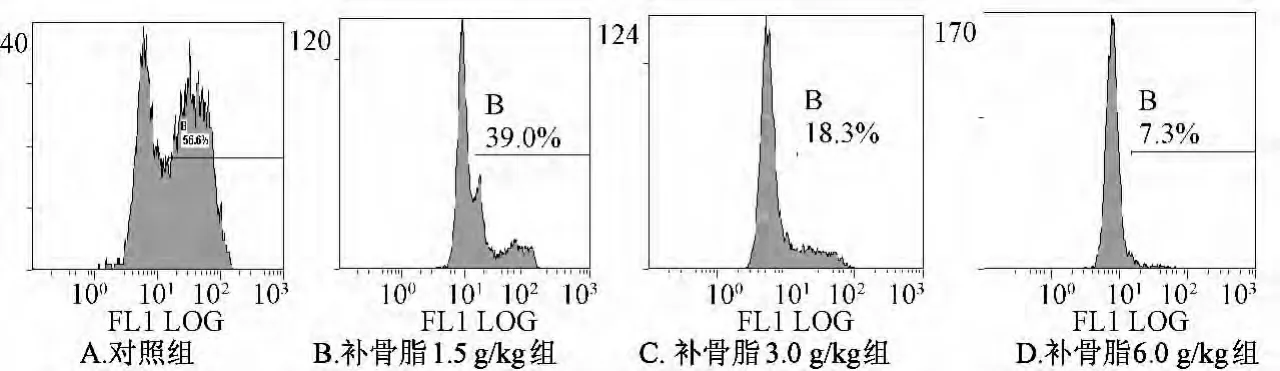
圖2 補骨脂對小鼠肝細胞線粒體Δψm的影響
4 討論
中藥肝毒性研究已成為中醫藥界關注熱點問題,正確合理的評價中藥毒性已成為當今中藥研究領域亟待解決的關鍵問題之一。進入機體的各種外源物質最終都會在肝臟內代謝、轉化、貯留,可直接或通過代謝作用間接損害肝臟,誘導肝細胞壞死、炎癥等病理改變,造成急性、慢性等不同程度的肝臟疾病[5-6]。外源性刺激引起動物肝臟發生損傷時均可引起血清轉氨酶活性的升高[7-8],其中血清 ALT及AST水平可在一定程度上反應肝臟的功能狀態。細胞因子是機體防御系統的主要部分,外界條件刺激會對各種細胞因子基因轉錄產生促進作用,進而導致細胞因子和炎癥介質 (TNF-α、IL-6)釋放[9-11],產生過多亦可損傷肝細胞。正常情況下,線粒體跨膜電位是維持線粒體進行氧化磷酸化、產生三磷酸腺苷的先決條件,是線粒體發揮正常功能的基礎。線粒體不僅可以通過氧化磷酸化產生三磷酸腺苷 (ATP)為機體供能外,還具有很多其他重要功能,如參與細胞內鈣自穩平衡、pH值的調節等,特別在細胞生存和壞死的調控中起決定性功能,細胞壞死時線粒體的形態和功能發生一系列變化[12-13]。研究結果顯示補骨脂能引起小鼠肝細胞腫脹、壞死,血清學結果顯示,ALT、AST活性低劑量組較空白組有增加趨勢但沒有統計學意義,高、中劑量組顯著增加;TNF-α、IL-6活性低劑量組較空白組有增加趨勢但沒有統計學意義,高、中劑量組顯著增加;肝細胞線粒體膜電位 (ΔΨm)隨著給藥劑量的增加顯著降低。說明補骨脂對小鼠肝臟具有明顯的損傷作用。
綜上所述,補骨脂經長期大劑量給藥對小鼠體質量、肝組織、肝功能酶都有明顯的影響,而且對肝細胞有損傷作用,表現為引起肝細胞線粒體膜電位顯著下降,肝細胞壞死。提示補骨脂大劑量使用可對小鼠肝臟造成一定的損害。
[1]吳 疆,魏 巍,袁永兵.補骨脂的化學成分和藥理作用研究進展[J].藥物評價研究,2011,34(3):217-219.
[2]劉自力,施 靜.補骨脂臨床研究進展[J].臨床分析與研究,2009,18(5):101-102.
[3]曹金一,劉京晶,黃文華,等.補骨脂藥理作用與臨床應用研究進展[J].中藥藥理與臨床,2008,24(6):89-91.
[4]劉 樺,白焱晶,陳亞云,等.中藥補骨脂化學成分的研究[J].中國中藥雜志,2008,33(12):1410-1412.
[5]王京麗,周超凡.中草藥及其制劑對肝損傷的研究概述[J].中國中藥雜志,2011,36(23):3371-3373.
[6]劉樹民.中藥藥物性肝損害[M].北京:中國中醫藥出版社,2007:53-59.
[7]賈毅捷,王育琴,常紅軍,等.77例中藥不良反應報告與分析[J].藥物不良反應雜志,2003,5(4):231-234.
[8]陳一凡,蔡皓東.中藥引起肝損害的調查分析[J].藥物不良反應雜志,1999(1):27-32.
[9]陳 晨,王 蓓,余 黎,等.中藥肝毒性成分研究進展[J].藥學與臨床研究,2012,20(2):148-151.
[10]Neuman M G.Cytokines-central factors in alcoholic liver disease[J].Alcohol Res Health,2003,27(4):307-316.
[11]Gobejishvili L,Barve S,Joshi-Barve S,et al.Chronic ethanolmediated decrease in cAMP primes macrophages to enhanced LPS-inducible NF-kappa B activity and TNF expression:relevance to alcoholic liver disease[J].Am J Physiol Gastrointest Liver Physiol,2006,291(4):681-688.
[12]王君明,崔 瑛,申玲玲,等.中藥致藥源性肝損傷的氧化應激機制研究進展[J].中國實驗方劑學雜志,2011,17(5):247-249
[13]Ichas F,Mazat J P.From calcium signling to cell death:two conformations for the mitochondrial permeability transition pore,switching from low-to high-conductance state[J].Biochim Biophys Acta,1998,1366(1/2):33-50.

