采用可視化方法通透性處理大腸桿菌細胞生產(chǎn)海藻糖合成酶*
崔懷言,江凌,,張文婧,唐飛,徐嫻,李霜,黃和
1(南京工業(yè)大學生物與制藥工程學院,江蘇南京,210009)
2(南京工業(yè)大學 食品與輕工學院,江蘇南京,210009)
海藻糖(Trehalose),是一種由葡萄糖分子以α,α-1,1-糖苷鍵相連而成的非還原性二糖[1]。由于海藻糖甜度低、性質穩(wěn)定,對于生物大分子(生物膜、蛋白質、DNA)具有良好的非特異性保護作用,因此,該雙糖被廣泛應用于食品、醫(yī)藥、化妝品等精細化學品領域[2]。海藻糖生產(chǎn)方法主要有微生物發(fā)酵法和酶合成法,而實際生產(chǎn)中多采用基因工程技術獲得高效率酶的表達系統(tǒng)。其中利用海藻糖合成酶以麥芽糖為原料的一步酶法生產(chǎn)海藻糖的路線由于工藝簡單、易于調控等優(yōu)勢,成為未來工業(yè)化生產(chǎn)海藻糖的趨勢[3-4]。
海藻糖合成酶屬胞內酶,傳統(tǒng)提取工藝通常先將細胞破碎,經(jīng)逐級分離純化后才可使用,酶活損失較大,且操作復雜,設備投資大,制約了其在工業(yè)生產(chǎn)中的應用[5]。而采用通透性處理細胞技術,在不破壞細胞整體內部有機結構的前提下改變細胞壁和細胞膜的通透性,使得小分子底物能夠自由進出細胞膜的技術則有望克服上述缺點[6]。薛璐等采用甲苯和EDTA對惡臭假單胞桿菌H76菌株進行了滲透處理,所得通透性細胞海藻糖合酶酶活高出未處理細胞的100倍以上[7]。張峻等系統(tǒng)對比了甲苯、氯仿、乙醇、吐溫、溶菌酶等試劑對亞棲熱菌CBS-01菌體細胞的滲透效果,最終確定了以2%的甲苯為滲透劑制備通透性細胞海藻糖合成酶的工藝路線[8]。但由于甲苯、氯仿等化學試劑對人體有毒害作用,存在食品安全隱患;處理細胞過程中易造成環(huán)境污染,同時也增加了海藻糖后續(xù)分離的難度,大大限制了化學通透性試劑在食品領域中的應用。
硫酸粘桿菌素是一種具有抗菌活性的生物表面活性劑,最早在桿屬多粘芽肥桿菌變種粘菌素(Bacillus polymyxa var.colistinus)的培養(yǎng)基中被發(fā)現(xiàn),對革蘭氏陰性菌有較強的抗菌作用,作為飼料添加劑在飼料工業(yè)中已被廣泛采用。研究表明,其抗菌機制主要是與細菌胞漿膜中脂蛋白的游離的磷酸酯鹽相互作用,使胞漿膜的表面張力降低和通透性增加,進而使胞內成分特別是嘌呤嘧啶從細胞原漿中逃逸,以導致細菌死亡[9]。本研究首次選用硫酸粘桿菌素作為通透性試劑處理大腸桿菌細胞,對其處理大腸桿菌細胞的濃度、溫度和時間進行單因素分析;進而,采用一種新的工藝條件優(yōu)化方法——可視化優(yōu)化方法[10-11],對通透性處理大腸桿菌的制備工藝條件進行分析、處理,預測出優(yōu)化的工藝條件。
1 材料與方法
1.1 材料
菌種:重組大腸桿菌 BL21(Escherichia coli)菌株,本實驗室構建[4]。
加氨芐的LB培養(yǎng)基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,氨芐抗生素0.1 g/L。
平板加氨芐抗生素的LB固體培養(yǎng)基:蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,氨芐抗生素0.1 g/L,瓊脂20 g/L。
主要試劑:硫酸粘桿菌素購于Ruibio公司,液相分析用色譜純麥芽糖、海藻糖、葡萄糖購于Sigma公司,分析純麥芽糖購于中國惠興生物化學試劑有限公司。
主要設備:高效液相色譜儀 UltiMate3000,美國Dionex公司;恒溫搖床HYL-A,太倉市強樂實驗設備廠;低溫高速離心機3-30K,德國Sigma公司;超聲破碎儀GA88-II,無錫上佳生物科技有限公司。
1.2 實驗方法
1.2.1 重組大腸桿菌發(fā)酵生產(chǎn)海藻糖合成酶
在37℃,200 r/min條件下培養(yǎng)重組大腸桿菌BL21,培養(yǎng)細胞濃度至OD6000.6~0.8加入誘導劑異丙基-β-D-硫代半乳糖苷(IPTG),終濃度為 0.8 mmol/L,誘導時間 8 h[4]。
1.2.2 通透性大腸桿菌的制備
發(fā)酵結束后,在6 000 r/min離心10 min后棄上清液,用0.04 mol/L pH 7.5的磷酸鹽緩沖液(PBS)重懸洗滌2次,離心后得大腸桿菌濕菌體,加入硫酸粘桿菌素進行通透性處理,在200 r/min條件下對硫酸粘桿菌素濃度、處理時間、處理溫度單因素處理后在6 000 r/min離心10 min后棄上清液,用磷酸鹽緩沖液洗滌2次,并1/2體積重懸,固定細胞菌懸液濃度為10%。此細胞懸浮液可用于海藻糖合成。
1.2.3 酶活測定
15 mL的通透性處理的細胞懸浮液與50 mL的30%(W/V)麥芽糖底物,在25℃,200 r/min條件下反應30 min。混合液于沸水浴加熱10 min終止酶反應。待其冷卻后,5 000 r/min離心10 min,取上清液,測定生成的海藻糖含量。
酶活力單位定義:在25℃,l min生成l nmoL海藻糖所需的海藻糖合酶的量為1個酶活力單位(U)。
1.2.4 海藻糖含量的測定
使用高效液相色譜法測定樣品中海藻糖的含量。
流動相為 V(乙腈)∶V(水)=75∶25;流速:0.6 mL/min;層析柱選擇氨基柱(柱溫35℃);選用視差折光檢測器。
1.2.5 智能可視化軟件優(yōu)化
采用可視化優(yōu)化方法對海藻糖制備工藝條件進行分析處理,預測出最佳的工藝條件。可視化優(yōu)化的基本原理如圖1所示。

圖1 可視化優(yōu)化方法基本原理圖Fig.1 Principles of visual optimization method
通過神經(jīng)網(wǎng)絡原理將樣本數(shù)據(jù)多維空間面貌特征維映射到二維平面上,運用 MATLAB軟件編寫程序語言產(chǎn)生目標函數(shù)等值線,然后從映射平面圖中找出滿足工藝條件的優(yōu)化點或優(yōu)化方向,并通過逆映射算法把平面上定出的優(yōu)化點逆映射到多維空間用原始變量表示,從而預測出優(yōu)化工藝條件[12-13]。
2 結果與分析
2.1 通透性處理大腸桿菌實驗參數(shù)的優(yōu)化
2.1.1 通透性試劑的最適濃度
在細胞懸液中加入硫酸粘桿菌素,使得最終質量濃度分別達到1.0、1.2、1.5、1.7、2.0 g/L,在25 ℃條件下反應60 min,測定細胞懸浮液中海藻糖合成酶的活性,結果如圖2所示。

圖2 硫酸粘桿菌素質量濃度對細胞通透性的影響Fig.2 Effects of colistin sulfate concentrations on cell permeability
由圖2可知,硫酸粘桿菌素濃度的增加,使得大腸桿菌細胞通透性同步增加,利于底物小分子進入胞內參與酶催化反應,當濃度達到1.5 g/L時,檢測酶活達到最大值。但是,隨著硫酸粘桿菌素濃度的進一步增加,檢測酶活反而迅速下降。由于硫酸粘桿菌素能夠通過自身所帶正電荷與細菌胞漿膜磷脂分子上的負電荷形成靜電吸附,結合并進入質膜中,通過其分子間的相互位移而聚合形成跨膜離子通道,擾亂質膜上蛋白質和脂質原有的排列秩序。硫酸粘桿菌素添加濃度越高,細胞膜的有序結構破壞越嚴重,最終致使菌體溶解,包括海藻糖合成酶在內的胞內物外溢,從而使得檢測酶活急劇降低[9]。
2.1.2 通透性處理的最適時間
選取1.5 g/L硫酸粘桿菌素在25℃條件下處理大腸桿菌細胞,處理時間分別為30、60、90、120 min,測定細胞懸浮液中海藻糖合成酶的活性,結果見圖3。

圖3 硫酸粘桿菌素處理細胞時間對細胞通透性的影響Fig.3 Effects of colistin sulfate processing time on cell permeability
由圖3可見,在處理時間少于60 min時,隨著處理時間的增加,細胞通透性程度加劇,使得檢測到的酶活提高,在60 min時達到最高值,隨后,隨著處理時間的增加,可檢測到的酶活急劇下降。可能原因是,當處理時間延長時,硫酸粘桿菌素與細胞膜表面形成的離子通道激增,由于滲透壓的作用使得水分子進入胞內,細胞溶脹,部分海藻糖合成酶從細胞中釋放出來,從而使得檢測到的酶活下降[14]。
2.1.3 通透性處理的最適溫度
選取1.5 g/L硫酸粘桿菌素處理大腸桿菌細胞60 min,處理溫度分別是 25、28、30、33、35 ℃,測定細胞懸浮液中海藻糖合成酶的活性,結果見圖4。
由圖4可見,隨著處理溫度的增加,硫酸粘桿菌素的處理效果迅速增強,透性化程度明顯,在溫度達到30℃時透性化程度最佳,隨后隨著溫度的增加,酶活逐漸降低,因為此酶在15~55℃之間保持較高的催化活性[4],所以可能原因是溫度增加使得細胞膜脂質和蛋白質加速位移,硫酸粘桿菌素能夠較容易進入質膜形成離子通道,導致離子通道有所增加,少量酶從細胞中釋放出來[14]。
2.2 通透性細胞海藻糖合成酶的反應工藝條件優(yōu)化

圖4 硫酸粘桿菌素處理細胞的溫度對細胞通透性的影響Fig.4 Effects of colistin sulfate processing temperature on cell permeability
2.2.1 設計正交實驗
根據(jù)單因素實驗結果,選定濃度、時間、溫度3個因素,采用正交表L9(33)對這3個因數(shù)進行綜合考察。通過正交實驗得出的最優(yōu)工藝;硫酸粘桿菌素濃度1.5g/L,處理時間60 min,處理溫度是35℃。正交實驗結果見表1。

表1 正交實驗結果表Table 1 Results of orthogonal experiment
實驗數(shù)據(jù)的方差分析表明,本實驗所選用的因素對海藻糖的轉化產(chǎn)率有顯著影響,各因素間差異顯著。由極差分析可知,各因素對海藻糖產(chǎn)率影響的主次順序為硫酸粘桿菌素濃度>處理時間>處理溫度。處理溫度影響最小,與單因素實驗結果相符。
2.2.2 函數(shù)擬合結果
利用可視化優(yōu)化軟件優(yōu)化正交實驗設計得到的實驗結果,圖5是目標函數(shù)經(jīng)過100次迭代擬合計算后產(chǎn)生的擬合曲線圖。從圖5中可知,其逼近能力很強,除少數(shù)幾個點稍微有些偏差以外,其余的點幾乎與原始點重合。

圖5 函數(shù)擬合圖Fig.5 Function fitting figure
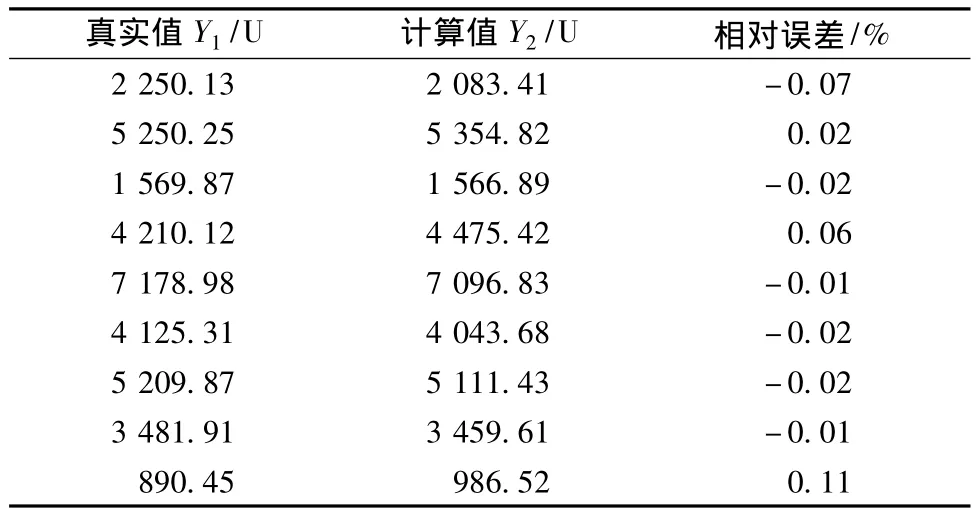
表2 可視化優(yōu)化方法的優(yōu)化結果Table 2 The optimization results of visual optimization method
2.2.3 產(chǎn)生目標函數(shù)等值線
可視化優(yōu)化結果如圖6所示,標號為1~9的9個點為每次實驗在映射圖上所對應的點,黑色實線為各組實驗酶活的等值線。根據(jù)逆映射算法預測出優(yōu)化的實驗操作點,其最優(yōu)實驗條件為:以1.42 g/L的硫酸粘桿菌素為滲透劑,35℃滲透處理72 min。預測酶活可達達7 734.32 U/mL。實際操作驗證以1.40 g/L的硫酸粘桿菌素為滲透劑,35℃滲透處理72 min,酶活可達到7 425.13 U/mL。可視化優(yōu)化軟件預測結果與實際結果基本相符。此時獲得的海藻糖合成酶酶活是傳統(tǒng)超聲破碎法制備的酶活的2.09倍(7 425.32 U/mL、3 552.13 U/mL)。
2.3 通透性細胞重復使用批次考察
為了考察通透性細胞胞內海藻糖合成酶酶活的
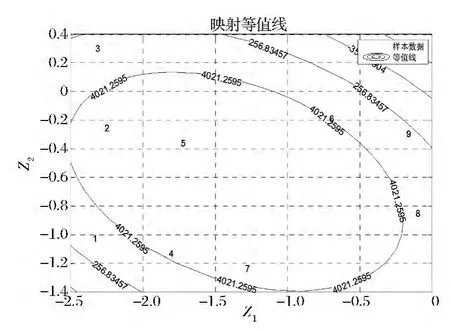
圖6 通透性細胞制備工藝降維映射平面圖Fig.6 Dimension reduction map of the permeable cell preparation technology

圖7 通透性細胞使用批次考察Fig.7 The using batch of the permeable cells
按優(yōu)化后方法得到的通透性細胞進行了16批次的酶催化反應(共192 h),海藻糖合成酶的轉化率基本保持穩(wěn)中略降的走勢,16批次后仍保留65.12%的較高轉化率。
3 結論
細胞經(jīng)透性化處理后,雖改變胞漿膜的通透性,但細胞整體結構完整,底物既能進入細胞,又保證了胞內酶催化作用的充分發(fā)揮,同時細胞結構對酶還具有一定的保護作用。本文選取生物表面活性劑硫酸粘桿菌素為透性化試劑,并采用可視化優(yōu)化方法對硫酸粘桿菌素透性化處理大腸桿菌制備工藝條件進行優(yōu)化。由于硫酸粘桿菌素可生物降解,不會造成環(huán)境污染,獲得的透性化細胞擁有較高酶活,反復使用16批后海藻糖的轉化率維持在65%以上,顯示了良好的應用前景,給海藻糖低成本、高效率的工業(yè)化生產(chǎn)開辟出一條新工藝路徑。
[1]Eroglu,Ali Russo,Michael J,et al.Intracellular trehalose improves the survival of cryopreserved mammalian cells[J].Nature Biotechnology,2000,18(2):163 -167.
[2]ZHANG Ran,PAN Yuan T,HE Shouming,et al.Mechanistic analysis of trehalose synthase from mycobacterium smegmatis[J].The Journal of Biological Chemistry,2011,286(41):35 601-35 609.
[3]LIANG Jiayuan,HUANG Ribo,HUANG Ying,et al.Cloning,expression,properties,and functional amino acid residues of new trehalose synthase from Thermomonospora curvata DSM 43183[J].Journal of Molecular Catalysis B:Enzymatic,2013,90:26-32.
[4]JIANG Ling,LIN Ming,ZHANG Yang,et al.Identification and Characterization of a Novel Trehalose Synthase Gene Derived from Saline-Alkali Soil Metagenomes[J].Plos One,2013,8(10):1-10.
[5]ZHOU Yan,YUAN Qipeng,GAO Huiling,et al.Production of trehalose by permeabilized Micrococcus QS412 cells[J].Journal of Molecular Catalysis,2006,43(1 - 4):137-141.
[6]Hye-Jin Oh,Kyung-Cheol Shin,Deok-Kun Oh.Production of 10-hydroxy-12,15(Z,Z)-octadecadienoic acid from αlinolenic acid by permeabilized cells of recombinant Escherichia coli expressing the oleate hydratase gene of Stenotrophomonas maltophilia[J].Biotechnology Letters,2013,35:1487-1493.
[7]薛璐,馬鶯.透性化細胞海藻糖合酶特性的研究[J].食品科學,2003,24(3):26-29.
[8]張峻,陳曉云,齊欣,等.透性化細胞海藻糖合酶的制備及其性質研究[J].南開大學學報自然科學版,2005,38(5):93-96.
[9]Jon-Paul S Powers,Robert E.W Hancock.The relations between peptide structure and antibacterial activity[J].Peptides,2003,24(11):1 681-1 691.
[10]鄢烈祥,華麗.工業(yè)過程操作優(yōu)化可視化方法:降維分析法[J].武漢理工大學學報,2002,24(7):79-82.
[11]Yan Liexiang,Ma Dexian.Global optimization of nonconvex nonlinear programs using Line-up Competition Algorithm[J].Computers& Chemical Engineering,2001,25(11-12):1 601-1 610.
[12]佘艷,張光旭,鄢烈祥,等.交聯(lián)-羧甲基淀粉合成工藝可視化優(yōu)化的研究[J].中國糧油學報,2009,24(4):62-65.
[13]ZHANG Guangxu,SHE Yan,YAN Liexiang,et al.The application of an advanced visualized method in synthesis process optimization of carboxymethyl hydroxyethyl starch[J].Carbohydrate Polymers,2010,79(3):673 -676.
[14]Heller W T,Waring A J,Lehrer R I,et al.Membrane thinning effect of the betasheet antimicrobial protegrin[J].Biochemistry,2000,39:139-145.

