特發性肺纖維化患者相關預后影響因素的臨床研究
于 洋 韓春生 韓桂玲 張紓難
(1北京中醫藥大學,北京,100029;2中日友好醫院,北京,100029)
間質性肺疾病(Interstitial Lung Disease,ILD)是多種肺疾病及多種系統性疾病的共同結局[1],是呼吸系統中較嚴重的疾病,其病變主要發生在肺間質,常常會累及到肺動靜脈、肺泡上皮細胞和肺毛細血管內皮細胞。目前其確切的發病機制尚不清楚了。在臨床上,可以根據其病因及發病機制分為繼發性和特發性,這兩類的主要特征都是彌漫性肺泡炎和肺泡結構紊亂,臨床癥狀是活動后呼吸困難并逐漸加重、干咳和喘憋等[2]。ILD的病變常常會呈現出進行性加重的趨勢,臨床上表現為勞力性、漸進性氣促,限制性通氣障礙伴有彌散功能降低,低氧血癥和胸部影像學呈現雙肺彌漫性病變,晚期發展為彌漫性肺纖維化甚至蜂窩肺,最終引起心肺功能的衰竭而死亡[3]。
特發性肺纖維化(Idiopathic Pulmonary Fibrosis,IPF)是ILD中常見類型,近幾年隨著影像學的發展,IPF的檢出率明顯升高。IPF目前無特效的藥物,臨床的病死率較高,其確切的發病率及流行情況等不詳,男性發病率高于女性,發病的年齡大多在50~70歲,發病率隨年齡增加而升高[4]。目前其治療方法較少,現代醫學主要以糖皮質激素聯合免疫抑制劑為主,療效不佳,其他藥物正處于臨床研究觀察階段,如N-乙酰半胱氨酸(NAC)及超氧化物歧化酶(SOD)等抗氧化劑等,但其效果不明顯,尚在研究中。目前最有效的治療方法為肺移植,但其手術難度及花費較大,臨床難以大規模應用。綜合可見IPF的病死率高,預后較差,所以對IPF的預后因素研究顯的尤其重要。通過回顧分析的方法,評價臨床生理病理指標各因素對IPF預后的影響作用,篩選出對預后有影響的因素,通過這些指標評價IPF患者的預后,為早期的治療預防的提供幫助。本研究以最新的非創傷性特發性肺纖維化的診斷標準為依據,通過嚴格的設計,運用生存分析的方法回顧分析IPF患者一般臨床資料、病理、生理指標、中醫證候積分及中藥干預后生存變化等參數因素對IPF患者預后的影響作用。
1 對象和方法
1.1 對象 收集中日友好醫院2007年10月至2012年10月間經病理或臨床診斷的IPF患者,共入選48例,均符合2000年ATS/ERS以及中華醫學會呼吸學分會的特發性肺纖維化非創傷性診斷標準[5],主要診斷條件:1)肺功能表現異常,包括限制性通氣功能障礙和(或)氣體交換障礙;2)胸部HRCT表現為雙肺網狀改變,晚期出現蜂窩肺,可伴有極少量磨玻璃影;3)經支氣管肺活檢(TBLB)或BALF檢查不支持其他疾病的診斷;4)除外已知原因的間質性肺疾病(ILD),如某些藥物不良反應、職業環境接觸史和風濕性疾病等。次要診斷條件:1)年齡>50歲;2)隱匿起病或無明確原因進行性呼吸困難;3)病程>3個月;4)雙肺聽診可聞及吸氣性Ve1cro啰音;對于沒有外科肺活檢病理資料的患者符合以上所有的主要診斷條件和至少3/4的次要診斷即可臨床診斷特發性肺纖維化。這些患者同時除外風濕免疫性疾病、藥物、環境等引起的肺間質纖維化。
1.2 方法 記錄這些患者的一般資料(年齡、性別、吸煙史、體重指數、工作性質)、臨床檢查指標(血沉、血氣分析、肺功能、6分鐘步行實驗)、圣喬治問卷評分、中醫證候積分、治療情況等。患者的一般資料中吸煙史分為吸煙史1年以上的定義為有,從不吸煙或吸煙史1年以下的定義為無;患者的體重指數BMI為體重/身高2(kg/m2);患者的工作性質分為體力工作和非體力工作;患者的血氣分析記錄pH、PO2、PCO2;肺功能記錄FVC、TLC、FEV1、DLCO占預計值的百分比。通過門診復查或者電話隨訪患者的生存情況,如患者死亡記錄其死亡時間及原因,除外非IPF導致死亡,將其從確診至死亡或隨訪結束時的時間定位生存時間,單位為月。
1.3 統計 運用SPSS 17.0統計軟件中生存分析進行各指標的統計分析,以P<0.05為有差異具有統計學意義。定量數據均數用M表示,可信區間為95%(95%CI)。單因素和多因素Cox比例風險回歸檢測各指標因素的死亡風險度(HR),Kaplan-Meier檢驗分析組間(定量資料以單因素Cox比例風險回歸的中位數作為Cutoff值分組)生存率差異,使用log-rank檢驗,以P<0.05為有差異具有統計學意義。
2 結果
2.1 IPF患者一般臨床資料參數特征 本研究一共入選48例特發性肺纖維化患者,平均年齡68.08歲,男女比例為30:18,吸煙者29例(60.42%),發現杵狀指者28例(58.33%),體力工作者16例(33.33%),接受中藥治療者30例(62.50%)。
2.2 IPF患者生存及預后情況 本研究的48例IPF患者隨訪時間為2~60個月,平均隨訪37個月,隨訪結束時48例IPF患者的死亡30例,存活18例,生存率為37.5%,平均生存時間為37.35個月(95%CI為31.34~43.37),48例入選IPF患者總生存曲線如下(圖1)。

圖1 48例入選IPF患者的生存曲線
2.3 IPF患者各參數單因素Cox比例回歸分析情況見表1。

表1 48例IPF患者單因素Cox比例回歸分析情況

圖2 BMI對IPF患者生存率的影響

圖3 中醫證候積分對IPF患者生存率的影響

圖4 圣喬治呼吸評分對IPF患者生存率的影響
通過單因素Cox比例回歸分析入選的48例IPF患者的各參數顯示,對IPF患者預后有影響(P<0.05具有統計學意義)的因素有:體重指數BMI,圣喬治呼吸評分,6分鐘步行試驗,肺功能指標FVC%,TLC%,DLCO%,血氣分析指標PO2,血沉,杵狀指。這些因素中體重指數 BMI、6分鐘步行實驗、PO2、FVC%、TLC%、DLCO%的相對死亡風險度HR均小于1,故它們與IPF患者的預后影響呈正相關的作用,而中醫證候積分、圣喬治呼吸評分、血沉、杵狀指的HR均大于1,故與IPF患者的預后影響呈負相關。

圖5 6分鐘步行試驗對IPF患者生存率的影響

圖6 TLC%對IPF患者生存率的影響

圖7 DLCO%對IPF患者生存率的影響
2.4 IPF患者各因素組間Kaplan-Meier檢驗生存率比較情況 對48例入選的IPF患者的各臨床因素組間進行Kaplan-Meier檢驗顯示:BMI(P=0.011,截點值=24.213,logrank=6.454)、中醫證候積分(P=0.001,截點值 =25.896,logrank=12.191)、圣喬治呼吸評分(P=0.001,截點值 =53.702,logrank=15.968),6分鐘步行試驗(P=0.002,截點值 =291.458,logrank=10.433),TLC%(P=0.028,截點值=68.658,logrank=4.816),DLCO%(P=0.004,截點值 =41.668,logrank=8.474),PO2(P=0.033,截點值=75.054,logrank=4.530)、血沉(P=0.005,截點值 =22.271,logrank=7.715)、杵狀指(P=0.013,logrank=6.229,圖2-10)這些因素組間的生存率有差異,說明它們是IPF患者預后的影響因素。
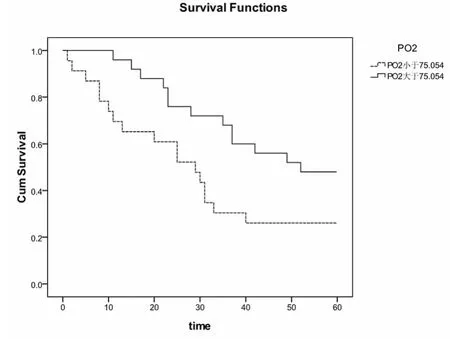
圖8 PO2對IPF患者生存率的影響
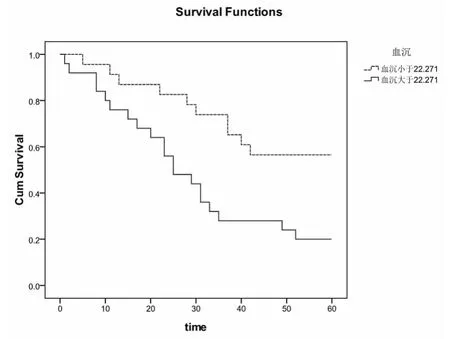
圖9 血沉對IPF患者生存率的影響
2.5 IPF患者多因素Cox比例回歸分析情況 對入選的48例IPF患者單因素Cox比例回歸分析有統計意義的參數進行多因素Cox比例回歸分析表明:體重指標(P=0.005,HR=0.779,Wald=7.882)、6 分鐘步行實驗(P=0.021,HR=0.996,Wald=5.337)、血沉(P=0.016,HR=1.061,Wald=5.807)是影響 IPF 患者預后的主要因素,其中體重指數和6分鐘步行實驗的HR小于1,呈正相關;血沉的HR大于1,與IPF患者預后呈負相關。
3 討論
特發性肺纖維化是彌漫性間質性肺病中的特殊類型,目前在臨床治療上無特效的藥物。根據國外報道發現,其病死率較高,中位生存期為2.8年,男性發病率高于女性,比例大約為1.6∶1。對于本研究來說,共納入患者48例,平均年齡68.08歲,男女比例30∶18,中位生存期為37.35個月,5年生存率為37.5%,與國外文獻報道的結果大體相似,可見特發性肺纖維化患者的預后較差,病死率較高,對其影響預后的相關因素研究很重要[6]。

圖10 杵狀指對IPF患者生存率的影響
體重指數(BMI)是評價患者營養狀況的重要指標,可用于多種疾病的預后評價之中。根據既往的研究表明,在COPD和慢性的呼吸功能衰竭患者中體重指數越高預后越好[7]。相對于IPF患者來說,有研究報道體重指數對預后也有一定的影響,Alakhras[8]等回顧性分析197名IPF患者,根據體重指數將所有患者進行了分組,BMI<25的患者中位生存期為3.6年,3年生存率是54%;BMI>25而<30的患者中位生存期為3.8年,其3年生存率是58%;BMI>30的患者中位生存期為5.8年,其3年生存率是69%。通用Cox比例風險回歸模型對其進行預后分析表明,IPF患者的生存率與BMI的關系密切相關,其中IPF患者的BMI越高生存優勢越明顯。本研究證明BMI是IPF患者的預后因素,與相關文獻報道的結果相似。分析其原因是高BMI是一種慢性的炎癥反應狀態,脂肪細胞可以通過不同的脂肪組織細胞分泌大量細胞因子,這些細胞因子參與了人體很多重要的生理活動的調節[9]。另外,BMI越高生存優勢越明顯可能也與營養狀況的改善有關,當低BMI時多有營養不良,患者常常出現胸腺萎縮而使T細胞的功能下降,進而會增加感染發生的幾率,并且當發生營養不良時,機體對炎癥反應損傷的易感性會受到損傷,炎癥反應被證明是可以使生存期縮短的潛在反應[10]。
在收集納入IPF患者的過程中,我們發現除了杵狀指等體征以外,患者常常出現咳嗽、咳痰、氣短、velcros啰音等臨床癥狀,我們根據這些癥狀量化為中醫證候積分。通過積分的高低評價IPF患者臨床癥狀的嚴重程度,積分越高表明臨床癥狀較重,反之則表示較輕。中醫證候積分作為中醫獨特的癥狀量化分級方法常用于臨床研究之中,用來評價臨床治療效果、患者病情的緩解程度。中醫證候積分是將患者的臨床癥狀、體征等量化以后的數據,可以大致反映患者病情的輕重,對患者的預后有一定的預測,可以作為臨床監測指標評價患者的預后。
6分鐘步行試驗在呼吸系統疾病的預后評價中經常用到,在IPF患者預后的評價方面比肺功能要更加的精確,可以預測IPF患者的死亡率。在沒有其他干擾因素的情況下,當患者6分鐘的步行距離<207 m時的死亡率是步行距離>207 m時的四倍,另外有研究還發現6分鐘步行試驗后血氧飽和度下降的程度與IPF患者預后的關系密切[11]。在本研究中,單因素Cox比例風險回歸分析顯示6分鐘步行試驗與IPF患者的預后相關(P=0.000 1),選取291.458 m為截點值分組,Kaplan-Meier檢驗組間生存率顯示有差異(P=0.000 2),當6分鐘步行試驗大于291.458 m的IPF患者的生存時間較長,表明6分鐘步行試驗可以與氧飽和度相配合作為評價IPF患者預后的指標,可以反應患者活動耐力和肺功能的一般情況。
過去對IPF的病理機制研究認為慢性炎性反應參與了纖維化的過程,而血沉是反映機體炎性反應的指標之一,其可能是IPF患者預后的相關因素。國外有研究表明,炎性反應的相關指標血沉、CRP等與IPF患者的預后關聯性不強,認為這些指標對IPF患者的預后沒有影響。本研究記錄全部患者的血沉值,通過單因素COX比例風險回歸模型進行預后分析后顯示其與IPF患者的預后相關(P=0.03),選取22.271為截點值進行分組,進行Kaplan-Meier組間生存率檢驗,顯示血沉大于22.271組與小于22.271組的生存率存在差異(P=0.005),本研究預后分析結果顯示血沉是IPF患者的預后因素,當血沉越高時IPF患者的生存時間較血沉低的患者短。本研究的結果與相關文獻報道的結果不同,分析原因是納入的患者可能存在感染,晚期IPF患者肺部情況較差,清楚異物能力減弱,易發生感染,當機體發生感染時血沉升高,對預后分析產生影響。本研究納入病人數較少,缺少大樣本數據,并且未排除可能存在感染的患者,提示以后的研究需要多中心大樣本嚴格標準納入患者,以減少誤差得出較客觀的結果。
目前對于IPF預后的研究已經進行了很多年,但是研究得出的結論卻都不是很明確,造成這一結果存在很多原因,例如以前的IPF診斷標準不明確,納入的患者不規范,很多的患者因沒有病理診斷而沒有納入,使樣本數量較少,缺少多中心大樣本的數據等等[12]。并且目前的預后研究都著眼于年齡、性別、肺功能等指標,沒有將某些指標的動態變化進行分析,致使目前對一些可能有價值的指標因素沒有達成共識。這些不足為我們今后的研究指明了方向,需要我們進行大規模、大樣本量、多種指標動態變化等特點的回顧性研究,以期得出較為客觀公認的結果。當我們獲得了確切的能對IPF患者預后產生影響的因素指標后,在我們臨床治療IPF時提供參考,幫助我們制定更科學更有效的診療方案。
[1]翁心植,王辰.呼吸內科專題講座[M].鄭州:鄭州大學出版社,2005:178–181.
[2]中華醫學會呼吸病學分會.特發性肺(間質)纖維化診斷和治療指南(草案)[J].中華內科雜志,2002,41(7):498-500.
[3]朱元玨,呼吸病學[M].北京:人民衛生出版社,2003:1071-1012.
[4]Erbes R,Schaberg T,Loddenkemper R.lung function tests in patients with idiopathic pulmonary fibrosis.Are they helpful for Predicting outcome?[J].Chest,1997,111(1):51-57.
[5]中華醫學會呼吸病學分會.特發性肺(間質)纖維化診斷和治療指南(草案)[J].中華結核和呼吸雜志,2002,25(7):387-389.
[6]田輝,于建華,彭守春,等.特發性肺纖維化預后因素研究進展[J].中國全科醫學,2008,11(1):73.
[7]Canon M,Piehard C,Roth H,et al.creaetive protein and body mass index prediet outcome in end stage respiratory failure[J].Chest,2004,126(2):540-546.
[8]Alakhras M,Deeker PA,Nadrous HF,et al.Body mass index and mortality in patients with idiopathic pulmonary fibrosis[J].Chest,2007,131(5):1448-1453.
[9]Tilg H,Mosehen AR.Adipoeytokines:mediators linking adipose tissue,inflammation and immunity[J].Nat Rev Immunol,2006,6(10):772-783.
[10]Savino W.The thymus gland is a target in malnutrition[J].Eur J Clin Nutr,2002,56(suppl):546-549.
[11]Caminati A,Bianchi A,Cassandro R,et al Walking distance on 6MWT is a prognostic factor in idiopathic pulmonary fibrosis[J].Respir Med.,2009,103(1):117-23.
[12]張紓難,疏欣楊.對特發性肺纖維化中醫臨床研究的思考[J].環球中醫藥,2009,2(3),196-198.

