脫礦牙本質基質材料對大鼠顱骨缺損修復的研究*
李伯翰 劉洪臣
口腔頜面部的腫瘤、外傷、發育性畸形均易造成頜骨缺損。骨缺損的修復技術主要有自體骨移植、異體(同種或異種)骨移植和人工骨材料移植。自體骨移植雖為目前骨缺損修復的金標準[1,2],但存在取骨區多種并發癥、骨量有限、吸收不良等問題[3-5]。為此,很多學者為尋找一種優良的骨替代材料進行了大量的研究。
近年來研究較多的脫礦牙本質基質(demineralized dentin matrix,DDM)是一種具有骨誘導性的骨替代材料[6-9]。本實驗選用的材料主要成分為DDM-熟石膏(Ca[SO4]-0.5H2O)復合構建新的組織工程骨,用于修復骨缺損,探討此種新型植骨材料的骨缺損修復作用,希望為臨床治療骨缺損提供一種新型的人工骨材料。
1.材料與方法
1.1 實驗動物及主要試劑、儀器 實驗動物:6-8周齡雄性SD大鼠14只(SPF/VAF,解放軍總醫院動物實驗中心),體重160-180 g。熒光顯微鏡、倒置顯微鏡(Leica公司,德國)。
1.2 脫礦牙本質基質牙粉制備 取8周齡SD大鼠兩只的上下前牙,用預冷的生理鹽水反復沖洗后,刮除軟組織,機械法去除牙釉質和牙骨質以及內部牙髓組織,用三氯甲烷-甲醇脫脂24h,然后將脫礦、脫脂的牙齒粉碎過篩制成200-280μm的微粒,用預冷生理鹽水反復沖洗,放入pH為8.0的5g/L的EDTA液中處理10min,生理鹽水沖洗12h去除EDTA后,環氧乙烷消毒,備用。純二水硫酸鈣經加熱1300℃,30 min鍛燒而得熟石膏。以脫礦牙本質基質和熟石膏按2:1的重量比混合后環氧乙烷消毒保管[10-12]。
1.3 手術方法 用乙醚進行全麻后,腹腔內注入戊巴比妥鈉25mg/kg完全麻醉SD大鼠,麻醉后固定于手術臺上,頭顱部備皮和碘伏消毒后為了減少術中出血注射20/0鹽酸利多卡因(含1:10萬復方腎上腺素),切開頭顱骨正中央部并露出骨面。用臺式慢速牙科電鉆低速鉆孔(3000r/min)直徑約為8mm。實驗組:立即將己準備好的脫礦牙本質基質牙粉末和熟石膏以2:1的質量比用生理鹽水混合后埋植到缺損部。縫合骨膜及上部組織。對照組:無治療修復,手術后立即縫合。待蘇醒后送回飼養室,分別于術后第4和8周(實驗組和對照組各3只)時分組處死動物。各實驗動物用吸入過量乙醚的方式處死后切開頭部,在70kvp、15ml、0.4sec的條件下攝X線片,之后采集標本(包括周圍自體骨),10%的福爾馬林固定,脫鈣,用石蠟包埋后以4-6μm的厚度制作組織標本。用H-E染色法染色后在光學顯微鏡下觀察。
1.4 觀察指標 (1)肉眼觀察術后大鼠活動、進食、傷口愈合情況。(2)分別于術后4和8 w,將大鼠麻醉后攝大鼠顱骨X線片,條件為40kV,1.6 mAs觀察顱骨缺損修復情況;然后在麻醉狀態下注入空氣處死,取標本行肉眼觀察及HE染色組織學觀察骨缺損的修復水平。
2.結果
2.1 實驗動物觀察 術后動物體溫、飲食正常,外界環境刺激敏感,切口無紅腫、滲液等炎性反應。
2.2 影像學檢查 實驗組各時間段均可見云霧樣改變,缺損邊緣隱約可見少量骨痂;8W時云霧模糊影較大,缺損處有骨形成充滿骨痂。空白組在各時間點,骨折缺損處見有瘢痕愈合,未見骨性愈合,未見明顯新生骨(圖1)。

圖1 顱骨缺損后修復影像學檢查
2.3 大體觀察 各組植入的修復材料在骨創區均無移位,材料于骨組織交界周圍未見變性、壞死、化膿、積液等不良跡象。4 w時,實驗組出現骨質較薄的骨痂樣硬組織,標本表面較為光滑,漸變暗紅色;對照組缺損區無明顯新骨長入,僅有少量結蹄組織覆蓋。8 w時,實驗組骨創區呈現乳白色,可見血管,新生出皮質骨與骨折端皮質連續,骨修復完成;對照組仍有明顯的骨缺損,骨缺損區被周圍結締組織覆蓋,未見明顯骨痂。
2.4 組織學觀察 4周時,實驗組和對照組脫鈣后均可見空腔,植入材料和缺損處鏈接緊密。各組材料均可見微血管和成纖維細胞浸潤,對照組的血管和細胞數量少于實驗組。8周時,實驗組較多骨樣組織形成,表現為軟骨成骨和纖維成骨特征。對照組,變化不大,少許局灶性骨樣組織形成。值得關注的是,對照組成骨主要表現是從缺損邊緣向中間發展,而實驗組的成骨活動是在材料與缺損邊緣交界處,且更為活躍(圖2)。
3.討論
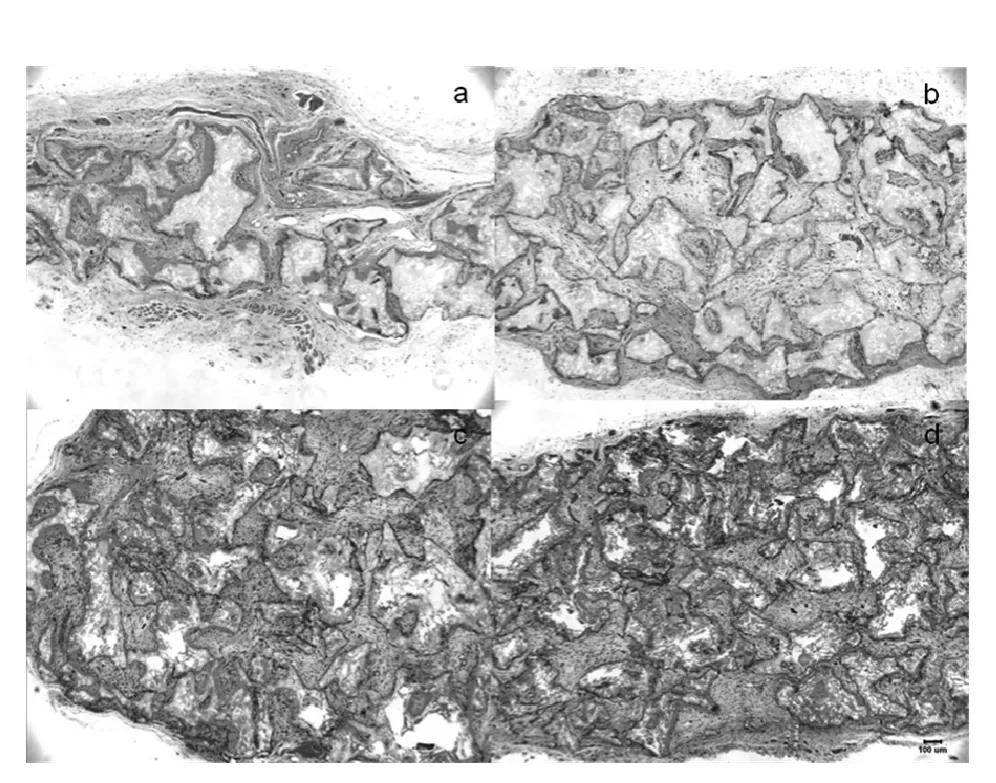
圖2 組組織學變化(HE染色,×400)
骨組織工程中,選擇具有細胞外基質作用的生物材料是很重要的,直接關系到組織再生成功與失敗[13-15]。脫礦牙本質基質,按形態分也有3種,即顆粒狀、凝膠狀和薄膜狀。,其制備和作用機理在雜志“脫礦牙本質基質骨誘導作用的研究”有關報道為以臨床拔除的各類牙為原料,經過粉碎、脫脂、脫鈣、病毒核酸滅活和消毒等過程獲得,此DDM的顆粒大小為100-200μm3。DDM無論在骨缺損區、根尖周區或軟骨區都具有良好的骨誘導作用,但是DDM的骨誘導機制目前原因并不十分明確。DDM為天然細胞外基質材料,內部含有豐富的有助于細胞生長的蛋白和細胞因子,包括DMP-1,牙本質涎蛋白(dentin sialoprotein,DSP),骨涎蛋白,骨橋蛋白,轉化生長因子-p1、I型膠原,核心蛋白多糖和二聚糖等牙齒基質成分,能夠為細胞提供相似天然的牙齒發育微環境[15-18]。本實驗發現4周后DDM材料和缺損處上游戲包正常貼附、生長、繁殖,證明該生物材料有良好的細胞相容性。
人類骨的無機成分最主要為羥基磷灰石(HA),我們選用的脫礦牙本質基質牙粉材料的主要材料也同樣為羥基磷灰石。但是羥基磷灰石質碎,吸收差,不易降解。目前國內外用羥基磷灰石和熟石膏復合物修復骨缺損的動物實驗一致認為:經基磷灰石和熟石膏復合物不引起組織炎性反應和異物反應;羥基磷灰石和熟石膏復合物誘導新骨形成的速度快于單純羥基磷灰石;新骨與輕基磷灰石的結合是理想的骨整合[19]。
為彌補脫礦牙本質基質牙粉末易離散,早期固位不佳的缺點,本實驗把熟石膏與脫礦牙本質基質牙粉末混合后移植,以此提高材料的初期穩定性,隨材料穩定性的提高,骨傳導能力也可能比單獨移植脫礦牙本質基質牙粉末時相比優越。熟石膏所特有的粘附性,作為脫礦牙本質基質牙粉末的粘接成形劑,以保證達到良好的形態和固位,減少顆粒的移動構成一種有效的輸送體系。
本實驗觀察結果隨著時間的變化,移植的脫礦牙本質基質牙粉末分解成小顆粒,其大小逐漸變小,移植物初期四方形邊緣逐漸變為圓鈍,因此可推斷脫礦牙本質基質牙粉末是可吸收的,第5周時可觀察到脫礦牙本質基質牙粉末周圍被膜化和骨缺損部位的新骨形成,并且可見到新生毛細血管;第8周時受區骨邊緣可觀察到新骨與脫礦牙本質基質牙粉末的直接愈合,新骨滲透到脫礦牙本質基質牙粉末的顆粒之間,也觀察到吞噬脫礦牙本質基質牙粉末的巨噬細胞。
綜上所述,本實驗所用的移植材料隨時間的變化逐漸被吸收,并具有周圍新骨可滲透的骨傳導能力。熟石膏在以往的研究中被認為是對人體無害的、可吸收的、但無骨傳導能力的材料。在本實驗中熟石膏大部分被消失,因此不能進行正確的組織學評價,但能觀察到與移植初期相比,隨時間的變化逐漸被吸收,8周時幾乎看不到剩余的熟石膏。第3周時,可觀察到結締組織內的慢性炎性細胞浸潤,但第5周時炎性細胞明顯減少,凡乎看不到炎性細胞浸潤。
本實驗中使用的脫礦牙本質基質牙粉末是同種異體的牙齒,它是在1200℃以上的高溫處理的方法從牙齒中提取無機物的,因此考慮它無免疫原性,但今后仍需進行免疫學相關研究。
[1]San Julian M,Valenti A.Bone transplant[J].An Sist Sanit Navar,2006,29(2):125-136
[2]Goldberg VM,Stevenson S.Natural history of autografts and a-llografts[J].Clin Orthop Relat Res,1987,(225):7-16
[3]Le Geros RZ.Properties of osteoconductive biomaterials:calcium phosphates[J].Clin Orthop Relat Res,2002,(395):81-98
[4]張 明,楊智賢,石展英,等.自體骨泥混入骨膜碎片植骨與單純自體骨泥植骨修復骨缺損的效果對比實驗[J].中國臨床康復,2006,9(30):76-79
[5]王丁丁,曾 戎,楊敏兒,等.緩釋型重組人骨形態發生蛋白2/殼聚糖生物骨修復材料誘導骨形成[J].中國組織工程研究與臨床康復,2011,15(25):4583-4586
[6]鮑濟波,謝志剛.脫礦牙本質基質骨誘導作用的研究[J].國際口腔醫學雜志,2011,38(3):329-331
[7]謝 迎,劉 斌,岑遠坤,等.種植體固定的鈦網復合脫鈣牙基質增高牙槽嵴的研究[J].中國修復重建外科雜志,2008,4(22):476-180
[8]岑遠坤,李 文,廖運茂,等.脫鈣牙本質基質及其復合物整復節段性骨缺損的組織學觀察華[J].西口腔醫學雜志,1998,8(16):263-165
[9]Li J,Yang J,Zhong X,et al Demineralized dentin matrix composite collagen material for bone tissue regeneration[J].J Biomater Sci Polym Ed,2013,24(13):1519-1528
[10]Reis-Filho CR,Silva ER,Martins AB,et al.Demineralised human dentine matrix stimulates the expression of VEGF and accelerates the bone repair in tooth sockets of rats[J].Arch Oral Biol,2012,57(5):469-476
[11]Yagihashi K,Miyazawa K,Togari K,et al.Demineralized dentin matrix acts as a scaffold for repair of articular cartilage defects[J].Calcif Tissue Int,2009,(3):210-220
[12]Gomes MF,Destro MF,Banzi EC,et al.Optical density of bone repair after implantation of homogenous demineralized dentin matrix in diabetic rabbits[J].Braz Oral Res,2008,22(3):275-280
[13]李伯翰,劉洪臣,鄂玲玲.蛋白質組學在骨質疏松癥大鼠頜骨組織差異蛋白篩選和鑒定中的應用[J].中華老年口腔醫學雜志,2012,2(10):111-114
[14]Gomes MF,Destro MF,Banzi EC,et al.Optical density of bone repair after implantation of homogenous demineralized dentin matrix in diabetic rabbits[J].Braz Oral Res,2008,22(3):275-280
[15]Mora-Rincones OA,Corona-Rodríguez JC,Díaz-Carvajal AL,et al.Aplication of demineralized human bone matrix in the surgical dental fusion treatment.Report of a case[J].Invest Clin,2008,49(2):239-249
[16]Guo W,He Y,Zhang x,et a1.The use of dentin matrix scaffold and dental follicle cells for dentin regeneration[J].Biomaterials,2009,30(35):6708-6723
[17]Bakhshalian N,Jalayer T,Shahoon H,et al.Osteopromotive property of allogenic demineralized dentin matrix:a pilot study[J].J West Soc Periodontol Periodontal Abstr,2013,61(2):35-38
[18]王永剛,張曉梅,譚家莉,等.脫礦牙本質基質對人牙髓干細胞體外增殖、牙向分化能力的影響[J].口腔醫學,2012,32(3):230-239
[19]Zhang SM,Liu J,Zhou W,et al.Interfaeialfabrieation and Property of hydroxyap-atite/Polylactide resorbable bone fixation composites[J].Current Applied Physics,2005,5(5):516-518

