微生物冷凍干燥保藏技術(shù)的影響因素分析
李偉杰,蔣桃珍,魏財(cái)文,豈曉鑫,田 野
(中國(guó)獸醫(yī)藥品監(jiān)察所,北京100081)
微生物保藏就是對(duì)活體微生物群體進(jìn)行有效的保藏,微生物保藏的基本目的是保持其純度、活性并盡可能減少變異,最終目的是為科技創(chuàng)新和生物經(jīng)濟(jì)發(fā)展提供有效的支撐。目前用于微生物的保藏技術(shù)可以分為四類:傳代法、干燥法、冷凍法和冷凍干燥法[1],其原理主要是運(yùn)用干燥、低溫和隔絕空氣的手段,抑制微生物的新陳代謝,使其生命活動(dòng)處于半永久性休眠狀態(tài),從而達(dá)到保藏的目的。現(xiàn)在簡(jiǎn)易的保藏方法,例如定期移植法、液體石蠟法,在很多實(shí)驗(yàn)室和保藏機(jī)構(gòu)還在使用,而砂土保藏法、硅膠干燥法等簡(jiǎn)易的保藏方法,已經(jīng)很少見(jiàn)到。當(dāng)今公認(rèn)的最安全、最可靠的長(zhǎng)期保存微生物的方法是冷凍法和冷凍干燥法,它們適用于大多數(shù)微生物的保藏。
冷凍干燥保藏技術(shù)適用范圍廣泛,除少數(shù)不產(chǎn)生孢子只產(chǎn)生菌絲體的絲狀真菌不宜采用外,其它微生物如細(xì)菌、病毒等均可采用此方法。其基本原理是微生物和凍干保護(hù)劑在低溫下先行凍結(jié)至共晶點(diǎn)以下,然后在適當(dāng)?shù)恼婵窄h(huán)境下進(jìn)行冰晶升華干燥,隨后進(jìn)行解吸干燥,除去部分結(jié)合水,從而獲得干燥的微生物產(chǎn)品,最后進(jìn)行真空熔封,在低溫、避光環(huán)境下保藏[2]。
1 影響冷凍干燥保藏的因素
1.1 菌齡和細(xì)胞濃度 凍干微生物的菌齡對(duì)其冷凍干燥保藏后細(xì)胞存活率有重要影響,例如鼠李糖乳桿菌在生長(zhǎng)的穩(wěn)定期進(jìn)行冷凍干燥,細(xì)胞存活率為31% ~50%,而在生長(zhǎng)對(duì)數(shù)期為14%,在生長(zhǎng)遲緩期僅為2%[3]。研究表明:生長(zhǎng)時(shí)期不同,細(xì)胞的生理狀態(tài)差異很大,對(duì)外界環(huán)境條件的反應(yīng)程度不一。處于穩(wěn)定期的細(xì)胞或成熟的孢子對(duì)不良環(huán)境具有較強(qiáng)的抗性,因而,保藏不產(chǎn)芽孢細(xì)菌、酵母菌,應(yīng)采用對(duì)數(shù)末期或穩(wěn)定期初期的細(xì)胞;而保藏產(chǎn)芽孢細(xì)菌、放線菌和霉菌,要用成熟的孢子,相應(yīng)的時(shí)期為產(chǎn)芽孢細(xì)菌在細(xì)胞的分化階段、放線菌在生長(zhǎng)II期,霉菌在無(wú)性孢子繁殖期和有性孢子繁殖期。在冷凍干燥保藏技術(shù)中,為保證在使用時(shí)有足夠數(shù)量存活的細(xì)胞,凍干前通常要加大細(xì)胞密度,細(xì)菌和放線菌濃度一般在108~109CFU/mL,酵母菌和霉菌孢子的濃度一般要大于107CFU/mL。
1.2 凍干保護(hù)劑 凍干保護(hù)劑可分為小分子保護(hù)劑(如低聚糖類、醇類和緩沖鹽類)和大分子保護(hù)劑(如蛋白質(zhì)、多肽類和多糖類)。小分子保護(hù)劑,一般具有很強(qiáng)的親水性,分子結(jié)構(gòu)中含有氫鍵,在冷凍或干燥過(guò)程中,可與菌體細(xì)胞膜磷脂中的磷酸基團(tuán)或菌體蛋白質(zhì)極性基團(tuán)形成氫鍵,保護(hù)細(xì)胞膜和蛋白質(zhì)結(jié)構(gòu)與功能的完整性。而大分子保護(hù)劑通過(guò)“包裹”形式保護(hù)菌體,同時(shí),促進(jìn)低分子保護(hù)劑發(fā)揮作用[4]。保護(hù)劑類型的選擇主要取決于菌株的生物學(xué)特性,脫脂牛乳、血清、蔗糖等既是有效的凍干保護(hù)劑又是很好的低溫保護(hù)劑。研究表明利用海藻糖作為凍干保護(hù)劑可以提高微生物的存活率[5],其中一個(gè)重要原因是海藻糖的玻璃化溫度較高,而玻璃化溫度越高,凍干樣品在溫度升高時(shí)更容易保持穩(wěn)定。由于蛋白的玻璃化溫度相對(duì)更高,因此在微生物保藏中經(jīng)常把蛋白和糖的混合物作為凍干保護(hù)劑。Abadias等[6]試驗(yàn)表明 Candida sake利用脫脂牛乳和碳水化合物作保護(hù)劑,菌株細(xì)胞存活率可達(dá)85.9%。
1.3 冷凍干燥工藝
1.3.1 預(yù)凍 預(yù)凍過(guò)程一方面要保護(hù)微生物的主要性能不變,另一方面要獲得凍結(jié)后微生物有合理的結(jié)構(gòu),以利于水分的升華。預(yù)凍效果主要由3個(gè)方面決定:預(yù)凍速率、預(yù)凍最低溫度、預(yù)凍時(shí)間。(1)預(yù)凍速率是影響微生物存活率的重要因素,由于微生物細(xì)胞對(duì)水分的滲透率不同,導(dǎo)致不同微生物最佳預(yù)凍速率不同。快速凍結(jié),胞內(nèi)的水分來(lái)不及通過(guò)細(xì)胞膜滲出,胞內(nèi)溶液過(guò)冷而結(jié)冰,細(xì)胞的體積膨大,最后導(dǎo)致細(xì)胞破裂;慢速凍結(jié),胞外溶液中水分大量結(jié)冰,溶液的濃度提高,胞內(nèi)的水分便大量向外滲透,導(dǎo)致細(xì)胞的劇烈收縮,造成細(xì)胞損傷[7]。實(shí)驗(yàn)證明,快速凍結(jié)導(dǎo)致升華速率低,解吸速率快,慢速凍結(jié)反之。實(shí)際上一般凍干微生物樣品的預(yù)凍速率介于快凍與慢凍之間。就細(xì)菌而言,通常采用分段降溫速率,從室溫快速降到約4℃,然后每分鐘降低1℃至-40℃,最后按每分鐘3~5℃的速率降至-70℃左右[7]。(2)預(yù)凍最低溫度一般應(yīng)低于溶液共晶點(diǎn)溫度,即在共晶點(diǎn)溫度以下8~10℃。共晶點(diǎn)與微生物類群、保護(hù)劑的種類和濃度有關(guān)。(3)適宜的預(yù)凍時(shí)間是指一次干燥之前所有的微生物樣品均已凍實(shí)所需要的時(shí)間,以免因抽真空而引起噴瓶。若預(yù)凍時(shí)微生物樣品凍結(jié)不實(shí),凍干后微生物樣品表面凹凸不平。一般要求凍干瓶裝厚度不超過(guò)10 mm。微生物樣品的固體含量一般為2% ~10%,如低于2%,凍干微生物樣品結(jié)構(gòu)的機(jī)械性能就可能不穩(wěn)定,而高于10%則凍干不易成功,且復(fù)水也比較困難[8]。
1.3.2 一次干燥(升華干燥) 一次干燥主要是使微生物樣品中凍結(jié)的自由水升華逸出。升華干燥的時(shí)間與微生物樣品的種類、分裝的厚度及升華時(shí)提供的熱量有關(guān)。凍干期間水升華的驅(qū)動(dòng)力為微生物樣品與冷阱之間的溫差。通常升華干燥階段冷阱溫度為-60℃(至少比微生物樣品溫度低20℃)。解吸干燥階段冷阱溫度要求低至-80℃,這樣獲得的凍干品殘留水量較少。為達(dá)到較快的干燥速度,微生物樣品溫度要求盡可能高,但必須低于共晶點(diǎn)溫度或崩解溫度,以防止微生物樣品熔化或崩解,出現(xiàn)干縮和鼓泡現(xiàn)象,造成微生物凍干樣品溶解性差[9]。在凍干時(shí)主要靠傳導(dǎo)方式提供熱量,凍干品的熱量主要從擱板獲得,擱板與微生物樣品之間有效的熱傳遞與界面溫度所對(duì)應(yīng)的飽和蒸汽壓和干燥室內(nèi)真空度之差有關(guān)。升華階段的真空度在10~30 Pa時(shí),較有利于熱量的傳遞和升華的進(jìn)行。若壓強(qiáng)過(guò)低,則對(duì)傳熱不利,微生物樣品不易獲得熱量,升華速率反而降低,對(duì)設(shè)備的要求也更高;而當(dāng)壓強(qiáng)過(guò)高時(shí),微生物樣品內(nèi)冰的升華速度減慢,微生物樣品自身溫度會(huì)上升,當(dāng)高于共晶點(diǎn)溫度時(shí)微生物樣品將發(fā)生熔化而導(dǎo)致凍干失敗。干燥室壁溫、底盤側(cè)邊高度、安瓿瓶的排列方式均會(huì)影響傳熱效果,并將影響升華速率[10]。
1.3.3 二次干燥(解吸干燥) 二次干燥主要是去除部分結(jié)合水。這部分水主要靠范德華力和氫鍵吸附在微生物樣品上,需要更多的能量才能將其除去。升華干燥后微生物樣品殘留水分通常在10%左右,解吸干燥后殘余水分一般應(yīng)低于2%。凍干微生物樣品中的殘留水分對(duì)凍干微生物質(zhì)量影響很大,殘留水分過(guò)多,微生物容易失活,穩(wěn)定性變差。為控制凍干微生物樣品中的殘留水分,解吸干燥時(shí)應(yīng)在保持微生物樣品活性的條件下選擇允許的最高溫度,真空度需盡可能提高,一般這一過(guò)程需4~6 h。自動(dòng)化較高的凍干機(jī)可通過(guò)壓力升高試驗(yàn)以獲得對(duì)殘留水分進(jìn)行控制的相應(yīng)數(shù)據(jù)。微生物冷凍干燥一般工藝曲線見(jiàn)圖1[11],在實(shí)際應(yīng)用中要根據(jù)不同微生物種類和選用的凍干保護(hù)劑做適當(dāng)?shù)膬?yōu)化和調(diào)整。
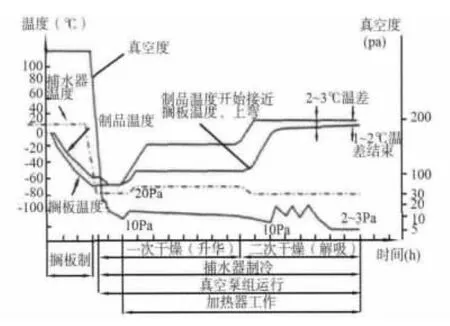
圖1 冷凍干燥一般工藝曲線
2 凍干微生物樣品的常見(jiàn)問(wèn)題及解決措施
2.1 噴瓶現(xiàn)象 噴瓶現(xiàn)象是由于微生物樣品在預(yù)凍時(shí),沒(méi)有完全凍實(shí)就抽真空的緣故。解決方法是適當(dāng)延長(zhǎng)預(yù)凍時(shí)間。
2.2 干縮現(xiàn)象 干縮現(xiàn)象是由于微生物樣品在升華干燥過(guò)程中,溫度超過(guò)了共晶點(diǎn)或崩解溫度,出現(xiàn)局部熔化,由液體蒸發(fā)為氣體,造成體積縮小,或者干燥產(chǎn)品溶入液體之中,造成體積縮小。解決方法是降低加熱溫度和提高凍干箱的真空度。
2.3 剩余水分不合格現(xiàn)象 剩余水分不合格是由于解吸干燥的時(shí)間不夠,或微生物樣品達(dá)到允許的最高溫度后未恢復(fù)高真空。解決方法是延長(zhǎng)解吸干燥的時(shí)間,并在產(chǎn)品達(dá)到允許的最高溫度后恢復(fù)高真空。
2.4 溶解性差的問(wèn)題 產(chǎn)品干燥過(guò)程中發(fā)生局部濃縮,例如產(chǎn)品內(nèi)部有夾心的硬塊,它是在升華中發(fā)生熔化,產(chǎn)生蒸發(fā)干燥濃縮造成的。解決方法是適當(dāng)降低板層溫度,提高凍干箱的真空度或延長(zhǎng)升華干燥的時(shí)間[9]。
3 結(jié)語(yǔ)
微生物冷凍干燥保藏技術(shù)涉及生物學(xué)、機(jī)械、制冷、真空和自動(dòng)化控制等多門學(xué)科,影響因素眾多,包括菌齡、細(xì)胞濃度、凍干保護(hù)劑、冷凍干燥工藝、安瓿瓶的規(guī)格等。隨著微生物冷凍干燥保藏技術(shù)與設(shè)備的日益完善,以及對(duì)影響微生物冷凍干燥保藏各種影響因素的深入研究,可以使我們不斷提高微生物保存的質(zhì)量,延長(zhǎng)其保存期限,進(jìn)而對(duì)其質(zhì)量加以控制。
[1]李 雁,鄭從義.微生物物種多樣性的保護(hù)與其資源保藏[J].氨基酸和生物資源,2003,25(3):4-6.
[2]霍 貞.冷凍干燥的工藝流程及其應(yīng)用[J].干燥技術(shù)與設(shè)備,2007,5(5):261 -264.
[3]Corcoran B M,Ross R P,F(xiàn)itzgerald G F,et al.Comparative survival of probiotic lactobacilli spray-dried in the presence of prebiotic substances[J].Journal of Applied Microbiology,2004,96(5):1024-1039.
[4]Palmfeldt J,Radstrom P,Hahn-Hagerdal B.Optimisation of initial cell concentration enhances freeze-drying tolerance of Pseudomonas chlororaphis[J].Cryobiology,2003,47(1):21 -29.
[5]楊曉菲,王 棟.副豬嗜血桿菌凍干保護(hù)劑的研究[J].中國(guó)獸藥雜志,2013,47(8):18-21.
[6]Abadias M,Teixido N,Usall J,et al.Viability,efficacy,and storage stability of freeze-dried biocontrol agent Candida sake usingdifferent protective and rehydration media[J].Journal of Food Protection,2001,64(6):856-861.
[7]陶天申,楊瑞馥,冬秀珠.原核生物系統(tǒng)學(xué)[M].北京:化學(xué)工業(yè)出版社,2007:73-75.
[8]劉洪斌,吳 強(qiáng),鄭桂軍.獸醫(yī)生物制品冷凍真空干燥技術(shù)研究進(jìn)展[J].畜牧獸醫(yī)科技信息,2004,(10):12-14.
[9]林澤培.耐熱保護(hù)劑活疫苗凍干技術(shù)[J].中國(guó)獸藥雜志,2009,43(3):58-60.
[10]Gan K H,Bruttini R,Crosser O K,et al.Freeze-drying of pharmaceuticals in vials on trays:effects of drying chamber wall temperature and tray side on lyophilization performance[J].Int J Heat and Mass Transfer,2005,48(9):1675.
[11]徐成海,張世偉,彭潤(rùn)玲,等.真空冷凍干燥的現(xiàn)狀與展望(二)[J].真空,2008,45(3):1-13.

