苦參堿減輕博來霉素致大鼠肺纖維化
曾賽麗,游曉星,張秀峰,何振華*
(南華大學 1.附屬第二醫院 呼吸內科; 2.病原生物學研究所, 湖南 衡陽 421001)
苦參堿減輕博來霉素致大鼠肺纖維化
曾賽麗1,游曉星2,張秀峰1,何振華1*
(南華大學 1.附屬第二醫院 呼吸內科; 2.病原生物學研究所, 湖南 衡陽 421001)
目的觀察苦參堿對博來霉素誘導的肺纖維化大鼠的保護作用,并探討其可能的分子機制。方法大鼠隨機分為對照組、模型組、潑尼松和苦參堿處理組。模型組氣管內給予博萊霉素(5 mg/kg) 建立肺纖維化動物模型。建模后第1天起,分別每日予以潑尼松(0.56 mg/kg)和不同劑量的苦參堿(50和100 mg/kg)灌胃1次。于第7、14和28天時,獲取大鼠取肺組織并行HE和Masson染色。檢測肺組織勻漿中丙二醛(MDA)和羥脯氨酸(HYP)含量;RT-PCR法檢測肺組織血紅素氧合酶(HO-1) mRNA的表達;ELISA檢測TNF-α產生。結果HE染色顯示,模型組7 d以炎性反應為主, 28 d可見大量的肺成纖維細胞,Masson染色見有更多膠原沉積。而苦參堿與潑尼松能明顯減輕其炎性反應和纖維化程度。模型組中MDA和HYP含量較對照組顯著增高(Plt;0.05),而予以苦參堿及潑尼松干預以后,二者含量均有下降,以28 d時改變最明顯(Plt;0.05)。在正常肺組織中,HO-1處于低表達狀態,TNF-α含量低。而模型組二者的含量明顯上升(Plt;0.01),苦參堿干預后,兩者表達水平顯著降低(Plt;0.05)。結論苦參堿具有減輕肺纖維化形成的作用,其機制可能與調節機體氧化-抗氧化失衡,抑制TNF-α的產生以及下調HO-1的表達水平有關。
苦參堿;血紅素氧合酶-1;腫瘤壞死因子-α;肺纖維化
肺纖維化(pulmonary fibrosis,PF)是一種以肺泡上皮的損傷、炎性細胞聚集和成纖維細胞過度增殖為病理特征的彌漫性肺間質性疾病[1]。目前其發病機制尚未明了,但氧化應激在炎性反應和免疫介導的組織損傷中起了重要作用。氧自由基不僅可直接損傷細胞和組織,而且能調節一系列炎性介質的產生和釋放[2-3]。其中一些炎性細胞因子又可誘導內源性氧自由基的產生,進一步促進了氧化-抗氧化失衡生,形成惡性循環。血紅素氧合酶-1(heme oxygenase-1,HO-1)是一種應激蛋白,是機體最重要的內源性保護體系之一,但HO-1的過度表達也可能是參與肺纖維化的重要因素[4-5]。
目前肺纖維化治療推薦糖皮質激素和硫唑嘌呤或環磷酰胺聯合治療方案[6]。近年來苦參堿(Matrine)在抗纖維化中的作用已經得到了廣泛的研究,但對肺纖維化是否也具有拮抗作用,目前仍不清楚[7-8]。本研究擬通過博萊霉素誘導建立的大鼠肺纖維化模型,探索苦參堿對博來霉素致大鼠肺纖維化的影響,并觀察苦參堿是否可以通過下調HO-1和TNF-α發揮作用。
1 材料與方法
1.1 實驗動物與主要試劑
SPF級雄性SD大鼠90只,體質量180~200 g,(南華大學實驗動物中心提供,合格證號:2009A023)。食用標準飼料,實驗期間大鼠均自由飲水。苦參堿粉針劑(純度98%,吉林玉皇藥業有限公司,批號081123),醋酸潑尼松片(天津太平洋制藥有限公司生產,批號080201),注射用鹽酸博來霉素(日本化藥株式會社生產,批號740104)。Trizol試劑(Invitrogen公司),Quant一步法 RT-PCR試劑盒(Tiangen)。兔抗鼠HO-1多克隆抗體、HPR標記羊抗兔多克隆抗體(Santa Cruz公司)。丙二醛和羥脯氨酸測定試劑盒(南京建成生物工程研究所)。TNF-α ELISA試劑盒(深圳欣博盛生物科技有限公司)。
1.2 實驗分組與處理
將大鼠隨機分為正常對照組、模型組、潑尼松處理組和苦參堿干預組(每組18只)。用腹腔注射10%水合氯醛麻醉(2.5 mL/kg),經氣管軟骨環間隙緩慢注入0.3 mL博萊霉素溶液(5 mg/kg)。苦參堿組每天以50和100 mg/kg苦參堿溶液灌胃1次,潑尼松組每天以5 mg/kg潑尼松灌胃1次,正常對照組和模型組以等量0.9%氯化鈉注射液灌胃。
1.3 肺組織病理組織學檢查
肺組織用10%甲醛溶液固定,常規石蠟包埋。常規脫水,透明,封片。Masson染色根據試劑盒提供的步驟進行操作,主要包括切片脫蠟處理、Masson復合染色,最后脫水,透明,封固。
1.4丙二醛(malondialdehyde,MDA)和羥脯氨酸(hydroxyproline,HYP)測定
取0.1 g肺組織解凍后,勻漿,按南京建成生物工程研究所提供的丙二醛、羥脯氨酸測定試劑盒說明書進行操作,使用可見光分光光度計測得各管吸光度值,按照說明書上公式計算肺組織丙二醛和羥脯氨酸含量,單位分別為nmol/mg·protein和μg/mg·protein。
1.5 RT-PCR檢測HO-1 mRNA的表達
采用Trizol法提取肺組織總RNA。設計HO-1特異性引物:正向:5′-TGATAGAAGAGGCCAAGACT GCGTT-3′;反向:5′-TGAGTGTAAGGACCCATCGGA GAAG-3′,擴增產物228 bp。內參β-actin正向引物:5′-CCTAAGGCCAACCGTGAA-3′,反相引物:5′-CTAGGAGCCAGGGCAGTAATC-3′,產物635 bp。擴增條件:94 ℃變性2 min;隨后94 ℃ 30 s,57 ℃退火30 s;65 ℃延伸1 min;共35個循環;最終延伸10 min。以目的基因/內參的吸光度比值表示。
1.6 ELISA檢測TNF-α 產生水平
取肺組織后,加入一定量的PBS(pH 7.4),用手工勻漿器將標本勻漿充分。3 000r/min離心20 min,收集上清。
1.7 統計學分析
2 結果
2.1 肺組織病理變化
HE染色結果顯示,空白對照組大鼠肺組織結構清晰。模型組28d時肺泡結構破壞或消失,肺泡間隔明顯增寬,肺泡結構受壓萎縮,肺泡腔變窄。而苦參堿組(100 mg/kg)和潑尼松組病理變化程度都輕于模型組。Massosn染色結果顯示,肺組織內可見大量膠原纖維沉積,融合成片。苦參堿組及潑尼松組相應時間點肺纖維化程度均低于模型組(圖1)。
2.2苦參堿對肺纖維化大鼠肺組織中MDA和HYP的影響
與空白對照組相比,模型組MDA水平最高(Plt;0.05)。潑尼松和不同濃度苦參堿處理后,MDA含量明顯降低(Plt;0.05)。與空白對照組比較,各模型組大鼠肺組織中HYP含量均升高(Plt;0.05),100 mg/kg苦參堿處理后, HYP含量顯著降低(Plt;0.05)(表1)。
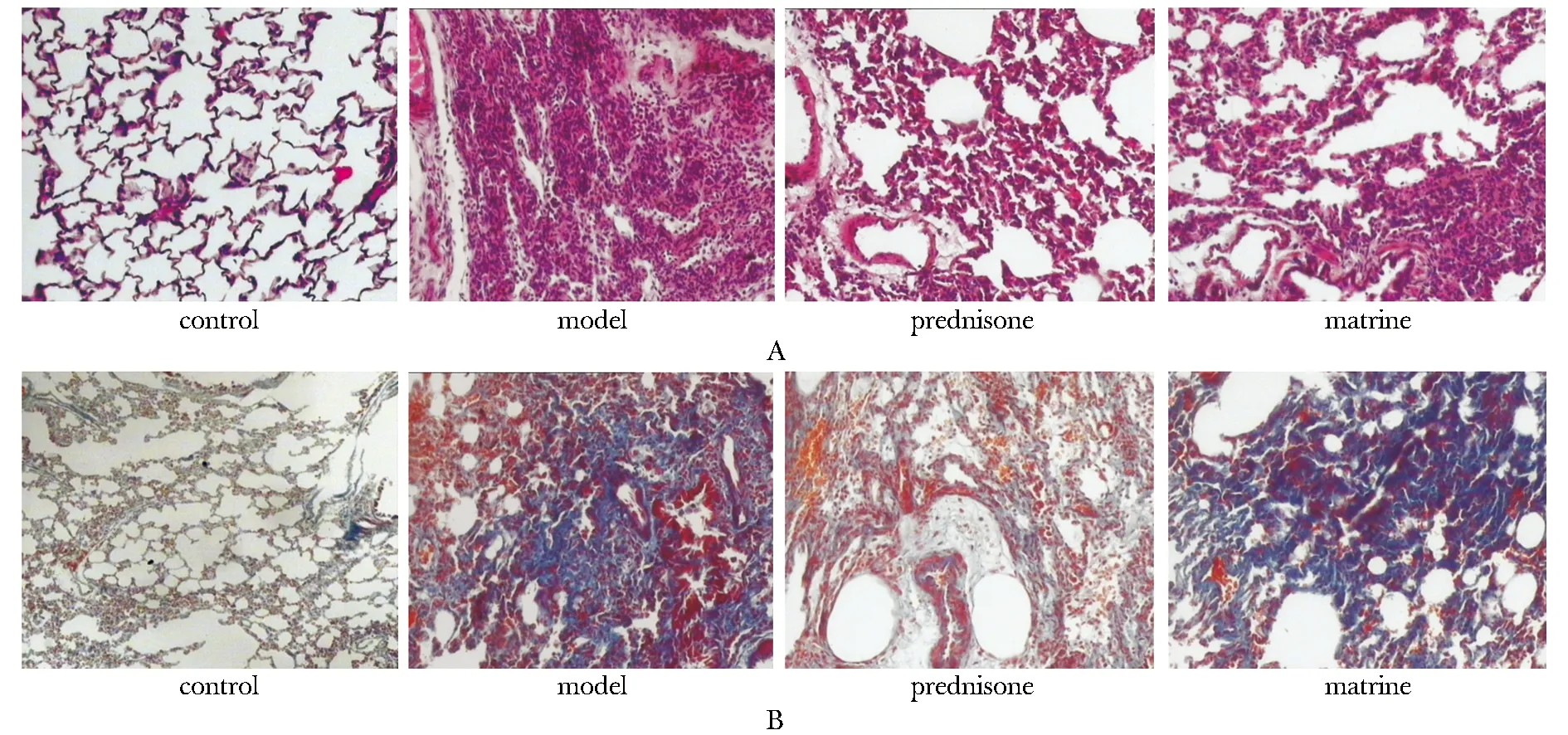
A.HE staining; B.Masson staining圖1 28 d時各組肺組織病理學改變Fig 1 Pathologic change in the lung tissue at 28 days(×100)
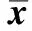
表1 各組MDA和HYP的含量Table 1 MDA and HYP concentration in the four groups(±s,n=3)
*Plt;0.05 compared with control;#Plt;0.05 compared with model.
2.3苦參堿對肺纖維化大鼠肺組織中HO-1mRNA表達的影響
與空白對照組相比,模型組大鼠肺組織中HO-1 mRNA的表達明顯增加。藥物干預后,苦參堿低劑量組、苦參堿中劑量組及潑尼松組與模型組相比,其HO-1 mRNA表達均相對降低(Plt;0.05),尤以7 d時苦參堿中劑量組及潑尼松組明顯(圖2)。
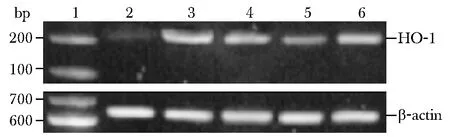
1.marker;2.control;3.model;4.prednisone;5.matrine(100 mg/kg);6.matrine(50 mg/kg)圖2 第7天各處理組HO-1 mRNA表達情況Fig 2 HO-1 mRNA expression in groups at 7days
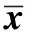
表2 7 d HO-1 mRNA灰度掃描比值Table 2 Expression of HO-1 mRNA(±s,n=3)
*Plt;0.05 compared with control;#Plt;0.05 compared with model.
2.4苦參堿對肺纖維化大鼠肺組織中TNF-α表達的影響
與空白對照組相比,模型組大鼠肺組織中TNF-α的表達明顯升高,7 d時為最高峰,后呈逐漸下降;予以藥物干預以后,與模型組比較,苦參堿低劑量組、苦參堿中劑量組及潑尼松組TNF-α表達均降低(Plt;0.05),尤以苦參堿中劑量組及潑尼松組降低明顯(Plt;0.01)(圖3)。
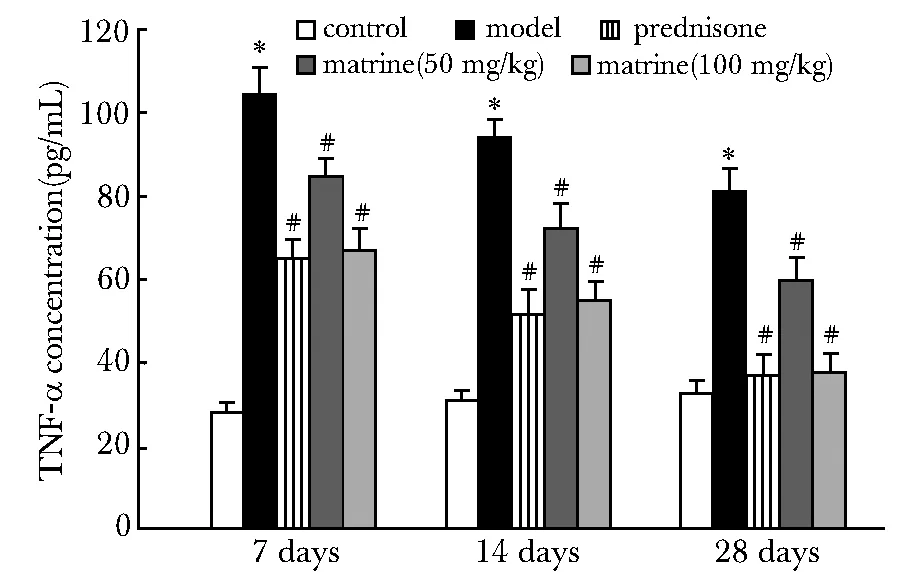
*Plt;0.05 compared with control; #Plt;0.05 compared with model圖3 不同處理組TNF-α水平變化Fig 3 TNF-α concentration in different groups
3 討論
苦參堿來源于豆科植物苦參、苦豆子及廣豆根中,特別是在抗組織纖維化治療方面的作用,受到極大的關注。氧化應激是肺纖維化的重要發病機制之一。氧自由基能夠攻擊生物膜上的不飽和脂肪酸,引起脂質過氧化。MDA是其產物之一,因而MDA含量變化可以反應機體組織細胞氧化損傷程度。HYP是機體膠原蛋白的主要成分之一,為膠原蛋白所特有,可作為衡量膠原組織代謝的重要指標。本實驗發現,MDA、HYP含量與對照組相比,模型組明顯升高。予以苦參堿及潑尼松干預后,MDA的含量有下降,HYP含量下降,病理學檢查提示肺組織的肺纖維化程度減輕。說明苦參堿能減輕博來霉素導致肺組織脂質過氧化損傷,具有抗氧化作用,能調節機體氧化抗氧化平衡,具有抗纖維化形成的作用。HO-1是內源性的抗氧化劑,機體存在氧化損傷時,HO-1就會增加。本研究也發現HO-1在對空白照組表達呈低水平狀態,予以博來霉素建模后,肺內的HO-1表達增加,提示氧化損傷參與肺纖維化。但是在使用苦參堿干預后,MDA和HO-1水平有所下降。這可能是由于苦參堿本身具有抗氧化能力,可以增加機體抗氧化水平,調節氧化抗氧化失衡,能協同抗氧化酶HO-1共同發揮抗氧化損傷作用。
近年來,關于TNF-α在肺纖維化中的作用倍受關注[9]。本實驗結果表明: TNF-α在模型組中7 d時處于高峰,隨后逐漸下降,而肺組織7 d可以看見肺泡性反應與肺纖維化開始形成共同存在。苦參堿可能通過抑制TNF-α表達,抑制早期炎性反應,從而進一步減輕對其他致纖維化細胞因子的激活,而減輕肺纖維化。其機制可能是在肺纖維化早期通過介導肺泡炎性反應和肺損傷發揮作用,可以直接或間接激活其他致纖維化細胞因子[10]。
在博來霉素致肺纖維化的過程中,氧化損傷可能啟動前炎性反應,炎性反應再導致組織氧化損傷。如何在二者中找到一個平衡點,對于尋找抗肺纖維化新的治療方法具有重要的意義。苦參堿作為一種中藥,能夠調節機體氧-化抗氧化失衡,以雙重作用抗肺纖維化,且不良反應小,具有良好的應用前景。
[1] Stoia-Djeska I, Ceausu RA, Cimpean AM,etal. From basic lesions to a pathological staging of pulmonary fibrosis[J]. Rom J Morphol Embryol, 2013,54:63-69.
[2] Hecker L, Cheng J, Thannickal VJ. Targeting NOX enzymes in pulmonary fibrosis[J]. Cell Mol Life Sci, 2012,69:2365-2371.
[3] Gao F, Kinnula VL, Myllarniemi M,etal. Extracellular superoxide dismutase in pulmonary fibrosis[J]. Antioxid Redox Signal, 2008,10:343-354.
[4] Morse D. The role of heme oxygenase-1 in pulmonary fibrosis[J]. Am J Respir Cell Mol Biol, 2003,29:S82-86.
[5] Lee JC, Kinniry PA, Arguiri E,etal. Dietary curcumin increases antioxidant defenses in lung, ameliorates radiation-induced pulmonary fibrosis, and improves survival in mice[J]. Radiat Res, 2010,173(5):590-601.
[6] Shulgina L, Cahn AP, Chilvers ER,etal. Treating idiopathic pulmonary fibrosis with the addition of co-trimoxazole: a randomised controlled trial[J]. Thorax, 2013,68:155-162.
[7] Gao HY, Li GY, Lou MM,etal. Hepatoprotective effect of matrine salvianolic acid B salt on carbon tetrachloride-iInduced hepatic fibrosis[J]. J Inflamm (Lond), 2012,9:16-19.
[8] Zhang JP, Zhang M, Zhou JP,etal. Antifibrotic effects of matrine oninvitroandinvivomodels of liver fibrosis in rats[J]. Acta Pharmacol Sin, 2001,22:183-186.
[9] Przybyszewska M, Miloszewska J, Rzonca S,etal. Soluble TNF-alpha receptor I encoded on plasmid vector and its application in experimental gene therapy of radiation-induced lung fibrosis[J]. Arch Immunol Ther Exp (Warsz), 2011,59:315-326.
[10] 鄭金旭, 湯艷, 黃振杰, 等. 熱休克蛋白47參與TGF-β1促人胚肺細胞膠原合成[J]. 基礎醫學與臨床, 2011,31:965-969.
Matrine alleviates blemycin-induced pulmonary fibrosis in rats
ZENG Sai-li1, YOU Xiao-xing2, ZHANG Xiu-feng1, HE Zhen-hua1*
(1.Dept. of Respiratory Medicine, the Second Affiliated Hospital of University of South China;2.Institution of Pathogenic Biology, University of South China, Hengyang 421001, China)
ObjectiveTo discuss the molecular mechanism and protective effect of matrine on blemycin-induced pulmonary fibrosis rat.MethodsRats were randomly divided into five groups, the control group, model group, prednisone, matrine low dose and high dose group.Pulmonary fibrosis model was made by adminstrated blecomin (5 mg/kg) through trachea. From 1st day after modeling, the rats were fed prednisone acetate (0.56 mg/kg/d) or different dose matrine (50 and 100 mg/kg/d). At the 7, 14, 28 days of modeling, the lung tissue biopsy sections are observed by HE and Masson staining pathology. The malondialdehyde (MDA) level and hydroxyproline (HYP) content in lung tissue was detected,HO-1 mRNA was measured by RT-PCR, and by production of TNF-α. The lung tissue biopsy sections are detected by HE and Masson staining pathology.ResultsIn model group, in-flammatory response was the main event at 7 d. At 28 d, more lung fibroblast were found. The collagen was found more clearly. Pathological change in the matrine and prednisone treated group was less than that from model group. The MDA and HYP content in model group was higher as compared with normal control group (Plt;0.05), and decreased after matrine and prednisone treatment in 28 d (Plt;0.05). In the normal lung tissue, expression of HO-1 and production of TNF-α was very low, and increased in the model group. After drug intervention, the level of both TNF-α and HO-1 was decreased (Plt;0.05).ConclusionsMatrine can alleviate the fibrosis status in rats, and the mechanism may be associated to regulate oxidative-antioxidant imbalance and inhibition of TNF-α and HO-1 expression.
matrine; heme oxygenase-1; tumor necrosis factor-α; pulmonary fibrosis
2013-06-27
2013-11-04
湖南省科研條件創新專項(2010TT2022);湖南省衛生廳科研計劃(B2009058);衡陽市科學技術發展計劃(2009KJ42)
*通信作者(correspondingauthor): Hezhenhua0734@163.com
1001-6325(2014)04-0504-05
研究論文
R 563.9
A

