microRNA-1誘導大鼠骨髓間充質干細胞向心肌樣細胞分化過程中Notch信號分子的表達變化
鄧海燕,曾俊義,魏云峰,,王夢洪,,鄭澤琪,,張 婉,文 通
(南昌大學 第一附屬醫院 1.心血管內科; 2.江西省高血壓病研究所, 江西 南昌 330006)
研究論文
microRNA-1誘導大鼠骨髓間充質干細胞向心肌樣細胞分化過程中Notch信號分子的表達變化
鄧海燕1,曾俊義2*,魏云峰1,2,王夢洪1,2,鄭澤琪1,2,張 婉2,文 通1
(南昌大學 第一附屬醫院 1.心血管內科; 2.江西省高血壓病研究所, 江西 南昌 330006)
目的探討微小RNA-1對大鼠骨髓間充質干細胞向心肌樣細胞分化的影響及分化過程中Notch信號分子的表達變化。方法全骨髓貼壁培養法分離培養大鼠MSCs并進行流式細胞學鑒定,miR-1慢病毒載體感染大鼠MSCs(MSCsmiR-1)按培養時間將細胞分成4組:對照組、培養4、6和15 d組;光鏡下觀察細胞形態變化,qPCR檢測miR-1及心肌細胞特異性基因GATA-4、cTnI、α-actin表達,免疫熒光檢測cTnI表達,Western blot檢測α-actin表達;qPCR檢測Notch信號通路相關基因的表達變化。結果原代大鼠MSCs呈長梭形、漩渦狀生長,98%以上細胞表達CD44和CD29,不足1%的細胞表達CD45。MSCsmiR-1中miR-1表達水平持續上升,同時伴隨心肌特異性基因GATA-4、cTnI和α-actin的表達逐漸增強,感染4 d后可見cTnI在部分MSCsmiR-1中表達,同時可檢測到α-actin在MSCsmiR-1中表達;MSCsmiR-1向心肌樣細胞分化過程中,Notch信號分子Jagged1、Notch1、Notch3和Hey2表達水平逐漸下調,于15 d時下調幅度最大。結論傳導miR-1至大鼠MSCs中可促使其向心肌樣細胞的分化;且分化過程中伴隨著Notch信號分子Jagged1-Notch1/Notch3-Hey2表達水平下調。
miR-1;骨髓間充質干細胞;心肌樣細胞;Notch
微小RNA(microRNAs,miRNAs)作為生命過程中一類重要的調控因子成為近年來的一大研究熱點。研究表明, miRNAs在一系列生物學行為比如干細胞增殖、干細胞分化中起著非常重要的作用[1]。在眾多miRNAs中存在一類肌相關miRNAs,包括miR-1、miR-133、miR-206和miR-499等,其中以肌特異性miR-1的生物學作用尤為引人關注[2- 3]。目前認為,miR-1主要存在于脊椎動物的心臟組織中,在機體的心臟發育及心肌細胞的分化成熟過程中發揮著重要的調控作用[4]。因此,本研究通過miR-1慢病毒載體感染大鼠(mesenchymel stem cells,MSCs),探討miR-1對MSCs向心肌樣細胞分化的影響及分化過程中notch信號分子的表達變化,以期闡明MSCs向心肌樣細胞分化的相關機制。
1 材料與方法
1.1 材料
4周齡清潔級Wistar大鼠,體質量100~150 g,雌雄不限[江西中醫學院實驗動物中心,許可證號: SCXK(贛) 200520001]。α-MEM培養基和EDTA胰蛋白酶(Gibco公司),胎牛血清(Hyclone公司),倉鼠抗CD29單克隆抗體、小鼠抗CD44 單克隆抗體和小鼠抗CD45單克隆抗體(eBioscience公司),miR-1重組慢病毒載體(上海吉凱基因化學技術有限公司),反轉錄試劑盒、qPCR檢測試劑盒和miRNA qRT-PCR檢測試劑盒(GeneCopoeia公司),兔抗心肌肌鈣蛋白I多克隆抗體(Santa Cruz公司),小鼠抗心肌肌動蛋白α(武漢博士德公司),小鼠抗β-actin多克隆抗體(北京中杉金橋生物技術有限公司)。miR-1及U6引物來自GeneCopoeia公司(RmiRQP1188, RmiRQP9003)。
1.2 方法
1.2.1 大鼠MSCs分離、擴增培養及鑒定:頸椎脫臼法處死大鼠,無菌條件下取出股骨和脛骨,剪除兩端干骺端,用含10%胎牛血清的α-MEM培養基沖洗骨髓腔,制成細胞懸液,以1×109/L接種于25 cm2培養瓶中, 放置37 ℃、5% CO2培養箱中培養。24 h后可見少量貼壁細胞,48 h后第1次換液去除非貼壁細胞,此后每3天換液1次,待貼壁細胞達到80%~90%匯合時,0.25% EDTA胰蛋白酶消化傳代,培養至第3代時用于實驗。實驗前取適量第3代MSCs進行流式細胞學檢測,選取細胞表面標志物CD29、CD44和CD45作為檢測指標,以確定細胞純度。
1.2.2 重組慢病毒載體感染大鼠MSCs及實驗分組:預先構建miR-1重組慢病毒載體,感染前1天將細胞以4×104/孔接種到12孔板中,并加入常規培養基培養,當細胞的匯合率約為30%時按感染復數(MOI)50進行感染,同時加入終濃度為8 μg/mL的polybrene[5],放回培養箱孵育。24 h后更換正常培養基繼續培養。按培養時間將細胞分成對照組、培養4、6和15 d組。倒置熒光顯微鏡下觀察綠色熒光蛋白(GFP)表達情況,評價慢病毒感染效率。提取細胞總RNA,經純度及濃度測定后行qPCR檢測miR-1,總RNA提取、cDNA合成及qPCR均按試劑說明書進行。數據采集由ABI7500完成。miR-1的檢測以U6作內參,以2-△△Ct比較miR-1表達水平。
1.2.3 檢測心肌特異性基因的表達:取各組細胞進行總RNA提取、cDNA合成及qPCR反應,分別按試劑說明書進行。GATA-4:上游引物5′- CTGTGCCA ACTGCCAGACTA -3′,下游引物5′-AGATTCTTGGG CTTCCGTTT-3′,165 bp;α-actin:上游引物5′-AGCC ATGTACGTAGCCATCC-3′,下游引物5′-CTCTCAGC TGTGGTGGTGAA-3′,228 bp;cTnI:上游引物5′-CCT GCGTGGCAAGTTTAA-3′,下游引物5′-TTCCTTCTC AATGTCCTCCT-3′,94 bp;GAPDH:上游引物5′-CTC ATGACCACAGTCCATGC-3′,下游引物5′-TTCAGC TCTGGGATGACCTT-3′,155 bp。
1.2.4 細胞免疫熒光檢測cTnI的表達:收集各組細胞爬片行細胞免疫熒光檢測。棄去培養液, PBS沖洗, 4%多聚甲醛4 ℃固定20 min, 1%牛血清白蛋白(BSA)室溫30 min封閉非特異性抗原,1∶100稀釋的兔抗大鼠cTnI多克隆抗體于4 ℃孵育過夜,1∶200稀釋的TRITC標記羊抗兔IgG于37 ℃孵育1 h。封片后倒置熒光顯微鏡下觀察。實驗中用PBS代替一抗作陰性對照。
1.2.5 Western blot檢測α-actin的表達:分別收集各組細胞,提取總蛋白并用BCA法測定蛋白濃度。取50 μg處理的蛋白樣品進行聚丙烯酰胺凝膠電泳,半干轉條件下以恒流將蛋白樣品從膠轉移至NC膜上。5%脫脂奶粉室溫振蕩封閉1 h, 加入適當稀釋的一抗(α-actin濃度為1∶500,β-actin濃度為1∶1 000),4 ℃過夜;根據一抗來源選擇辣根過氧化物酶(HRP)標記的二抗,按相應比例稀釋后室溫下孵育1 h。TBST洗膜后加入發光液顯影,使用化學發光成像系統(LAS 4000)進行圖像采集及目標條帶分析。
1.2.6 Real time qPCR檢測Notch信號分子表達變化:分別取各組細胞進行總RNA提取、cDNA合成及qPCR反應,分別按試劑說明書進行。Notch信號通路相關基因引物見(表1)。
1.3 統計學分析
2 結果
2.1 大鼠MSCs分離培養與鑒定
MSCs接種24 h后少量開始貼壁,細胞形態均一,呈梭形或多角形。48 h后首次換液去除未貼壁細胞,3~4 d后可見放射狀排列的細胞集落,伸出長短不一、粗細不均的突起,梭形細胞為主(圖1A)。5 d時細胞集落生長范圍擴大,匯合80%~90%,經胰蛋白酶消化傳代后均勻鋪于瓶底,呈漩渦狀同向排列(圖1B)。第3代大鼠MSCs均一表達CD44和CD29,陽性率分別為98.03%,99.00%,而CD45呈陰性表達,陽性率僅為0.02%,證實培養所獲細胞為MSCs,且純度較高(圖2)。

表1 Notch信號通路相關基因引物序列
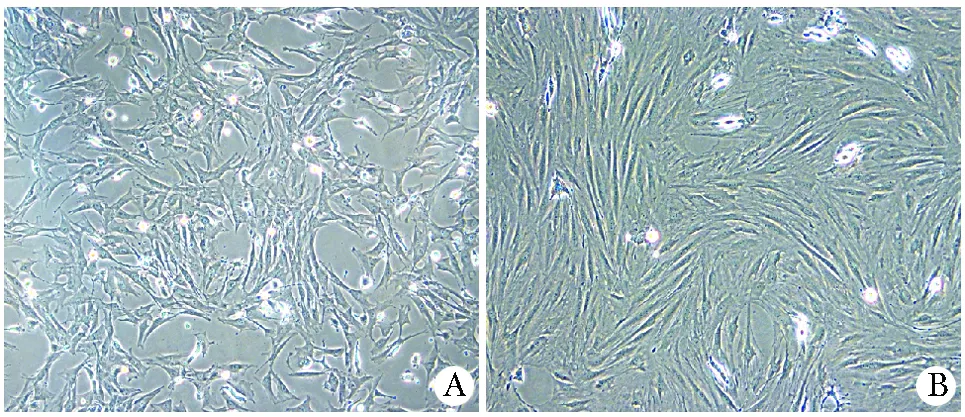
A .primary rat MSCs(×100);B.the third passage of rat MSCs(×100)圖1 大鼠MSCsFig 1 Micrographs of rat MSCs
2.2重組慢病毒載體感染大鼠MSCs效率及miR-1表達檢測
慢病毒感染大鼠MSCs第2天即可觀察到部分細胞表達GFP,細胞形態變化不明顯,隨培養時間推移,GFP陽性細胞逐漸增多,GFP表達逐漸增強,至4 d時綠色熒光蛋白表達基本達到穩定,其后持續高表達,感染效率達90%以上。到15 d時仍可見綠色熒光表達,部分細胞形態呈多角、短梭形變化(圖3)。miR-1表達水平隨時間逐漸增高,到15 d時MSCsmiR-1中miR-1表達量達到最高(表2)。
2.3 心肌特異性基因的表達變化
心肌特異性蛋白cTnI和α-actin只在誘導后的細胞中表達,表達水平逐漸上升,15 d時達到高峰;轉錄調控因子GATA-4在分化過程中的第4天表達水平稍下降,以后逐漸上升,一直持續到15 d(表3)。
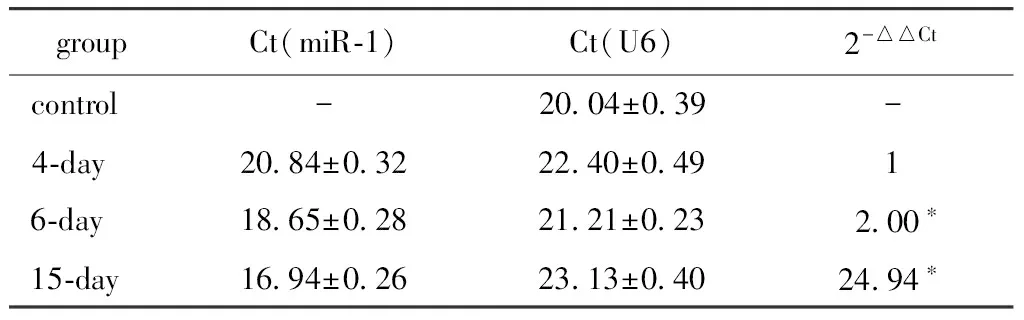
表2 MSCsmiR-1 中miR-1表達變化Table 2 Expression of miR-1 in MSCsmiR-1
*P<0.01 compared with day 4.
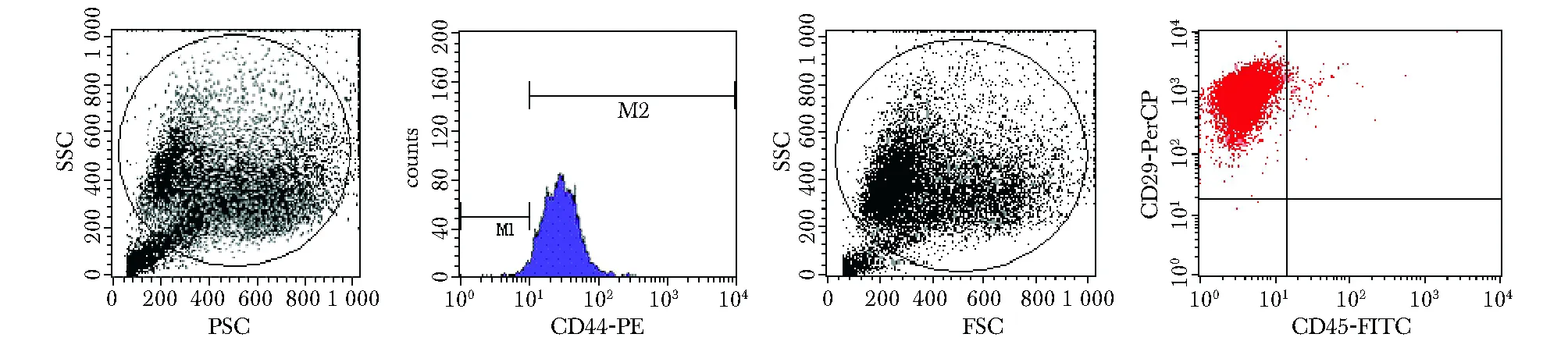
More than 98% of the MSCs population expressed CD44 and CD29,less than 1% cells were CD45 positive圖2 流式細胞檢測大鼠MSCs表面標志物Fig 2 Identification of MSCs phenotype by flow cytometry
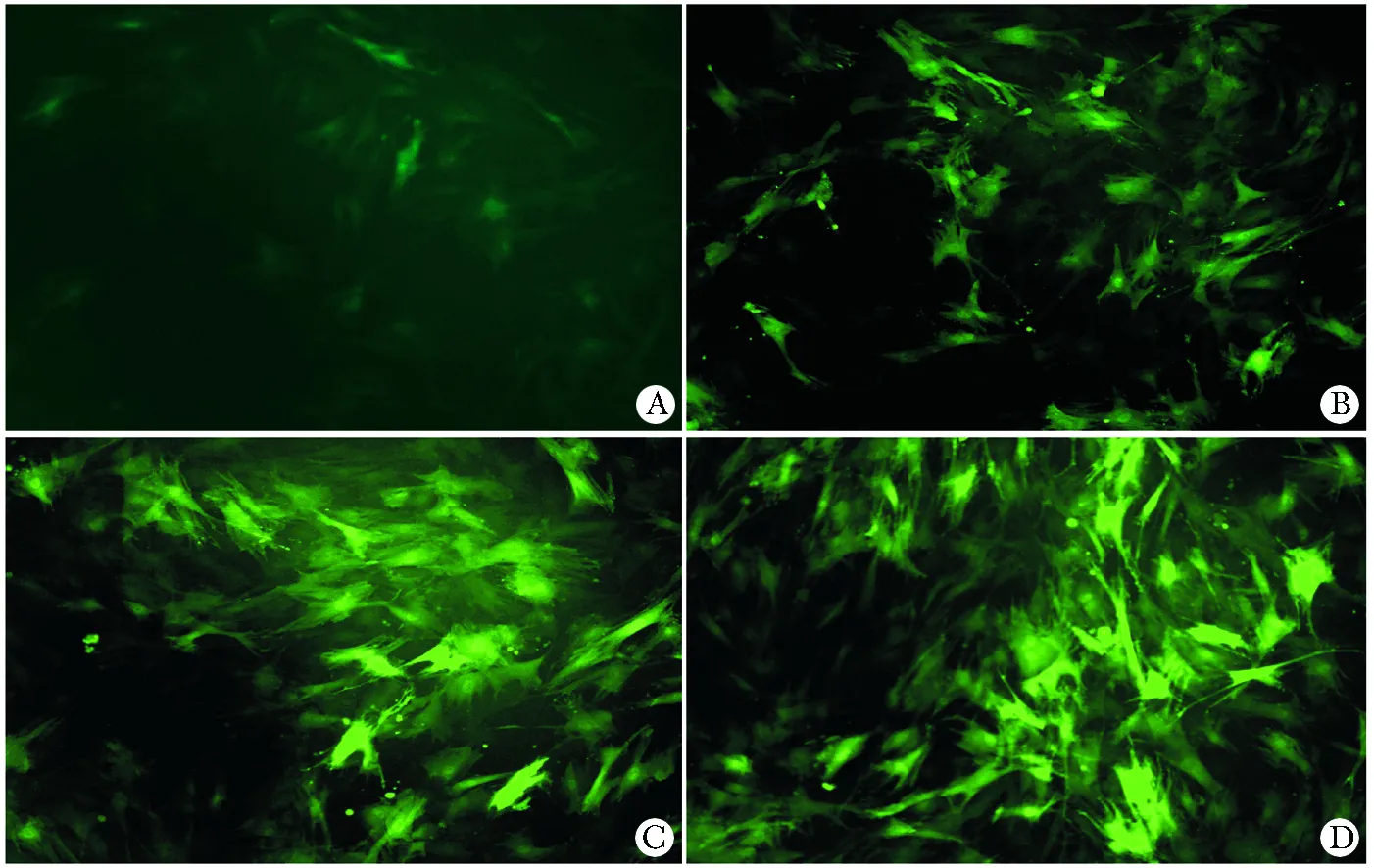
A.control group;B.4-day group;C.6-day group;D.15-day group圖3 MSCsmiR-1中GFP的表達Fig 3 GFP expression of MSCsmiR-1(×100)
2.4 免疫熒光檢測cTnI的表達
感染后的MSCsmiR-1細胞體積較前變長和寬大,形成類似肌管樣的形態特點。MSCsmiR-1于感染后第
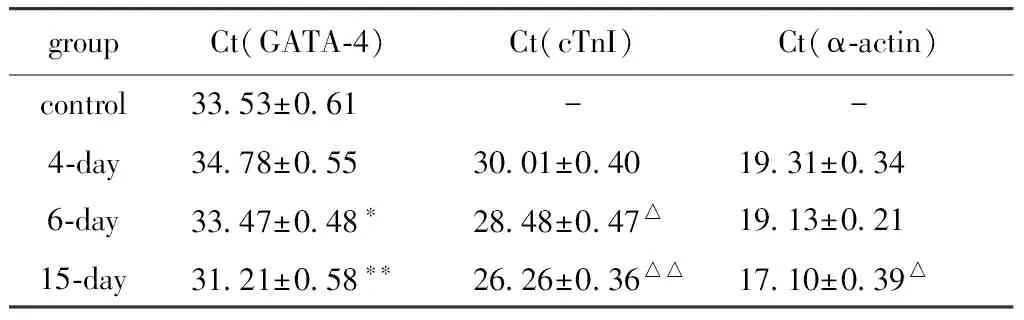
表3 MSCsmiR-1心肌特異性基因的表達變化
*P<0.05,**P<0.01compared with control;△P<0.05,△△P<0.01 compared with day 4.4天開始少量表達cTnI,隨著培養時間的延長,陽性率逐漸增加(圖4)。
2.5 Western blot檢測α-actin的表達
感染前大鼠MSCs不表達α-actin。感染4 d時α-actin蛋白呈弱表達,到第6天表達明顯增強,并持續高表達至第15天(圖5)。
2.6 Notch信號分子表達變化
大鼠MSCs原代細胞高水平表達Notch1、Jagged1、Hey1和Hey2,中等表達Dll1、Dll3、Dll4、Notch2、Notch3和Notch4,下游靶基因Hes1和Hes5在肌分化過程中等量持續表達。miR-1重組慢病毒感染MSCs后,Jagged1、Notch1、Notch3和Hey2表達水平隨著觀察時間的延長而逐漸下調,其中配體Jagged1的含量下調最顯著 (表4)。而配體Dll1、Dll3和Dll4,受體Notch2和Notch4及靶基因Hes-1、Hes-5和Hey-1表達水平雖有波動,但無顯著性差異(表5)。
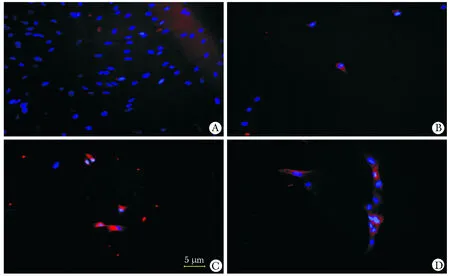
A.control group; B.4-day group; C.6-day group; D.15-day group圖4 MSCsmiR-1中cTnI的表達Fig 4 Expression of cardiomyocyte-specific cTnI in MSCsmiR-1(×100)

*P<0.01 compared with control圖5 MSCsmiR-1中α-actin表達變化Fig 5 Expression of cardiomyocyte-specific α-actin in MSCsmiR-1
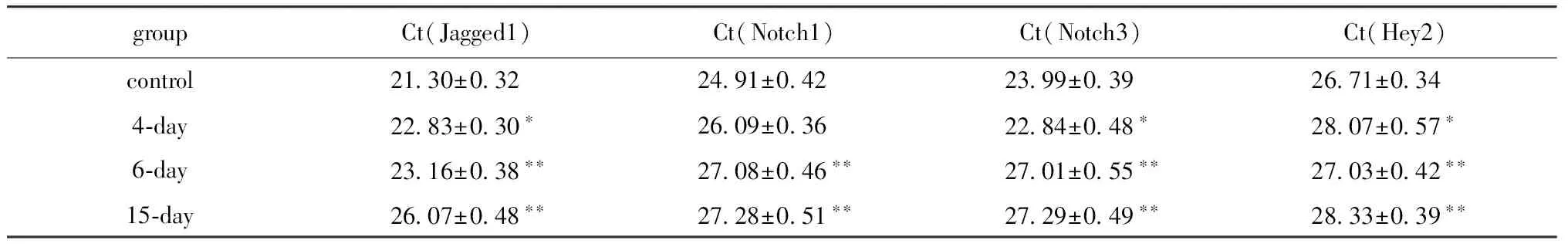
groupCt(Jagged1)Ct(Notch1)Ct(Notch3)Ct(Hey2)control 2130±032 2491±042 2399±039 2671±0344?day 2283±030? 2609±036 2284±048? 2807±057?6?day 2316±038?? 2708±046?? 2701±055?? 2703±042??15?day 2607±048?? 2728±051?? 2729±049?? 2833±039??
*P<0.05,**P<0.01 compared with control.
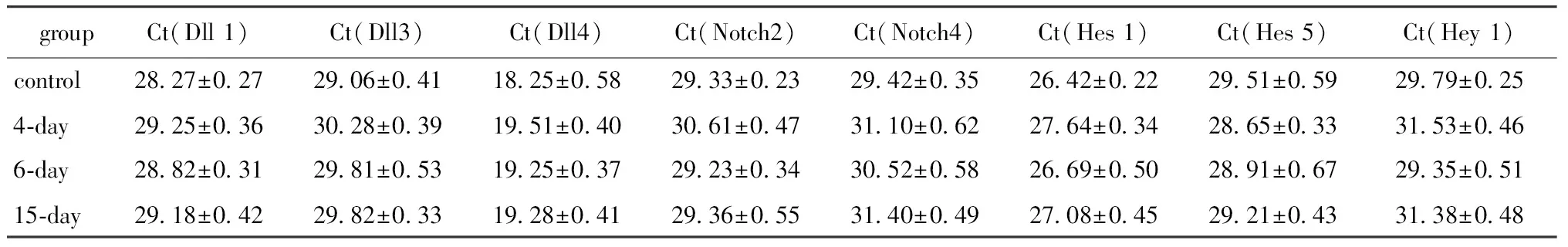
表5 Notch信號分子的表達變化Table 5 Expression of genes related to Notch signaling pathway
3 討論
miR-1作為首個確定的肌相關miRNAs,其調控機體心臟發育過程及心肌細胞分化的作用在一系列相關研究得到證實。敲除miR-1的小鼠心臟祖細胞的增殖明顯,而分化成的心肌細胞明顯減少[6]。在C2C12肌細胞中過表達miR-1使得早期和晚期心肌相關基因表達增多,明顯促進肌生成[7]。本研究結果同樣證實miR-1可促使大鼠MSCs向心肌細胞分化,并進一步驗證了本實驗的前期研究[8],表明miR-1具有決定干細胞向心肌細胞定向分化的作用。
在脊椎動物的心臟發育的不同階段伴隨著Notch信號通路不同組分的時空表達變化,表明Notch信號通路在心臟發育的多個過程中發揮重要的調控作用[9]。本研究中,miR-1重組慢病毒載體感染MSCs后,伴隨其向心肌樣細胞定向分化過程,Notch信號分子Jagged1、Notch1、Notch3及Hey2表達水平隨時間逐漸下調,推測Jagged1-Notch1/Notch3-Hey2介導的Notch信號下調可能參與了miR-1誘導大鼠MSCs的心肌分化過程,并在其中發揮著重要的調控作用。一項關于爪蟾的研究發現,通過Notch1激活內源性Notch信號通路可導致心肌分化標志物cTnI、MHC和α-actin的下調,致使心肌細胞分化成熟障礙,抑制Notch信號通路則相反[10]。因此,心臟分化發育過程中Notch1介導的Notch信號下調具有重要的調控作用。研究中發現Notch3的表達變化與Notch1相一致,推測肌分化過程中Notch3具有類似Notch1的同向作用。關于未成熟心肌細胞的體外分化研究發現,Jagged1通過激活Notch1在未成熟心肌細胞的分化中發揮著重要的調控作用[11]。另一項研究發現Jagged1可激活Notch3啟動Notch信號通路調控心肌細胞的分化[12]。盡管實驗背景有所不同,但Jagged1激活Notch1/ Notch3介導心肌細胞分化得到證實。Hey2特異性敲除的小鼠出現室間隔缺損、瓣膜發育異常,進一步研究證實Hey2是Notch信號通路的重要效應因子[13]。此外,一項體內研究發現Jagged1和Notch1敲除的小鼠中出現的心肌發育異常與Hey2敲除出現的一致,再次印證了Hey2為Notch信號的下游效應因子[14]。由此可知,Jagged1-Notch1/Notch3-Hey2介導的Notch信號下調在miR-1誘導大鼠MSCs的心肌分化過程中發揮著重要的調控作用。需要指出的是,盡管配體Dll1、Dll3、Dll4,受體Notch2、Notch4及靶基因Hes1、Hes5、Hey1表達水平亦隨MSCsmiR-1分化過程而波動,但無顯著性差異。雖然上述基因均與心臟發育、胚胎發生有著密切的關系,但在miR-1介導MSCs向心肌細胞分化過程中是否發揮相應的調控作用證據不足,進一步的研究有助于闡明其相關作用。
綜上所述,本研究通過miR-1慢病毒載體感染大鼠MSCs,證實miR-1可促使MSCs向心肌細胞分化,在此過程中Jagged1-Notch1/Notch3-Hey2介導的Notch信號下調發揮著重要的調控作用。研究不僅為實現MSCs定向分化為心肌細胞找到了一條新途徑,同時對其分化機制也進行了初步有益的探討。相信隨著研究的深入,MSCs向心肌細胞分化的相關機制將逐步闡明,干細胞低分化效率的瓶頸也終將突破,進而實現干細胞治療技術的廣泛應用。
[1] Leonardo TR, Schultheisz HL, Loring JF,etal. The functions of microRNAs in pluripotency and reprogramming[J].Nat Cell Biol,2012,14:1114- 1121.
[2] Townley-Tilson WH, Callis TE, Wang D. MicroRNAs 1, 133, and 206: critical factors of skeletal and cardiac muscle development, function, and disease[J]. Int J Biochem Cell Biol,2010,42:1252- 1255.
[3] Sluijter JP, van Mil A, van Vliet P,etal. MicroRNA-1 and -499 regulate differentiation and proliferation in human-derived cardiomyocyte progenitor cells[J]. Arterioscler Thromb Vasc Biol, 2010, 30:859- 868.
[4] Zhao Y, Samal E, Srivastava D. Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J]. Nature, 2005, 436: 214- 220.
[5] Ricks DM, Kutner R, Zhang XY,etal. Optimized lentiviral transduction of mouse bone marrow-derived mesenchymal stem cells[J]. Stem Cells Dev, 2008, 17:441- 450.
[6] Zhao Y, Ransom JF, Li A,etal. Dysregulation of cardiogenesis, cardiac conduction, and cell cycle in mice lacking miRNA-1-2[J]. Cell, 2007,129:303- 317.
[7] Chen JF, Mandel EM, Thomson JM,etal. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J]. Nat Genet, 2006,38: 228- 233.
[8] 文通,魏云峰,王夢洪,等.microRNA-1誘導大鼠骨髓間充質干細胞向心肌樣細胞分化[J].基礎醫學與臨床,2011,31:41- 46.
[9] MacGrogan D, Nus M, Pompa JL. Notch signaling in cardiac development and disease [J]. Curr Top Dev Biol, 2010, 92: 333- 365.
[10] Rones MS, McLaughlin KA, Raffin M,etal. Serrate and Notch specify cell fates in the heart field by suppressing cardiomyogenesis [J]. Development, 2000, 127: 3865- 3876.
[11] Sassoli C, Pini A, Mazzanti B,etal. Mesenchymal stromal cells affect cardiomyocyte growth through juxtacrine Notch-1/Jagged-1 signaling and paracrine mechanisms: clues for cardiac regeneration [J]. J Mol Cell Cardiol, 2011, 51:399- 408.
[12] Li H, Yu B, Zhang Y,etal. Jagged1 protein enhances the diffe- rentiation of mesenchymal stem cells into cardiomyocytes [J]. Biochem Biophys Res Commun, 2006, 341:320- 325.
[13] Fischer A, Schumacher N, Maier M,etal. The Notch target genes Hey1 and Hey2 are required for embryonic vascular development [J]. Genes Dev, 2004, 18:901- 911.
[14] McBride KL, Riley MF, Zender GA,etal. Notch1 mutations in individuals with left ventricular outflow tract malformations reduce ligand-induced signaling [J]. Hum Mol Genet, 2008, 17: 2886- 2893.
Expression of Notch signaling moleculesin the process of microRNA-1 inducing rat bone marrowmesenchymal stem cells into cardiomyocyte-like cells
DENG Hai-yan1, ZENG Jun-yi2*, WEI Yun-feng1,2, WANG Meng-hong1,2, ZHENG Ze-qi1,2, ZHANG Wan2, WEN Tong1
(1.Dept of Cardiology;2.Jiangxi Institute of Hypertension,the First Affiliated Hospital of Nanchang University,Nanchang 330006,China)
ObjectiveTo investgate the effect of miR-1 on MSCs differentiation into cardiac phenotypes and the expression changes of Notch signaling molecules in this process.MethodsMSCs were isolated from rat bone marrow by the whole bone marrow adherence method; MSCs were introduced by the lentiviral vectors expressing miR-1(MSCsmiR-1),which were then divided into four groups: control group, 4-day culture group, 6-day culture group,15-day culture group;The cell morphology was examined by light microscopy, miR-1 and cardiomyocyte-specific genes including GATA- 4, cTnI and α-actin were examined by real-time qPCR, and the expression of cTnI and α-actin was detected by immunofluorescence and Western blot respectively;Meanwhile, MSCsmiR-1cells were detected for the expression of genes related to notch signaling pathway by qPCR.ResultsIsolated MSCs displayed a stable spindle-phenotype and showed characteristic swirling growth. More than 98% of the MSCs population expressed CD44 and CD29 for MSCs phenotype; Meanwhile, less than 1% cells were CD45 positive. MSCsmiR-1highly expressed miR-1 and showed a higher expression of cardiomyocyte-specific genes, including GATA-4, cTnI and α-actin, cTnI was detected by immunofluorescence in MSCsmiR-1after miR-1 transduction for 4 days, and gradually increased afterwards. Western blot further confirmed the expression of α-actin in MSCsmiR-1. The mRNA expression of Jagged1,Notch1,Notch3 and Hey2 reduced significantly in MSCsmiR-1during its differentiation into cardiomyocyte-like cells,and reached the minimum on day 15.ConclusionsTransduction of miR-1 into rat MSCs induce cell differentiation into cardiomyocyte-like cells,which is in company with down-regulation mRNA expression of Jagged1- Notch1/ Notch3-Hey2 in the Notch pathway.
miR-1; MSCs;cardiomyocyte-specific cells;notch
2013- 11- 18
2014- 03- 28
江西省自然科學基金(2010GZY0321);江西省科技支撐計劃(2010BSA11700);江西省教育廳青年科學基金(GJJ12153);江西省衛生廳科技計劃(20111021)
*通信作者(correspondingauthor):zjy1312@163.com
1001-6325(2014)09-1204-07
R 542.2
A

