碳酸鈣主含量測定的探討
王秉鈞,謝秋利,鄭秀玲,張寶娟
(唐山三友化工股份公司,河北 唐山 063305)
碳酸鈣是純堿公司的副產品。將濃海水二次精制時所產生的二次鹽泥經沉淀進行離心分離、干燥、風選、包裝等工序處理后,生產合格成品碳酸鈣粉末,并回收二次濾液。由碳酸鈣的生產工藝我們可以發現,在生產過程中,會在碳酸鈣產品中引入大量的雜質,如 Mg2+、Cl-、SO24-等。在用EDTA容量法對主含量測定過程中,標準規定的方法不能有效地去除這些雜質的影響,達不到分析準確度要求。為此,我們進行了大量的試驗,努力尋找影響測定主含量的因素,并針對相關情況采取必要的措施;為驗證以上結果準確性,我們又自制分析裝置,用氣體容量法——測定碳酸根的量來確定碳酸鈣主含量的方法進行試驗,收到很好的效果,確保了分析數據準確可靠。
1 標準規定方法介紹——EDTA容量法(GB/T19281)
1.1 測定原理
在含有Ca2+的溶液中,調節pH≥12,以鈣試劑為指示劑,用EDTA標準溶液進行滴定,溶液由紫紅色變為純藍色達到滴定終點。
1.2 測定步驟
稱取3.000g碳酸鈣樣品放入燒杯中,加少量蒸餾水潤濕,蓋上表面皿,用過量的1+1硝酸溶解,并加熱煮沸,用無CO2蒸餾水沖洗表面皿,轉移液體至500mL容量瓶中,定容至刻度,搖勻。準確移取10.00mL稀釋溶液,加入5mL 1+3的三乙醇胺,加入新鮮的C(NaOH)=2.0mol/L的溶液,調節pH≥12,加入適量鈣試劑,立即用C(EDTA)=0.02500mol/L標準溶液進行滴定,溶液由紫紅色變為純藍色達到滴定終點。
這里就上述操作步驟特別強調注意事項:
1)溶解樣品時必須加入1+1硝酸,并且加熱煮沸,直至樣品完全溶解。
2)配制NaOH所用蒸餾水必須要經過煮沸,必須保證NaOH的新鮮,超過5天要重新配制。
3)加入NaOH后必須立即滴定。
1.3 理論分析初步確定干擾因素
在用EDTA滴定中,被測金屬離子M與EDTA絡合,生成絡合物MY,此為主反應。反應物M與Y都可能同溶液中其他組分發生副反應,使MY絡合物的穩定性受到影響,反應式如下:

式中:L為輔助絡合劑;N為干擾離子。
如果反應物M和Y發生了副反應,不利于主反應的進行;如果反應產物MY發生了副反應,稱為混合絡合效應,則有利于主反應的進行。
在CaCO3主含量的測定中,我們主要通過測定Ca2+的含量來確定CaCO3含量。如果溶液中有CO2的存在,就會與Ca2+結合生成難溶的CaCO3含量,在EDTA滴定Ca2+的時候很難從CaCO3中奪取Ca2+進行絡合,從而使得CaCO3主含量偏低。因此在樣品溶解過程中,我們必須嚴格按照1.2中操作步驟中特別強調的注意事項進行操作,盡最大可能的減少CO2的影響。
操作步驟1.2顯示,我們通過控制pH值,已經消除了Y的酸效應及CaY的混合絡合效應;加NaOH溶液后立即滴定,消除了Ca與OH-生成微溶物Ca(OH)2的影響(這里我們做過實驗:在加入NaOH溶液調節pH≥12的試樣液中加入乙醇,溶液立即變渾,因為乙醇降低了Ca(OH)2的溶解度,由少量的Ca(OH)2生成大量的Ca(OH)2)。但是在對碳酸鈣的日常檢測中,我們發現碳酸鈣總量忽高忽低,因此懷疑產品中的SO24-可能對Ca2+的測定也有一定的影響,因為CaSO4屬于微溶物,在EDTA滴定Ca2+的時候,很難從CaSO4中奪取Ca2+進行絡合,使得CaCO3主含量偏低,從而造成總量偏低的現象。為此我們對標準方法加以改進——對SO24-進行部分掩蔽,以期能夠解決總量偏低的問題。
2 改進方法
2.1 方法介紹
移取10.00mL 1.2中制備的試樣溶液,加25 mL蒸餾水,加熱煮沸,趁熱緩慢加入一定量的0.1 mg/mL的BaCl2溶液,冷卻后加入5mL1+3的三乙醇胺,加入新鮮的C(NaOH)=2.0mol/L的溶液,調節pH≥12,加入適量鈣試劑,立即用C(EDTA)=0.02500mol/L的標準溶液進行滴定,溶液由紫紅色變為純藍色達到滴定終點。
2.2 試驗數據
1)SO24-含量較低時,加入不同體積的BaCl2得到的數據,如表1所示:(原分析結果SO24-=0.66%,CaCO3=96.08%)
2)SO24-含量較高時,加入不同體積的BaCl2得到的數據,如表2所示:(原分析結果SO24-=1.76%,CaCO3=94.52%)
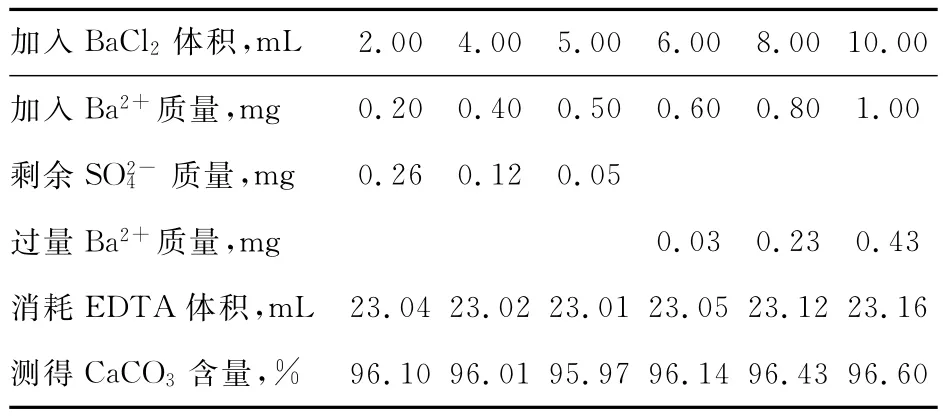
表1 SO24-含量較低時,測得CaCO3含量

表2 SO24-含量較高時,測得CaCO3含量
2.3 原因分析
由表1和表2我們可以發現,當SO24-含量較低時,加入BaCl2測得的主含量數據與不加入BaCl2時變化不大;而SO24-含量較高時,加入BaCl2測得的主含量數據與不加入時明顯提高。這是由于溶液中含有大量的Ca2+,當SO24-含量較高時,超過其溶度積Ksp(CaSO4)=2.45×10-5,就會形成溶解度較低的CaSO4,在EDTA滴定Ca2+的時候,很難從CaSO4中奪取Ca2+進行絡合,使得CaCO3主含量偏低,而加入BaCl2會形成溶解度更低的BaSO4,將SO24-部分掩蔽,使溶液中的Ca2+全部處于游離狀態,從而測得的主含量準確可靠。但是當BaCl2過量時,少量的Ba2+也會與EDTA絡合,從而影響結果的準確,因此BaCl2的加入量應控制使SO2-4 略有剩余,即使SO24-部分被掩蔽。
以CaCO3主含量為96%為例,通過計算我們可以得到生成CaSO4時所需SO24-的最低含量。
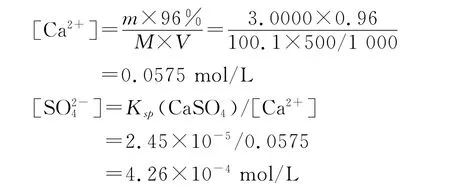
因此當SO24-的含量高于0.68%時,需要加入BaCl2溶液,來提高主含量測定準確度。
關于BaCl2溶液用量的計算:假設SO24-含量為1.05%,稱樣量m=3.0000g則10.00mL溶液中含有SO24-的質量為=0.63mg。
則與之完全沉淀的Ba2+質量為0.63×137.33/96.06=0.90mg。
考慮到BaCl2有劇毒,則加入等當量的70%~80%即可,則選擇加入8.00mL的0.1mg/mL的BaCl2即可。
以上數據均為多次測得的平均值。
為驗證此種方法的準確性,我們特進行了以下摸索。
3 關于碳酸根的試驗——氣體容量法
3.1 試驗原理
一定質量的碳酸鈣被酸溶解后會放出CO2氣體,利用氣體發生裝置測定CO2氣體,然后利用公式換算出CaCO3的含量。
計算公式:
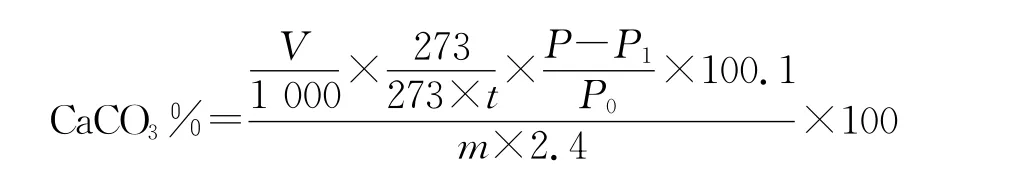
其中:V——產生CO2氣體,mL;
t——溫度,℃;
P——大氣壓,Pa;
P0——標準大氣壓,Pa;
P1——t溫度下的水蒸汽分壓,Pa。
3.2 氣體發生裝置

圖1 氣體發生裝置
3.3 測定步驟
稱取一定量的CaCO3樣品放入氣體發生瓶中,將量氣管液面提到一定高度,用膠塞塞緊氣體發生瓶,使基準瓶與量氣管內液面持平,記錄體積V1,通過滴定管向氣體發生瓶內緩緩滴加1+1HCl,有CO2氣體產生,直至反應完全,記錄消耗鹽酸體積V3,使基準瓶與量氣管內液面持平,記錄體積V2。同時記錄溫度t。
則產生氣體體積V=V1-V2-V3
3.4 注意事項
1)保證每次稱樣量一致,加酸量一致,減少讀數誤差。
2)測量期間要保證室內溫度、濕度恒定,保證壓強不變,減少系統誤差。
3)由于飽和蒸汽壓都是在理想狀態下測得,正常情況下很難達到此標準,因此每次都要用標準碳酸鈣測定水蒸汽分壓。
4)膠塞塞緊氣體發生瓶后,不能再按壓,保證反應期間壓強一致。
3.5 試驗數據(以30℃為例)

表3 由標準碳酸鈣確定水蒸汽分壓所得數據
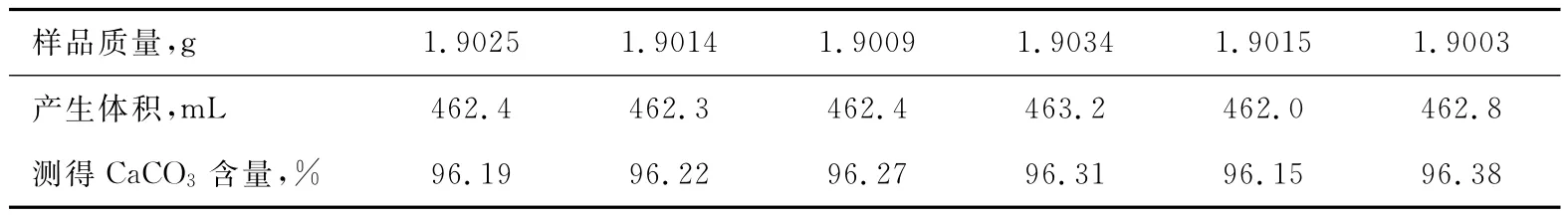
表4 測得樣品所得數據(分析所得SO24-=0.66%,CaCO3=96.08%)
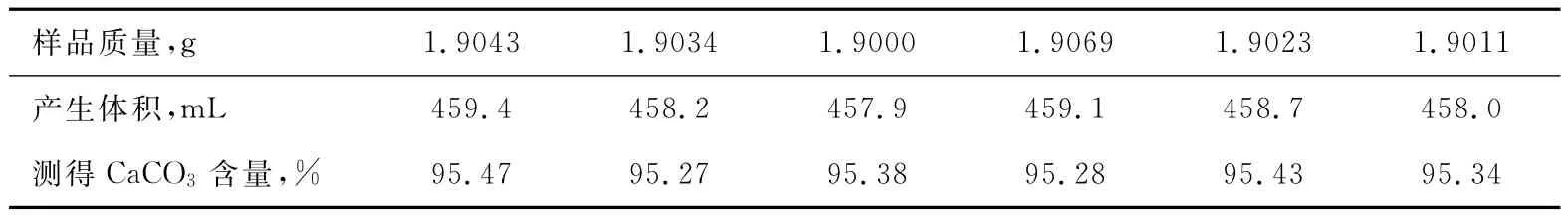
表5 測得樣品所得數據(分析所得SO24-=1.76%,CaCO3=95.22%)
3.6 原因分析
從以上數據不難看出,用氣體容量法測得Ca-CO3含量(以CaCO3計)與EDTA容量法測得的CaCO3含量很一致,驗證了我們用2中改進方法的可行性。但是由于氣體分析對環境的要求很高,所以樣品的平行性不是很好。
4 結 論
通過一系列的試驗,找到了影響測定碳酸鈣主含量的因素;通過加入BaCl2對SO24-進行部分掩蔽,使碳酸鈣主含量結果準確可靠,可以為以后的分析工作提供有力的參考。但是對于SO24-含量高的碳酸鈣樣品,用加入BaCl2掩蔽的方法,客戶不一定認可,因此應該針對不同客戶需求,來調整產品質量,以滿足客戶需求。
[1] 華東化工學院分析化學教研組.分析化學[M].北京:高等教育出版社,1978

