含吡啶配位聚合物結構對合成溫度的不敏感性*
王方闊
(皖西學院材料與化工學院,安徽六安237012)
近年來,配位聚合物由于其具有新穎的拓撲結構和廣闊的應用前景而引起人們較大的研究興趣[1-8]。迄今為止,設計、合成配位聚合物面臨的最主要問題仍然是如何通過控制反應條件來合成預期結構和功能的配位聚合物。這是因為配位聚合物的合成受多種因素的影響,如合成溫度、反應物濃度、配體的幾何構型、金屬離子的配位數、溶劑的極性和溶液的酸堿度等[4-7]。水熱合成法是制備配位聚合物的常用方法之一,但是水熱反應產物結構的合理控制還是無機合成化學領域的一個遠期研究目標。其中水熱合成溫度是影響產物結構的重要因素之一[5-7],當水熱合成溫度改變時,配位聚合物的網絡結構也將隨之發生規律性的變化,而在這些配位聚合物的合成中,一般都是采用常見的強堿如氫氧化鉀或氫氧化鈉等來調節反應混合物的pH值。為了進一步研究水熱合成溫度對配位聚合物結構的影響,我們嘗試用吡啶代替氫氧化鉀或氫氧化鈉調節反應混合物的pH值。然而,我們發現得到的配位聚合物結構并沒有隨著溫度的變化而變化,而在較大的合成溫度范圍內都不會發生改變。本實驗采用2,5-二甲基對苯二甲酸和間苯二甲酸(以下簡稱H2dmbdc和H2ip)和六水合硝酸鋅通過吡啶調節反應混合物的pH值在水熱條件下進行水熱反應,得到一個二維配位聚合物[Zn3(dmbdc)3(py)2]n,1 和 [Zn4(H2O)(ip)4(py)6]n,2,研究表明當有吡啶參與反應時,配位聚合物的結構對水熱合成溫度具有一定的不敏感性。
1 實驗部分
1.1 試劑和物理測試
本實驗所用試劑均為商品供應,未經純化直接使用。2,5-二甲基對苯二甲酸(H2dmbdc)、吡啶、硝酸鋅均為分析純試劑,實驗用水為二次去離子水。
X射線在Panalytical X-Pert pro衍射儀上使用Cu靶進行測試。
1.2 合成部分
[Zn3(dmbdc)3(py)2]n,1 的合成:稱取 97mg(0.5mmol)H2dmbdc置于 25mL錐形瓶中,加入12mL去離子水,緩慢滴加吡啶至pH=7并攪拌使之溶解,然后再加入149mg(0.5mmol)Zn(NO3)2·6H2O。最后將反應混合物轉入20mL的聚四氟乙烯內襯中。分別控制反應溫度為120℃和210℃,恒溫3天,均得到無色透明片狀晶體。
[Zn4(H2O)(ip)4(py)6]n,2 合成方法與[Zn3(dmbdc)3(py)2]n,1基本相同,除了將反應物97mg(0.5mmol)H2dmbdc(2,5-二甲基對苯二甲酸)換成83mg(0.5mmol)H2ip。
2 結果與討論
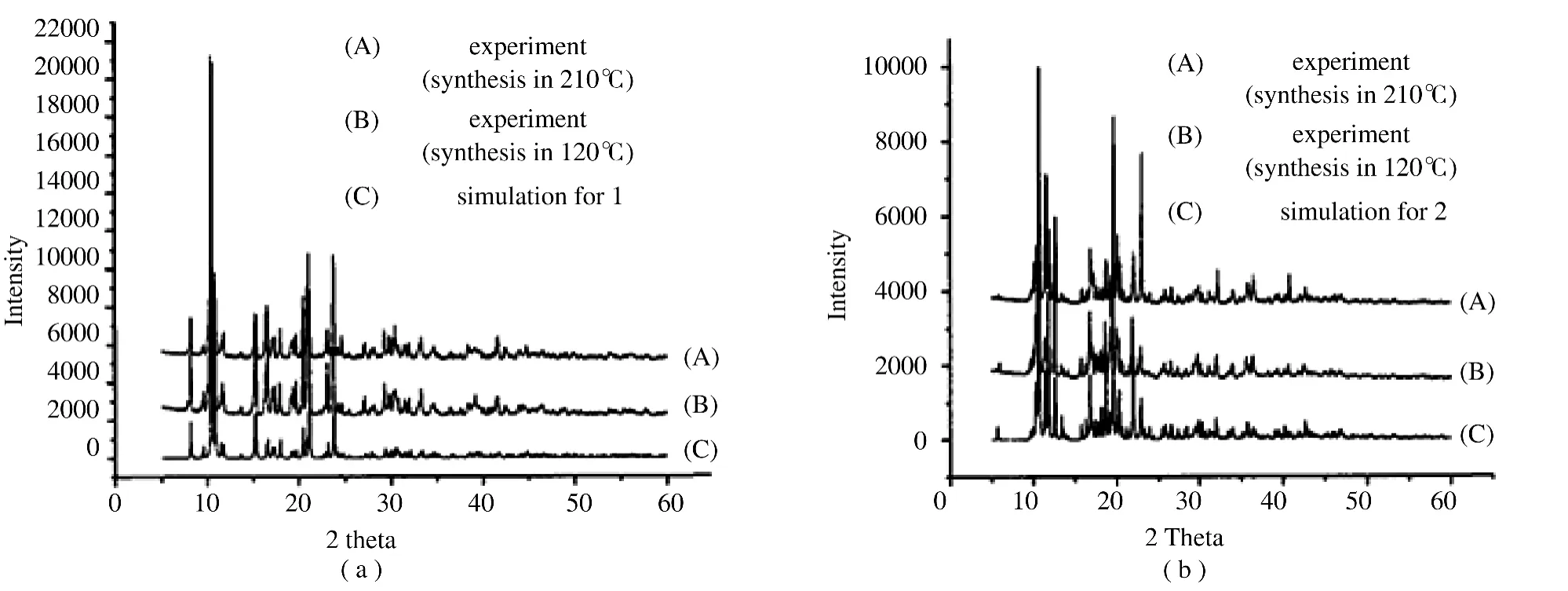
圖1 配位聚合物1和2的X-射線粉末衍射實驗和單晶模擬對比圖譜Figure 1 Experimental and simulated X-ray powder diffraction patterns a)for 1 and b)for 2
本實驗采用吡啶代替常用的強堿氫氧化鈉或氫氧化鉀調節反應混合物的pH值,以H2dmbdc和H2ip為配體與Zn(NO3)2·6H2O在水熱條件下合成得到配位聚合物[Zn3(dmbdc)3(py)2]n,1 和[Zn4(H2O)(ip)4(py)6]n,2[8,9]。
為了探究水熱合成溫度對配位聚合物結構的影響,逐漸升高水熱反應溫度,我們發現配位聚合物的結構沒有發生改變,結果在120℃ ~210℃范圍內產物結構均不會發生改變。在X-射線粉末衍射圖譜(圖1)中,圖中曲線A表示合成溫度為210℃時得到的產物的X-射線粉末衍射圖譜,曲線B表示合成溫度為120℃時得到的產物的X-射線粉末衍射圖譜,而曲線C則表示合成配位聚合物的單晶數據模擬的粉末衍射圖譜。圖1(a)和(b)兩圖中的三條曲線的峰位都基本一致,且曲線A和B的峰強度也基本相同,這更進一步證明當合成溫度從120℃升至210℃時,配位聚合物的結構不會發生改變。這可能是因為吡啶具有較強的配位能力,在水溶液中容易與鋅離子配位,從而使得鋅離子隨著溫度的升高不會發生水解等變化,因此其結構也不會發生改變。此外,在以前的研究中,我們采用H2dmbdc和鋅離子通過氫氧化鈉調節溶液的pH值,在150℃和170℃不同的水熱溫度下得到不同結構的配位聚合物[7]。由此可以證明,吡啶存在下,水熱反應產物的結構對水熱反應溫度具有不敏感性。
3 結論
采用 H2dmbdc、H2ip和 Zn(NO3)2·6H2O 在120℃ ~210℃范圍內不同的水熱溫度下,反應生成配位聚合物[Zn3(dmbdc)3(py)2]n,1和[Zn4(H2O)(ip)4(py)6]n,2。研究表明,在吡啶參與下,隨著溫度升高,配位聚合物的結構不會發生明顯變化。因此,吡啶參與下,水熱溫度對配位聚合物的結構具有不敏感性。
[1]Kupplera R J,Timmonsb D J,Fanga Q R,et al.Potential applications of metal-organic frameworks[J],Coord.Chem.Rev.,2009,253:3042 -3066.
[2]Burnett B J,Choe W,Sequential self-assembly in metal-organic frameworks[J],Dalton Trans.,2012,41:3889 -3894.
[3]Long L S,pH effect on the assembly of metal-organic Architectures[J],CrystEngComm,2010,12:1354-1365.
[4]Natali M,Aakeroy C,Desper J,The role of metal ions and counterions in the switching behavior of a carboxylic acid functionalized spiropyran [J],Dalton Trans.,2010,39:8269 -8277.
[5]He R,Song H H,Wei Z,Manganese(Ⅱ)and zinc(Ⅱ)compounds via amino acid derivatives:Effects of temperature and solvents[J],Inorg.Chim.Acta,2010,363:2631 -2636.
[6]Forster P M,Burbank A R,Livage C,The role of temperature in the synthesis of hybrid inorganicorganic materials:the example of cobalt succinates[J],Chem.Commun.,2004,368 -369.
[7]Wang F K,Song X X,Yang S Y,et al.Influence of hydrothermal synthesis temperature on the structures of two 3D coordination polymers[J],Inorg.Chem.Commun.,2007,10:1198 -1201.
[8]Wang F K,Yang S Y,Huang R B,et al.,Poly[tris(2,5-dimethylbenzene-1,4-dicarboxylato)bis(pyridine)trizinc(Ⅱ)][J],Acta Cryst.,2010,E66:m282.
[9]Zhou D S,Wang F K,Yang S Y,et al,Substituent effect on the assembly of coordination polymers containing isophthalic acid and its derivatives[J],CrystEngComm,2009,11:2548 -2554.

