大腸桿菌代謝工程生產芳香族化合物研究進展*
李飛飛,趙廣榮
(天津大學化工學院制藥工程系,天津,300072)
芳香族化合物廣泛應用于化工、飼料、食品和醫藥等領域,其主要的來源是石油和煤焦油工業,化學合成是工業上生產芳香類化合物普遍采用的方法。芳香族化合物也廣泛分布于自然界,是各種生物的初級和次級代謝產物,所以也有一部分芳香族產品是通過生物法獲得的。近年來,隨著環保要求的提高和化石能源的減少,利用生物法合成芳香族目標化合物成為研究的熱點,其中微生物發酵法是通過優良的微生物菌種在合適的條件下以葡萄糖、甘油等可再生原料發酵積累芳香族化合物。目前對于微生物中芳香族化合物的合成途徑和調控機理研究最多且闡述最為清楚的是大腸桿菌。
大腸桿菌體內芳香族化合物的合成主要通過莽草酸途徑(shikimate pathway)(圖1)和其下游芳香族氨基酸進一步衍生化實現。由于大腸桿菌自身積累芳香族化合物能力很低,只有代謝途徑優化改造才能更好的實現目標產物的發酵生產。近幾年通過大腸桿菌代謝工程方法生產芳香族化合物取得了顯著成效,極大地提高了目標化合物的合成積累能力,這為日后研究的進一步深入和工業化生產奠定了良好的基礎。
1 莽草酸途徑及莽草酸生物合成
如圖1所示,莽草酸途徑是所有芳香族化合物合成共有的,合成的起始物是赤蘚糖-4-磷酸(E4P)和磷酸烯醇式丙酮酸(PEP),在3-脫氧-D-阿拉伯庚酮糖-7-磷酸合成酶(DAHP合成酶)催化下生成DAHP,后其經過3步酶催化形成莽草酸(shikimate),途徑終產物為分支酸(chorismic acid,CHA),以分支酸為前體分別合成L-酪氨酸和L-苯丙氨酸,及L-色氨酸。3種芳香氨基酸可經不同酶催化得到多種的芳香族衍生物。莽草酸途徑是下游芳香族化合物合成的前提,其代謝通路是否暢通直接影響到下游目標化合物的產量。對于途徑的改造多集中于增加來自于糖酵解途徑(glycolytic pathway)PEP和磷酸戊糖途徑(pentose phosphate pathway)E4P前體的供應,DAHP合成同工酶基因突變以抗反饋抑制,途徑中負調控基因的敲除和競爭途徑的阻斷,以及途徑中的關鍵酶的過表達等[1]。
莽草酸是生產抗病毒藥物達菲重要的原料,目前主要從植物中提取獲得。Gosset等[2]通過在缺失磷酸轉移酶系統(Phosphotransferase system,PTS)和丙酮酸激酶(Pyruvate kinase,Pyk)的大腸桿菌體內過表達戊糖磷酸途徑和莽草酸途徑的6個基因,以葡萄糖為碳源培養基分批補料發酵30 h,莽草酸產量達到43 g/L。Escalante 等[3]利用缺失 PTS、aroK、aroL、pykF或pykA及 過表達aroG、tktA、aroB和aroE的大腸桿菌生產 SA,產量達7 g/L,產率達0.29 mol/mol。Zhou 等[4]利用過表達 tktA、glk、aroE 和 aroB 基因,并敲除aroK、aroL、ptsHIcrr和ydiB基因的大腸桿菌,10 L發酵罐發酵,SA積累產量達到1 850 mg/L。
2 L-酪氨酸衍生物大腸桿菌代謝工程合成
由莽草酸途徑終產物分支酸出發,經過分支酸變位酶(Chorimate mutase)TyrA和PheA催化,得到預苯酸(prephenic acid,PA),預苯酸在預苯酸脫氫酶(prephenate dehydrogenase)作用下得到4-羥基苯丙酮酸(4-hydroxyphenylpyruvate),4-羥基苯丙酮酸在 L-酪氨酸氨基轉移酶(Tyrosine aminotransferase)TyrB或AspC作用下通過與L-谷氨酸的轉氨作用生成L-酪氨酸。L-酪氨酸是人和動物新陳代謝、生長發育重要的、必需的氨基酸。通過代謝工程構建高產L-酪氨酸的工程大腸桿菌,微生物發酵法生產L-酪氨酸成為近幾年的熱點[1]。
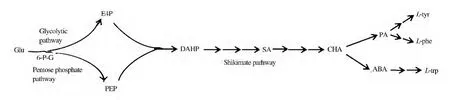
圖1 芳香氨基酸生物合成途徑Fig.1 Biosynthesis pathway of aromatic amino acid
L-酪氨酸作為很好的平臺化合物,以其為前體利用大腸桿菌發酵轉化可以得到多種廣泛用途的化學品,如圖2所示,其衍生物包括對羥基苯乳酸、對羥基苯乙酸、對羥基苯乙醇、L-多巴、丹參素、黑色素、咖啡酸、對羥基肉桂酸、對羥基苯乙烯,苯酚,對羥基苯甲酸等。

圖2 通過大腸桿菌代謝工程合成L-酪氨酸相關衍生物Fig.2 L-tyrosine derivatives synthesized by metabolic engineering of Escherichial coli
4-羥基苯乳酸(4-hydroxyphenyllactic acid,HPL)是合成新型糖尿病藥物和混雜多肽的關鍵中間體,4-羥基苯乙酸(4-hydroxyphenylacetic acid,HPA)可用于合成β-受體阻滯藥阿替洛爾和葛根黃豆甙元有效成分4,7-二羥基異黃酮的合成,4-羥基苯乙醇(4-hydroxyphenethylalcohol,HPAL)可用于合成心血管藥物美多心安。Sakai等[5]將來自 Cupriavidus necator的乳酸脫氫酶(Lactate dehydrogenase)基因整合到L-酪氨酸高產菌株染色體上表達,得到4-羥基苯乳酸;將來自Azospirillum brasilense的苯丙酮酸脫羧酶(Phenylpyruvate decarboxylase)基因ipdC和Escherichial coli的苯乙醛脫氫酶(Phenylacetaldehyde dehydrogenase)基因feaB整合到L-酪氨酸高產菌株染色體上表達,得到4-羥基苯乙酸;將ipdC和來自Lactobacillus brevis的乙醇脫氫酶(Alcohol dehydrogenase)基因整合到染色體上表達,得到產4-羥基苯乙醇。
多巴(L-3,4-dihydroxyphenylalanine ,L-DOPA)是一種治療帕金森癥的芳香族化合物。Gosset等[6]表達來自于Escherichial coli的抗反饋抑制DAHP合成酶、轉酮醇酶、分支酸變位酶和來自于 Zymomonas mobilis的環己二烯脫氫酶(Cyclohexadienyl dehydrogenase)得到高產L-酪氨酸菌株,進一步表達大腸桿菌4-羥基苯乙酸3-羥化酶(4-Hydroxyphenylacetate 3-hydroxylase,HpaBC)實現 L-酪氨酸向 L-多巴轉化,發酵50 h時L-多巴產量達到1.51 g/L。
丹參素(salvianic acid A,SAA)是一種酚酸類化合物,可用于胸憋悶、心絞痛治療等,其主要來源是藥用植物丹參中提取。YAO等[7]通過模塊化代謝工程雙啟動子過表達L-酪氨酸合成途徑中6個關鍵基因得到高產L-酪氨酸大腸桿菌,并在此基礎上引入D-乳酸脫氫酶(D-lactate dehydrogenase)和4-羥基苯乙酸3-羥化酶,實現丹參素的合成,產量達到7.1 g/L,轉化率達到 0.47 mol/mol。
黑色素(melanin)是動物皮膚或毛發中存在的一種黑褐色的色素,可以保護機體避免受紫外線的傷害,其合成主要通過酪氨酸酶(Tyrosinase)對L-酪氨酸的轉化實現,Gosset等[8]缺失PTS系統和tyrR基因,同時表達編碼來自Rhizobium etli的酪氨酸酶的melA基因,大腸桿菌以葡萄糖為碳源發酵120 h黑色素產量達到3.22 g/L。
咖啡酸(caffeate)具有收縮增固微血管、提高凝血因子、升高白細胞和血小板的作用,同時它還具有抗炎和抗腫瘤的作用,是醫藥的重要原料和中間體。Stephanolpoulos等[9]通過優化不同的途徑、基因拷貝數、培養基等條件,從L-酪氨酸合成咖啡酸,產量達106 mg/L。YAN Yajun 等[10]在高產 L-酪氨酸大腸桿菌中表達4-羥基苯乙酸3-羥化酶并優化接種時間,發酵咖啡酸產量達到766.68 mg/L。
4-羥基苯乙烯(4-hydrostyrene)可用作高性能聚合物材料光刻膠單體。Sariaslani等[11]利用1株表達來自Rhodotorula glutinis L-酪氨酸氨解酶(Tyrosine ammonia-lyase)和來自Lactobacillus plantarum對香豆酸脫氫酶(4-coumaric acid decarboxylase)大腸桿菌,實現L-酪氨酸經對香豆酸(4-coumalic acid,4CA)向4-羥基苯乙烯轉化,在14L發酵罐磷酸鹽限制型碳源培養基發酵,4-羥基苯乙烯產量達到0.4 g/L。
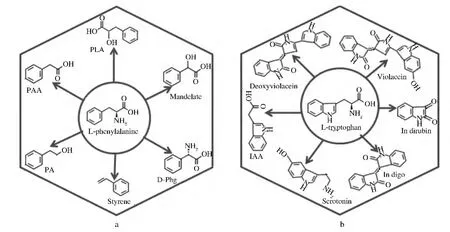
圖3 由大腸桿菌代謝工程合成的L-苯丙氨酸(a)和L-色氨酸(b)相關衍生物Fig.3 Derivatives of L-phe(a)and L-try(b)synthesized by metabolic engineering of Escherichial coli
苯酚(phenol)是重要的有機化工原料,在樹脂、合成纖維、合成橡膠、殺菌劑、防腐劑、染料以及醫藥等工業領域有著重要用途,醫療上也用于外科器械或皮膚的殺菌消毒。Lee等[12]在大腸桿菌中利用SRNA技術抑制負調控基因,過表達L-酪氨酸酚裂解酶(Tyrosine phenol-lyase),利用葡萄糖生產苯酚,菌株搖瓶發酵最高產量達到419 mg/L,補料分批發酵產量達1.69 g/L。苯酚由于其對微生物的毒性,限制了其發酵積累,通過兩相補料分批發酵21 h配合甘油三丁酸酯萃取苯酚產量和產率分別提高至3.79 g/L和 0.18 g/(L·h)。
對羥基苯甲酸(4-hydroxybenzoic acid,HBA)是重要的有機合成原料,還廣泛用于食品、化妝品、醫藥的防腐防霉和殺菌等方面。Frost等[13]過表達抗反饋抑制的DAHP合成酶和3-脫氫奎尼酸合成酶,再由ubiC編碼的分支酸裂解酶將分支酸轉化為對羥基苯甲酸,以葡萄糖為碳源最高產量達12 g/L,產率為0.13 mol/mol。
3 L-苯丙氨酸及其衍生物
3.1 大腸桿菌代謝工程合成L-苯丙氨酸
預苯酸經PheA催化得到苯丙酮酸,苯丙酮酸經過AspC、TyrB轉氨酶催化得到L-苯丙氨酸。L-苯丙氨酸是人體必需氨基酸之一,醫藥工業上可作為復配氨基酸輸液的重要成份,是苯丙氨芐、甲酸溶肉瘤素等氨基酸類抗癌藥物的中間體,也是生產腎上腺素、甲狀腺素的原料;在食品工業上用作合成甜味劑阿斯巴甜。此外,L-苯丙氨酸相關的芳香族衍生物的大腸桿菌代謝工程合成也取得了很多進展,如圖3a。
陳堅等[14]通過亞硝基胍誘變得到具有Thr326Pro突變的PheA,突變的大腸桿菌同時共表達aroF基因,在3 L發酵罐中產量達到35.38 g/L,比原始菌株高2.81倍,產率達到0.26 mol/mol,是原始菌株2倍。Packdibamrung等[15]大腸桿菌中表達來自于Thermotolerant bacillus lentus的L-苯丙氨酸脫氫酶(Phenylalanine dehydrogenase)、芳香氨基酸外轉運基因yddG和編碼甘油轉運輔因子基因glpF,甘油作為碳源5 L發酵罐發酵L-苯丙氨酸產量達到366 mg/L。
3.2 大腸桿菌代謝工程合成L-苯丙氨酸衍生物
扁桃酸(mandelate)是藥物合成重要的原料,可用于頭孢羥唑、血管擴張藥環扁桃酯、滴眼藥鹽酸羥芐唑、匹莫林等的合成。楊晟等[16]通過大腸桿菌對L-苯丙氨酸合成途徑基因改造實現以葡萄糖為碳源合成光學純的扁桃酸。通過引入Amycolatopsis orientalis的對羥基扁桃酸合成酶(Hydroxymandelate synthase)得到S-扁桃酸產量0.092 g/L的工程菌。敲除競爭途徑基因tyrA,24 h產量達到0.74 g/L。在S-扁桃酸生產菌株中共表達天藍色鏈霉菌對羥基扁桃酸氧化酶(Hydromandelate oxidase)和Rhodotorula graminis D-扁桃酸脫氫酶(D-mandelate dehydrogenase)),可生產 R-扁桃酸 0.68 g/L。
苯乙烯(styrene)是合成樹脂、離子交換樹脂及合成橡膠等高分子聚合物材料的重要單體。David等[17]在大腸桿菌中共表達從細菌,酵母,植物中篩選L-苯丙氨酸氨解酶(Phenylalanine ammonia-lyase)和反式肉桂酸脫羧酶同工酶,實現由內源L-苯丙氨酸向苯乙烯的轉化。最終選擇在L-苯丙氨酸高產大腸桿菌工程菌種過表達來自于Arabidopsis thaliana的L-苯丙氨酸氨解酶和來自于Saccharomyces cerevisiae的阿魏酸脫羧酶(Ferulate decarboxylase)搖瓶發酵產量達到260 mg/L,接近苯乙烯毒性極限。
D-苯甘氨酸(D-phenylglycine)是半合成青霉素類和頭孢菌素類抗生素重要的側鏈單元。Muller等[18]從L-苯丙氨酸前體苯丙酮酸起始,人工構建了一條新的D-Phg合成途徑,由分別來自Amycolatopsis orientalis,Streptomyces coelicolor和 Pseudomonas putida的3種酶對羥基扁桃酸合成酶(Hydroxymandelate synthase),對羥基扁桃酸氧化酶(Hydroxymandelate oxidase)和D-對羥基苯甘氨酸氨基轉移酶 (Hydroxyphenylglycine aminotransferase)組成,將苯丙酮酸經過扁桃酸,苯乙酮酸轉化為D-苯甘氨酸。
苯乳酸(phenyllactic acid,PLA)是可以抑制腐敗菌、致病菌,特別是對真菌的感染,有望成為一種新型的防腐劑應用于食品工業及藥物制劑;苯乙酸(phenylacetic acid,PAA)在醫藥工業中用于青霉素、地巴唑等藥物合成,還可用作生產廣譜有機磷殺蟲劑農藥,合成香料等;苯乙醇(phenethylalcohol,PA)可作為食用香料,也在化妝品、香皂中經常應用,還可作為眼藥水中的抗菌成分。Sakai等[5]利用跟高產L-酪氨酸菌株生產對羥基苯乳酸,對羥基苯乙酸,對羥基苯乙醇同樣的基因表達及生產策略,將基因整合到高產L-苯丙氨酸基因組上,可以得到苯乳酸,苯乙酸,苯乙醇生產菌株。
4 L-色氨酸及其衍生物
4.1 大腸桿菌代謝工程合成L-色氨酸
分支酸在氨基苯甲酸合成酶作用下與L-谷氨酰胺(L-glutamine)發生轉氨作用生成鄰氨基苯甲酸(2-aminobenzoic acid,ABA),后其經過多步酶促反應生成含五元雜環的芳香族化合物吲哚(indole),吲哚與絲氨酸(serine)在色氨酸合成酶催化下最終生成L-色氨酸。色氨酸是是人體必需的氨基酸之一,作為營養增補劑用于食品工業;用于煙酸缺乏癥治療藥及調節精神節律安神藥用于醫藥領域,另外L-色氨酸還大量應用于飼料工業。L-色氨酸生產菌株通常通過傳統的誘變育種篩選,但有益突變頻率低,變異的方向和性質難控制,因此通過代謝工程理性設計以提高其產量逐漸成為研究熱點,并拓展到與色氨酸代謝途徑相關的芳香族衍生物,如圖3b。
祁慶生等[19-21]在產 L-色氨酸工程大腸桿菌體內導入可以改變胞內代謝通路和氧化還原狀態的聚羥基丁酸酯(polyhydroxybutyrate)途徑,有效地增加了L-色氨酸產量,達到14.4 g/L。通過構建 L-色氨酸通透酶Mtr,TnaB,AroP突變菌株,抑制大腸桿菌對L-色氨酸的吸收轉運,增加胞外發酵液中的L-色氨酸濃度至16.3 g/L。通過過表達tktA和突變的trpE和aroG基因及阻斷一系列競爭途徑得到原始產L-色氨酸菌株,后通過一步法弱化子失活和啟動子對換策略對代謝通路優化,其產量比原始產L-色氨酸菌株分別高1.67和9.29倍,48 h發酵罐發酵最高產量達到10.15 g/L。
陳堅等[22]通過定點突變消除AroF和鄰氨基苯甲酸合成酶(TrpED)的受到的反饋抑制,并在溫度誘導的表達型質粒pSV上表達兩突變基因。敲除trpR基因解除trp抑制子的轉錄調控,敲除pheA、tyrA和tnaA基因分別阻斷L-苯丙氨酸、L-酪氨酸途徑與L-色氨酸途徑的競爭及其降解,最終發酵L-色氨酸產量達到13.3 g/L。
陳寧等[23-25]通過修飾芳香氨基酸分泌基因yddG和芳香氨基酸透過酶AroP構成的L-色氨酸轉運系統,影響L-色氨酸的生產和細胞生長,使得L-色氨酸合成代謝流重新分配。最優化的工程菌株在30 L發酵罐中補料分批發酵L-色氨酸產量達36.3 g/L。通過敲除大腸桿菌pta和mtr基因,并過表達yddG基因,30 L發酵罐發酵 L-色氨酸最大產量可達48.68 g/L。通過過表達ppsA和tktA,增加胞內PEP和E4P供應,分批發酵40 h L-色氨酸產量達到35.9 g/L。
4.2 大腸桿菌代謝工程合成L-色氨酸衍生物
吲哚3-乙酸(indole-3-acetic acid,IAA),又稱生長素,對于植物的生長發育具有重要作用。Romasi等[26]在大腸桿菌中表達 aspC,ipdC和 iad1三個基因,分別編碼來自于Escherichia coli、Enterobacter cloacae和Ustilago maydis的氨基轉移酶、吲哚3-丙酮酸脫羧酶和吲哚-3-乙酸脫氫酶。tac啟動子控制表達ipdC和iad1及來自于Corynebacterium glutamicum的sod啟動子控制表達aspC,重組大腸桿菌在添加2 g/L L-色氨酸LB培養基發酵48 h,IAA產量約1.1 g/L,進一步敲除抑制L-色氨酸生成的tnaA基因,IAA產量增至1.8 g/L。當添加4 g/L L-色氨酸至LB培養基發酵24 h,IAA 產量達3.0 g/L。
靛紅(indirubin)和靛藍(indigo)是應用廣泛的還原染料,用于食品、醫藥和日用化妝品的著色。Han等[27]在大腸桿菌中表達來自于 Methylophaga aminisulfidivorans的黃素單加氧酶(Flavin-containing monooxygenase),并在5 L含2 g/L L-色氨酸的培養基中發酵,得到920 mg/L靛藍和5.0 mg/L靛紅。培養基中進一步添加0.36 g/L的半胱氨酸,半胱氨酸會影響黃素單加氧酶的區域選擇性,增加靛紅前體2-羥基吲哚的合成,利用優化培養基發酵靛紅產量達到223.6 mg/L。
紫色桿菌素(violacein)和脫氧紫色桿菌素(deoxyviolacein)具有很好的生物活性,可以作為潛在的抗腫瘤、抗病毒藥物及生物染料。Wittmann等[28]在大腸桿菌中表達來自于Chromobacterium violaceum的vioABCE基因簇,可以積累脫氧紫色桿菌素達180 mg/L,進一步通過胞內代謝分析找到絲氨酸、分支酸和色氨酸生物合成及磷酸戊糖途徑瓶頸,并進行系統改造,搖瓶發酵脫氧紫色桿菌素積累量增至320 mg/L。將來自于Janthinobacterium lividum的vioD基因整合到工程大腸桿菌基因組上,紫色桿菌素成為唯一的終產物,補料分批發酵其產量達710 mg/L。
血清素(serotonin)是一種植物源的生物堿,具有潛在的藥理作用。Sangkyu等[29]在含有GST(Glutathione S transferase)標簽蛋白的質粒pCOLADuet-1上融合表達色胺5-羥化酶(Tryptamine 5-hydroxylase),使其在大腸桿菌中具有活性,并同時共表達色氨酸脫羧酶(Tryptophan decarboxylase),在約20℃誘導表達融合蛋白可有最高的可溶性,此時血清素產量達24 mg/L。
5 展望
隨著化石資源的枯竭,化石能源基產品需要尋求新的可持續替代來源;天然產物提取因受到季節地域成本等影響,其發展也有很大的局限性。芳香族化合物作為在醫藥,食品,化妝品,化工等各領域具有重要作用的產品,其來源也需要我們重新思考。單純傳統微生物育種已經遇到生產能力無法提高的瓶頸,也不能滿足人們對發酵產品多樣性的需求。必須與現代工業生物技術相結合,以發揮微生物發酵的優勢。
代謝工程通過重新合理設計和優化微生物的代謝途徑來更好地實現目標產物的發酵生產,廣泛應用于微生物的改造取得了顯著成效。近年來,隨著各種組學的發展,對于全細胞尺度的基因組、轉錄組、蛋白質組和代謝組調控機理研究得越來越清晰,加之合成生物學理論的提出,從原件、模塊、系統不同層次設計特定功能合成的生命體成為未來的趨勢。在大腸桿菌等模式生物研究基礎之上,不斷優化并構建高產高效微生物細胞工廠,再結合工業微生物發酵和過程技術,最終實現產業化,促進經濟社會可持續發展。
[1]姚元鋒,趙廣榮.L-酪氨酸代謝工程研究進展[J].食品與發酵工業,2013,39(5):132-137.
[2]Rodriguez A,Martinez J A,Baez J L,et al.Constitutive expression of selected genes from the pentose phosphate and aromatic pathways increases the shikimic acid yield in high-glucose batch cultures of an Escherichia coli strain lacking PTS and pykF [J].Microbial Cell Factories,2013,12(9):86.
[3]Escalante A,Calderon R,Valdivia A,et al.Metabolic engineering for the production of shikimic acid in an evolved Escherichia coli strain lacking the phosphoenolpyruvate:carbohydrate phosphotransferase system [J].Microbial Cell Factories,2010,9(4):21.
[4]CHEN K,DOU J,TANG S R,et al.Deletion of the aroK gene is essential for high shikimic acid accumulation through the shikimate pathway in E.coli[J].Bioresource Technology,2012,119(9):141-147.
[5]Koma D,Yamanaka H,Moriyoshi K,et al.Production of aromatic compounds by metabolically engineered Escherichia coli with an expanded shikimate pathway[J].Applied and Environmental Microbiology,2012,78(17):6 203-6 216.
[6]Munoz A J,Hernandez C G,Deanda R,et al.Metabolic engineering of Escherichia coli for improving L-3,4-dihydroxyphenylalanine(L-DOPA)synthesis from glucose[J].Journal of Industrial Microbiology & Biotechnology,2011,38(11):1 845-1 852.
[7]YAO Y F,WANG C S,QIAO J,et al.Metabolic engineering of Escherichia coli for production of salvianic acid A via an artificial biosynthetic pathway[J].Metabolic Engineering,2013,19(5):79-87.
[8]Chavezbejar M I,Balderashernandez V E,Gutierrezalejandre A,et al.Metabolic engineering of Escherichia coli to optimize melanin synthesis from glucose[J].Microbial Cell Factories,2013,12(11):108.
[9]Zhang H R,Stephanapoulos G.Engineering E.coli for caffeic acid biosynthesis from renewable sugars[J].Applied Microbiology And Biotechnology,2013,97(8):3 333-3 341.
[10]HUANG Q,LIN Y H,YAN Y J.Caffeic acid production enhancement by engineering a phenylalanine over-producing Eescherichia coli strain[J].Biotechnology and Bioengineering,2013,110(12):3 188-3 196.
[11]Qi W W,Vannelli T,Breinig S,et al.Functional expression of prokaryotic and eukaryotic genes in Escherichia coli for conversion of glucose to p-hydroxystyrene[J].Metabolic Engineering,2007,9(3):268-276.
[12]Kim B,Park H,Na D,et al.Metabolic engineering of Escherichia coli for the production of phenol from glucose[J].Biotechnology Journal,2014,9(5):621-629.
[13]Barker J L,Frost J W.Microbial synthesis of p-hydroxybenzoic acid from glucose[J].Biotechnology and Bioengineering,2001,76(4):376-390.
[14]ZHOU H,LIAO X,WANG T,et al.Enhanced L-phenylalanine biosynthesis by co-expression of pheA(fbr)and aroF(wt)[J].Bioresource Technology,2010,101(11):4 151-4 156.
[15]Thongchuang M,Pongsawasdi P,Chisti Y,et al.Design of a recombinant Escherichia coli for producing L-phenylalanine from glycerol[J].World Journal of Microbiology& Biotechnology,2012,28(10):2 937-2 943.
[16]SUN Z,NING Y,LIU L,et al.Metabolic engineering of the L-phenylalanine pathway in Escherichia coli for the production of S-or R-mandelic acid[J].Microbial Cell Factories,2011,10(9):71.
[17]McKenna R,Nielsen D R.Styrene biosynthesis from glucose by engineered E.coli[J].Metabolic Engineering,2011,13(5):544-554.
[18]Muller U,Vanassema F,Gunsior M,et al.Metabolic engineering of the E-coli L-phenylalanine pathway for the production of D-phenylglycine(D-Phg)[J].Metabolic Engineering,2006,8(3):196-208.
[19]GU P,KANG J,YANG F,et al.The improved l-tryptophan production in recombinant Escherichia coli by expressing the polyhydroxybutyrate synthesis pathway [J].Applied Microbiology and Biotechnology,2013,97(9):4 121-4 127.
[20]GU P,YANG F,KANG J,et al.One-step of tryptophan attenuator inactivation and promoter swapping to improve the production of L-tryptophan in Escherichia coli[J].Microbial Cell Factories,2012,11(3):30.
[21]GU P,YANG F,LI F,et al.Knocking out analysis of tryptophan permeases in Escherichia coli for improving L-tryptophan production[J].Applied Microbiology and Biotechnology,2013,97(15):6 677-6 683.
[22]ZHAO Z J,ZOU C,ZHU Y X,et al.Development of L-tryptophan production strains by defined genetic modification in Escherichia coli[J].Journal of Industrial Microbiology& Biotechnology,2011,38(12):1 921-1 929.
[23]LIU Q,CHENG Y S,XIE X X,et al.Modification of tryptophan transport system and its impact on production of L-tryptophan in Escherichia coli[J].Bioresource Technology,2012,114(12):549-554.
[24]SHEN T,LIU Q,XIE X,et al.Improved production of tryptophan in genetically engineered Escherichia coli with Tkta and Ppsa overexpression[J].Journal of Biomedicine and Biotechnology,doi:10.1155/2012/605219.
[25]WANG J,CHENG L K,WANG J,et al.Genetic engineering of Escherichia coli to enhance production of l-tryptophan [J].Applied Microbiology and Biotechnology,2013,97(17):7 587-7 596.
[26]Romasi E F,Lee J.Development of indole-3-acetic acidproducing Escherichia coli by functional expression of IpdC,AspC,and Iad1[J].Journal of Microbiology and Biotechnology,2013,23(12):1 726-1 736.
[27]Han G H,Gim G H,Kim W,et al.Enhanced indirubin production in recombinant Escherichia coli harboring a flavin-containing monooxygenase gene by cysteine supplementation [J].Journal of Biotechnology,2012,164(2):179-187.
[28]Rodrigues A L,Trachtmann N,Becker J,et al.Systems metabolic engineering of Escherichia coli for production of the antitumor drugs violacein and deoxyviolacein [J].Metabolic Engineering,2013,20(6):29-41.
[29]Park S,Kang K,Lee S W,et al.Production of serotonin bydualexpression oftryptophan decarboxylaseand tryptamine 5-hydroxylase in Escherichia coli[J].Applied Microbiology and Biotechnology,2011,89(5):1 387-1 394.

