兩臺血細胞分析儀結果的可比性分析
何偉業,吳培潔,陳少艷(廣州中醫藥大學第一附屬醫院,廣州 510405)
不同品牌血細胞分析儀有可能因具有不同的檢測原理和方法,導致對同一標本的檢測結果存在一定的差異,即使同一品牌、相同型號的血細胞分析儀也有可能存在上述現象,有可能對臨床診斷、病情評估和結果解釋等方面帶來一定的困難和誤解。因此,關注檢驗結果的溯源性,提高血細胞分析系統的可比性,對確保血液檢驗報告的準確性,提高醫學實驗室工作質量,具有重要的意義,也是ISO15189實驗室認可需要實現的質量目標之一[1-4]。為了解本同為希森美康公司產品的XE-5000和XS-800i血細胞分析儀檢測結果的準確性和一致性,本研究對兩臺儀器進行了比對試驗。
1 材料與方法
1.1 儀器與試劑希森美康XE-5000血細胞分析儀(簡稱XE-5000)、希森美康XS-800i血細胞分析儀(簡稱XS-800i)及二者配套試劑、質控品和校準品。以XE-5000作為對比儀器,XS-800i作為試驗儀器。
1.2 標本采集自臨床患者的乙二胺四乙酸二鉀抗凝新鮮靜脈血標本120份(含高、中、低值),所有標本檢測均無有核紅細胞、巨大血小板、血小板聚集等報警提示。
1.3 方法
1.3.1 質量控制 嚴格按儀器說明書的要求,每日采用配套全血質控品進行檢測。整個研究周期中,各次質控品檢測結果均在控制范圍內。
1.3.2 比對試驗 按美國臨床和實驗室標準化協會EP9-A2文件的要求,每日隨機選取覆蓋高、中、低值的標本10份,同時
用兩臺儀器進行白細胞(WBC)、紅細胞(RBC)、血紅蛋白(Hb)、血小板(PLT)和紅細胞比容(HCT)檢測。每份標本在同一儀器上測定2次,檢測順序為1~10、10~1,計算平均值。所有檢測均在標本采集后2h內、(25±2)℃環境下完成,連續檢測12d。
1.4 統計學處理采用SPSS13.0軟件計算各儀器檢測結果的相關系數和回歸方程,采用Microsoft Excel2003軟件繪制散點圖和計算差異百分率。
1.5 判斷標準和處理原則相關性判斷標準為:WBC、RBC、Hb和HCT的相關系數不低于0.98,PLT相關系數不低于0.95;差異百分率[差異百分率=(測定值-靶值)÷靶值×100%]以美國臨床實驗室修正法規規定的室間質量評價允許誤差的1/2(1/2CLIA′88)作為臨床可接受性能的評價標準,WBC、RBC、Hb、HCT、PLT的變異范圍確定控制限分別設為±7.5%、±3.0%、±3.5%、±3.0%、±12.5%[5]。若兩臺儀器檢測結果相關系數低于上述標準,或差異百分率超出控制限,則對儀器進行校準和維護保養。
2 結 果
XE-5000和XS-800i測定WBC、RBC、Hb、PLT和HCT的均數 分 別 相 差0.35×109/L、0.03×1012/L、1.24g/L、4.65×109/L、0.01,標準差分別相差0.08、0.08、0.26、0.90、0.01。WBC、RBC、Hb、PLT和HCT檢測結果呈正相關,相關系數分別為1.000、1.000、1.000、0.987、0.997,檢測結果差異百分率均在控制限內,見表1。
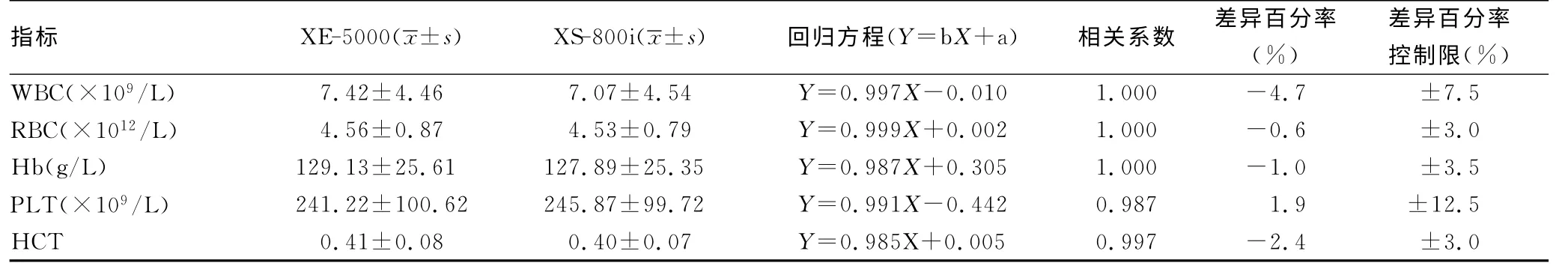
表1 XE-5000與XS-800i比對試驗結果
3 討 論
本研究顯示,XE-5000和XS-800i測定WBC、RBC、Hb和HCT的結果具有較高的相關性和一致性;采用1/2CLIA′88標準判斷你,兩臺儀器檢測結果的差異百分率均在控制限內,預期偏倚可接受。
目前,全自動血細胞分析儀已在臨床廣泛應用,實驗室同時使用數臺分析儀的情況極為常見,如何保證不同儀器相同指標檢測結果具有較高的一致性至關重要。因此,應定期對不同儀器進行比對分析,以保證不同儀器檢測結果間的差異控制在臨床可接受范圍內[6]。ISO15189認可文件指出“當同樣的檢驗應用不同程序或設備,或在不同地點進行,或以上各項均不同時,應有確切機制以驗證在整個臨床適用區間內檢驗結果的可比性”[7]。這就要求不同儀器檢測結果的準確性和一致性能夠達到統一。每天進行質控品檢測僅是了解單臺儀器檢測性能的有效措施,而不同儀器配套的質控品一般不能通用。因此,質控品檢測無法反映不同儀器檢測結果間的一致性。室間質量評價也是對某一型號儀器的檢測結果進行比較,無法對不同型號儀器檢測結果進行評價。通常情況下,實驗室僅選擇1臺分析儀參加室間質量評價。因此,僅單純通過室內質控和室間質評難以保證實驗室內不同分析儀檢測結果均具有較高的準確性和一致性。定期對不同分析儀進行比對分析,是保證其檢測結果準確性的重要手段。采用新鮮全血標本定期對不同血細胞分析儀進行可比性研究,有助于發現系統偏差[8]。綜合采用比對分析(相關性分析、差異百分率評價)、室內質控分析,更能有效保證檢測結果的可靠性。
[1]Clinical and Laboratory Standards Institute.Method comparison and bias estimation using patient samples;Approved guideline-second edition,EP9-A2[S].Wayne,PA,USA:CLSI,2002.
[2]叢玉隆,鄧新立.實驗室ISO15189認可對學科建設的幾點啟示[J].中華檢驗醫學雜志,2007,30(2):128-131.
[3]胡綠蔭,楊冀,吳文娟.兩種血細胞分析系統檢測結果的可比性 研 究[J].現 代 檢 驗 醫 學 雜 志,2011,26(5):115-118.
[4]曾素根,韓秀華,莊利芳,等.從CAP實驗室認證看血液細胞分析儀性能監管體系[J].現代檢驗醫學雜志,2009,24(2):152-154.
[5]張秀明,莊俊華,徐寧,等.不同檢測系統血清酶測定結果的偏倚與可比性研究[J].中華檢驗醫學雜志,2006,29(4):346-349.
[6]刁文連,阮春霞,張志峰,等.不同血細胞分析儀檢測結果間的比對分析[J].檢驗醫學與臨床,2013,10(8):1037-1038.
[7]Burnett D.ISO 15189:2003-Quality management,evaluation and continual improvement[J].Clin Chem Lab Med,2006,44(6):733-739.
[8]彭文紅,蘭曉梅,王海,等.不同血細胞分析儀多水平比對試驗方案的建立和應用[J].軍醫進修學院學報,2010,31(12):1224-1226.

