2,6-二叔丁基-4-氨基苯酚的合成工藝研究
柯中爐,蔣軍榮,徐峰,陳紅云
(臺州職業技術學院 生化制藥研發中心,浙江 臺州 318000)
受阻酚類抗氧劑因其低毒性、無著色、無污染、相容性好等優點,在高分子材料(尤其塑料制品)加工中得到廣泛應用[1-2]。本文以2,6-二叔丁基苯酚(DTBP)為原料合成的2,6-二叔丁基-4-氨基苯酚(DTBAP),兼具受阻酚類抗氧劑和芳胺類抗氧劑的結構特點,具有良好的抗氧化性能[3],同時可作為關鍵中間體衍生化合成系列抗氧劑產品,比如抗氧劑565[4]。綜合國內外文獻,DTBAP 合成方法有以下幾種:①2,6-二叔丁基-4-甲基苯酚(BHT)為原料,先通過催化氧化成苯醌,再與羥胺反應生成2,6-二叔丁基-4-亞硝基苯酚,然后通過還原反應得到DTBAP。Kjaer 等[5-6]用Cr2O3氧化BHT 為2,6-二叔丁基-1,4-苯醌。Yamada 等[7-8]以新型的鈷催化劑催化下氧氣氧化BHT。該方法存在主要問題有:一是氧化反應條件苛刻需要高溫高壓,二是反應選擇性不高,三是催化劑穩定性和重復使用性有待提高。②以DTBP 為原料,先通過硝化反應合成2,6-二叔丁基-4-硝基苯酚,然后通過催化加氫還原合成DTBAP。劉德龍[4]以發煙硝酸為硝化劑合成2,6-二叔丁基-4-硝基苯酚,再分別用Rany Ni 與Pd-C 催化加氫還原得到產品。該方法存在主要問題有,一是硝化反應不僅設備腐蝕性強,也會產生廢酸污染環境,二是還原反應需要用到昂貴的催化劑,生成成本較高。③以DTBP 為原料,在堿性條件下與苯胺重氮鹽偶合,再酸化得到對羥基偶氮苯,然后用Pd-C 催化在甲醇中氫解得到產品。該方法在對乙酰氨基酚合成中有研究,但因產率低沒有進一步應用[9]。④以DTBP 為原料,先通過亞硝化反應合成2,6-二叔丁基-4-亞硝基苯酚再通過還原反應制得產品。Wolfgang 等[10]以亞硝酸鈉為亞硝化試劑合成2,6-二叔丁基-4-亞硝基苯酚,再用Pd-C 催化加氫還原得到產品,該方法也是用到昂貴的金屬催化劑,生產成本較高。Dexter 等[11]以氯化氫的乙醇溶液作為酸化試劑進行亞硝化反應,由于氯化氫乙醇溶液價格較貴,致使生成成本偏高。
本文以95%乙醇為溶劑,濃鹽酸為酸化試劑、亞硝酸鈉為亞硝化試劑進行亞硝化反應合成2,6-二叔丁基-4-亞硝基苯酚,再用含硫化合物作為還原試劑,水作為溶劑進行還原反應制備產品。本制備方法簡單,反應條件溫和、易于控制,產物易于分離,產品總收率較高,反應原料廉價、容易采購,生產成本較低,適合于工業化生產。
1 實驗部分
1.1 試劑與儀器
石油醚(60 ~90 ℃)、95%乙醇、甲醇、濃鹽酸、氫氧化鈉、乙酸乙酯、2,6-二叔丁基苯酚(DTBP)、亞硝酸鈉、連二亞硫酸鈉(保險粉)、亞硫酸鈉、硫代硫酸鈉均為分析純。
AVANCE Ⅲ型核磁共振波譜儀(500 MHz);LC-20A 高效液相色譜(配紫外檢測器);FT-IR200 傅里葉紅外光譜分析儀;1260RRLC/500-MS 離子阱液質聯用儀;WRS-2A 數字熔點儀;DZF-6050 型恒溫真空干燥箱;2XZ-2 旋片式真空泵;DF101S 集熱式恒溫加熱磁力攪拌器;DFY-5/40 低溫恒溫反應浴;ZF-20D 暗箱式紫外分析儀;RE-2000B 旋轉蒸發器。
1.2 實驗方法
1.2. 1 合成2,6-二叔丁基-4-亞硝基苯酚將51.58 g(0.25 mol)DTBP 溶入150 mL 95%乙醇中,在冰水浴下冷卻,再慢慢加入50 mL 濃鹽酸,溫度控制在5 ℃以下。將25 g 亞硝酸鈉溶解于30 mL 水中,用恒壓滴液漏斗慢慢向反應瓶內滴加,約1 ~1.5 h滴加完畢。在15 ℃下繼續反應2 h。冷卻至0 ℃以下,攪拌0.5 h。趁冷過濾,濾餅先用120 mL,分3 次打漿洗滌。再用60 ~90 ℃石油醚打成漿狀洗滌3 次,然后放入真空干燥箱干燥。得到亮黃色粉末50. 35 g,收率為90. 94%。熔點為218. 5 ~219.5 ℃。
1.2. 2 合成2,6-二叔丁基-4-氨基苯酚先將23.53 g(0. 10 mol)2,6-二叔丁基-4-亞硝基苯酚、5 mol/L氫氧化鈉加入反應瓶,開啟攪拌,加入250 mL水,溶液呈棕紅色,室溫下開始慢慢滴加保險粉水溶液(65 g 溶解在250 mL 水中),約0.5 ~1 h滴加完畢,期間溫度升至50 ℃左右(注意溫度不能超過60 ℃,否則生成的產物因氧化而生成了紅色的副產物),反應液由棕紅色慢慢變成了棕黃色,并有固體產生。繼續反應1 h 左右,反應生成的固體逐漸變成了雪白色。用冰水浴冷卻至10 ℃以下,過濾。濾餅用冰水洗滌3 次,再用少量石油醚洗滌3次。將濾餅放在濾紙上,并將濾紙置于裝有氯化鈣的培養皿上,立即放入真空干燥箱室溫下烘干。得到20. 76 g 白色固體,收率約為92. 35%,純度為99% 以上,熔點為106. 5 ~107. 5 ℃。[IR ν(cm-1)]:υOH3 579,δOH1 382,υC—O1 235 (—OH);υNH23 230、3 187,υC—N1 109 (—NH2);υC—H3 082、3 015,υCC1 610、1 483、1 460 (苯環骨架);υC—H2 969、2 872,δC—C398、1 235。1H NMR (CDCl3,400 MHz),δ × 10-6:1. 367 (18H,s,CH3),8. 036(1H,s,OH),6.358 (2H,s,m-Ph—H)],4.379(2H,s,NH2)。
2 結果與討論
2.1 影響合成2,6-二叔丁基-4-亞硝基苯酚的因素
合成2,6-二叔丁基-4-亞硝基苯酚的是典型的亞硝化反應,反應機理與硝化反應類似,也是雙分子親電取代反應。不過由于NO+親電活性不如
NO2
+,所以只能與被強共軛給電子基(如羥基、氨基等)活化芳烴發生反應。由于HNO2很不穩定,所以一般以亞硝酸鹽(如亞硝酸鈉)作為亞硝化試劑。反應時,先將反應物溶解于酸(如乙酸、鹽酸、稀硫酸等)中,再將亞硝酸鹽的水溶液向反應瓶內滴加,生成的HNO2能馬上與底物反應。因乙酸是弱酸不易與NaNO2生成NO+,所以反應活性較低,致使產率也偏低;而鹽酸和稀硫酸作用差不多,故本反應采用濃鹽酸作為試劑。滴加亞硝酸鈉溶液不宜過快,否則生成HNO2來不及反應會分解掉,本反應控制在1 ~1.5 h 加完為宜;反應溶劑考察了95%乙醇、甲醇、異丙醇、乙酸乙酯,因異丙醇和乙酸乙酯對產品有一定溶解度,所以產率僅有80%左右,用95%乙醇和甲醇作溶劑產率差別不大,但從成本上考慮,采用95%乙醇作為溶劑。其它影響亞硝化反應主要因素為亞硝酸鈉的用量、反應時間、反應溫度。
2.1.1 亞硝酸鈉用量的影響 DTBP 為10. 32 g(50 mmol),95%乙醇30 mL,濃鹽酸12 g,反應溫度15 ℃,反應時間2 h,考察了亞硝酸鈉的用量對收率的影響,結果見表1。

表1 亞硝酸鈉的用量對收率的影響Table 1 Effect of the amount of sodium nitrite on the yield
由表1 可知,當亞硝酸鈉的用量達到1.25 倍以上時,產品收率已達到了90%以上,繼續增加亞硝酸鈉的用量,對反應基本已沒有影響。因此,亞硝酸鈉的用量以1.25 ~1.50 倍為宜。
2. 1. 2 反應溫度的影響 DTBP 10. 32 g(50 mmol),亞硝酸鈉4. 5 g(65 mmol),95% 乙醇30 mL,濃鹽酸12 g,反應時間2 h,考察了反應溫度對收率的影響,結果見表2。
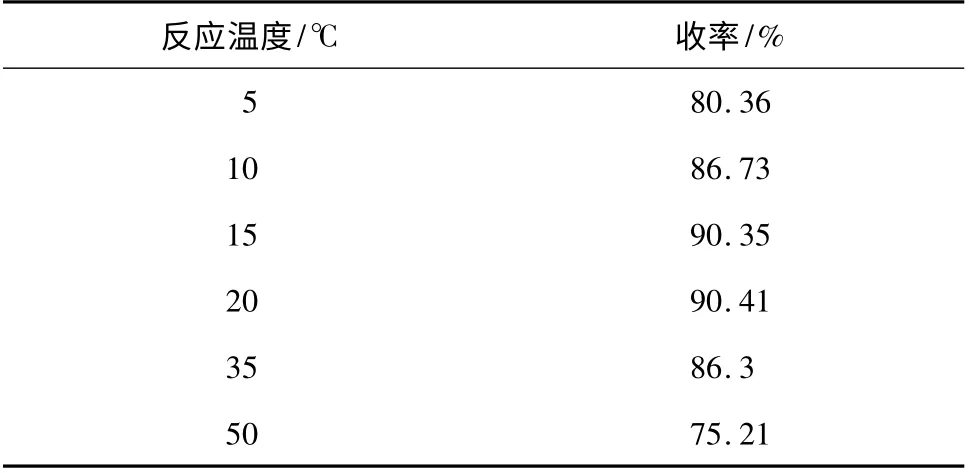
表2 反應溫度對收率的影響Table 2 Effect of reaction temperature on the yield
由表2 可知,反應溫度低于15 ℃,反應速度慢,產品收率偏低。當反應溫度達到15 ℃,產品收率達到了90%以上。但當反應溫度為35 ℃時,產品收率反而降低了,尤其當反應溫度進一步升高,產品收率下降越快。從實驗現象上發現,反應溫度低于20 ℃得到產品顏色呈亮黃色,隨著反應溫度升高,產品顏色逐漸變成棕黃色。而且產品在室溫(30 ℃及以上)放置也會變成棕黃色,純度下降。究其原因可能是反應溫度高,生成亞硝酸部分沒有反應即被分解或氧化,部分產物也被氧化成副產物。因此,反應溫度15 ~20 ℃為宜。
2. 1. 3 反應時間的影響 DTBP 為10. 32 g(50 mmol),亞硝酸鈉4. 5 g(65 mmol),95% 乙醇30 mL,濃鹽酸12 g,反應溫度15 ℃,考察了反應時間對收率的影響,結果見表3。

表3 反應時間對收率的影響Table 3 Effect of reaction time on the yield
由表3 可知,反應時間到達2 h 以上,產品收率已達到90%以上,繼續增加反應時間,反應收率已變化不大。因此,反應時間2.0 ~2.5 h 為宜。
綜上所述,DTBP 的亞硝化較為合適的反應條件為:以95%乙醇為溶劑,以鹽酸為酸化試劑,亞硝酸鈉用量為DTBP 摩爾量1.25 ~1.50 倍,反應溫度為15 ~20 ℃,反應時間2.0 ~2.5 h,產品收率達90%以上。
2.2 影響合成2,6-二叔丁基-4-氨基苯酚的因素
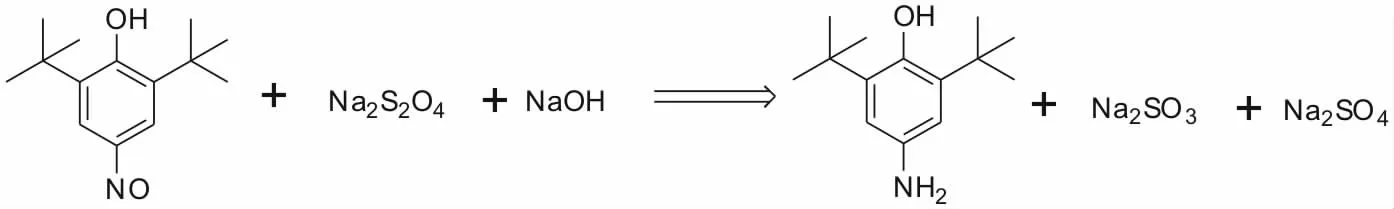
亞硝基還原成氨基易于進行,有鐵粉、鋅粉等的金屬還原法,Pd-C、Raney-Ni 等催化加氫還原法,硫化堿、亞硫酸鈉、硫代硫酸鈉、連二亞硫酸鈉等含硫化合物還原法。鐵粉等金屬還原法產生大量的鐵泥,不僅使產物分離困難,而且會污染環境。Pd-C等催化加氫主要是催化劑成本較高。含硫化合物還原反應條件溫和、分離容易、生成周期短、對設備腐蝕性小等特點,尤其適合制備不溶于水的胺類[12]。實驗表明,2,6-二叔丁基-4-氨基苯酚為白色粉末,不溶于水,易溶于丙酮、乙酸乙酯等有機溶劑。因此,連二亞硫酸鈉等含硫化合物還原法比較適合于本反應。工業級硫化堿因含少量雜質呈土黃色、棕紅色或粉紅色,會影響到產品的質量。因此,本反應選用亞硫酸鈉、硫代硫酸鈉、連二亞硫酸鈉等還原劑考察對反應影響。確定還原劑后,考察了還原劑用量、反應溫度、反應時間等因素對還原反應的影響。
2.2.1 還原劑的篩選 2,6-二叔丁基-4-亞硝基苯酚11.77 g(50 mmol),還原劑用量為2,6-二叔丁基-4-亞硝基苯酚摩爾數的3.6 倍,反應溫度為50 ℃,反應時間為1 h,考察了亞硫酸鈉(Na2SO3)、硫代硫酸鈉(Na2S2O3)、連二亞硫酸鈉(Na2S2O4)等3 種還原劑還原效果,結果見表4。

表4 還原劑對收率的影響Table 4 Effect of reductants on the yield
由表4 可知,用連二亞硫酸鈉作為還原劑,產物的收率最高,反應比較穩定,沒有產生有毒氣體。因此,本文以連二亞硫酸鈉作為還原劑,連二亞硫酸鈉中的硫化合價為+3,在堿性條件下,自身可被氧化成亞硫酸鈉或硫酸鈉。反應式如下:
2.2.2 還原劑用量的影響 2,6-二叔丁基-4-亞硝基苯酚11.77 g(50 mmol),反應溫度為50 ℃,反應時間為1 h,考察了還原劑用量對還原反應的影響,以連二亞硫酸鈉與2,6-二叔丁基-4-亞硝基苯酚摩爾比來表示,結果見表5。
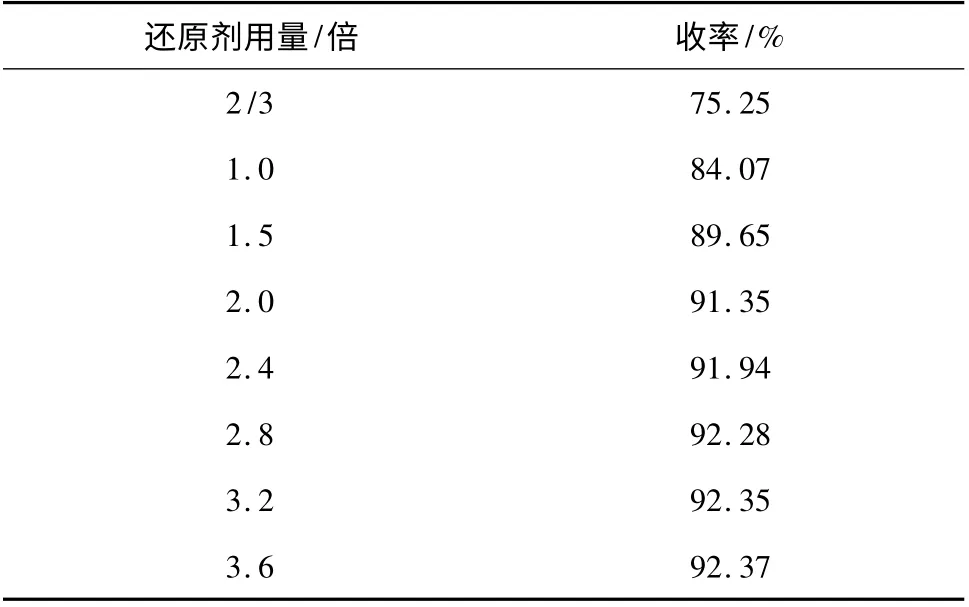
表5 還原劑用量對收率的影響Table 5 Effect of the amount of reductants on the yield
根據連二亞硫酸鈉被氧化的產物不同,理論上需要還原劑用量,即連二亞硫酸鈉用量為2,6-二叔丁基-4-亞硝基苯酚摩爾數2/3 ~2 倍。2,6-二叔丁基-4-氨基苯酚(DTBAP)在沒有氧化變質前為白色結晶性粉末(或片狀結晶),見光呈紫色,逐漸轉變成褐色;在堿性溶液中更易變化。它們在空氣中易氧化成亞胺醌,然后變成聚合物,結構式如下。因還原產物DTBAP 易氧化,所以還原劑適當過量可以提高產品收率。由表5 也可以看出,按最大理論用量(還原劑用量為2.0)加入還原劑,產品收率沒有達到最好。當還原劑用量達到2.8 及以上,產品收率達到了最好。

2.2.3 反應溫度的影響 2,6-二叔丁基-4-亞硝基苯酚11. 77 g(50 mmol),連二亞硫酸鈉32. 5 g(180 mmol),反應時間為1 h,不同反應溫度對還原反應的影響,可以直接從反應液的顏色上可以判斷。2,6-二叔丁基-4 亞硝基苯酚溶解于堿性水溶液,物料顏色呈棕紅色,隨著反應的進行,反應液顏色逐漸由棕紅色變成棕黃色,再變成淡黃色,最終變成雪白色。如果反應溫度過低,即使反應時間較長,反應液顏色也不會變成雪白色。反過來,反應溫度過高,反應液顏色又會變成粉紅色,說明已發生比較嚴重的氧化反應,結果見表6。

表6 反應溫度對收率的影響Table 6 Effect of reaction temperature on the yield
由表6 可知,反應溫度必須控制在60 ℃以下,較為合適的反應溫度為50 ~55 ℃。
2.2.4 反應時間的影響 2,6-二叔丁基-4-亞硝基苯酚11. 77 g(50 mmol),連二亞硫酸鈉32. 5 g(180 mmol),反應溫度50 ℃,還原反應時間一般是當反應液顏色變成白色后,繼續反應一定時間就能反應完全,在反應溫度50 ℃下,當連二亞硫酸鈉水溶液滴加完,繼續反應30 ~40 min,反應液顏色會變白色,考察結果見表7。

表7 反應時間對收率的影響Table 7 Effect of reaction time on the yield
由表7 可知,隨著反應時間的增加,產品收率逐漸提高,當反應時間60 ~70 min 時,產品收率達到最好,然后繼續增加反應時間,產品收率反而下降,可能氧化副產物增加的原因。
綜上所述,2,6-二叔丁基-4-亞硝基苯酚還原反應較為合適的反應條件為:以連二亞硫酸鈉為還原劑,在50 ~55 ℃下反應60 min,連二亞硫酸鈉用量為2,6-二叔丁基-4-亞硝基苯酚摩爾數的2.8 倍及以上,產品收率可達到92%以上。
3 結論
通過以2,6-二叔丁基苯酚(DTBP)為原料通過亞硝化反應、還原反應,合成2,6-二叔丁基-4-氨基苯酚(DTBAP)。通過單因素實驗系統考察了反應工藝條件得出:①亞硝化反應:以95%乙醇為溶劑,以濃鹽酸為酸化試劑,亞硝酸鈉用量為DTBP 摩爾量1.25 ~1.50 倍,反應溫度為15 ~20 ℃,反應時間2.0 ~2.5 h,產品收率達90%以上;②還原反應:以連二亞硫酸鈉為還原劑,在50 ~55 ℃下反應60 min,連二亞硫酸鈉用量為2,6-二叔丁基-4-亞硝基苯酚摩爾數的2. 8 倍及以上,產品收率可達到92%以上。本制備方法操作簡單,反應條件溫和、易于控制,產物易于分離,產品總收率較高,反應原料廉價、容易采購,生產成本較低,適合于工業化生產。
[1] Tochacek J. Effect of secondary structure on physical behaviour and performance of hindered phenolic antioxidants in polypropylene[J]. Polym Degrad Stab,2004,86(2):385-389.
[2] Vulic I,Vitarelli G,Zenner J M. Structure property relationships:phenolic antioxidants with high efficiency andlow colour contribution[J]. Polym Degrad Stab,2002,78(1):27-34.
[3] 李翠勤,王俊,方宏,等. 新型受阻酚類抗氧劑的合成與性能研究[J].中國塑料,2011,25(1):97-101.
[4] 劉德龍.抗氧劑565 合成工藝研究[D].南京:南京理工大學,2008.
[5] Cynthia D,Rajeshwar P,Kapur S. QSAR for the cytotoxicity of 2-alkyl or 2,6-dialkyl,4-X-phenols:the nature of the radical reaction[J].J Chem Soc,Perkin Trans,2002,2(2):1112-1117.
[6] Kjaer A M,Ulstrup J.Solvent bandwidth dependence and band asymmetry features of charge-transfer transitions in N-pyridinium phenolates[J]. J Am Chem Soc,1987,109(7):1934-1942.
[7] Yamada M,Araki K,Shiraishi S.Oxygenation of 2,6-di-tbutylphenol catalyzed by a new cobalt(ii)complex[Co(babp)]:a salen analogue having higher catalytic activity,selectivity,and durability[J]. J Chem,Soc Perkin Trans,1990,1(10):2687-2690.[8] Araki K,Kuboki T,Otohata M.Dioxygen adducts of cobalt(II)complexes of 6,6’-bis(psubstituted benzoylamino)-2,2’-bipyridines and their catalytic activities in oxygenation of 2,6-di-tert-butylphenol[J]. J Chem Soc Dalton Trans,1993,3(24):3647-3652.
[9] 計志忠. 化學制藥工藝學[M]. 北京:化學工藝出版社,1996:91-92.
[10]Wolfgang T,Heinz S,Helmut P,et al.Process for preparation of thioderivatives of alkylhydroxyanilino-triazine:EP,0457730(A2)[P].1991-11-21.
[11]Dexter M,Plains W,Knell M,et al.Method of stabilization of rubber with a substituted thiazine and compositions stabilized thereby:US,3257354[P].1966-06-21.
[12]高歌,金子林,蔣景陽.芳香硝基化合物還原方法的研究進展[J].現代化工,2011,31(6):57-61.

