豬源益生枯草芽孢桿菌的分離鑒定及培養條件優化
魏姍姍, 馬紅霞, 高云航, 幺乃全, 徐鳳宇, 李茂輝
(1.吉林農業大學動物科學技術學院,吉林長春130118;2.吉林正大實業有限公司,吉林長春 130052)
益生芽孢桿菌可產生脂肽、肽、磷脂、多烯、氨基酸、核酸等多種抑菌物質 (Tan等,2013;Chandraleka 和 Ramya,2011;呂艷艷等,2011),具有廣譜抑菌活性,且無毒、無副作用、無殘留、無耐藥性(Jacquet和 Grimal,2012;Huyghebaet等,2011)。 基于仔豬腹瀉的病原性細菌以革蘭氏陰性菌為主、發病率和死亡率較高的生產實際,本研究從健康仔豬腸道內分離拮抗革蘭陰性菌的芽孢桿菌,經抑菌試驗,耐受人工胃、腸液試驗和安全性試驗,獲得了一株益生芽孢桿菌,為其生產應用奠定了基礎。
1 材料與方法
1.1 材料
1.1.1 菌種 解淀粉芽孢桿菌 (TR)、大腸桿菌(CVCC200)、大腸桿菌(AT52)、大腸桿菌(JMS)、金黃色葡萄球菌(K88)、白葡萄球菌(AK2)、恥垢分枝桿菌(mc2155)、新金分枝桿菌(NC18-1)、偶發分枝桿菌(NC19-2)、母牛分枝桿菌(NH55-2)、金新分枝桿菌(NC56-2)、黏質沙雷菌(jn01)、鏈球菌(CVCC100)、多殺性巴氏桿菌(CVCC500)、多殺性巴氏桿菌(PmA),均為吉林農業大學預防獸醫學實驗室保存。
1.1.2 主要試劑 NaCl、MgSO4·7H2O、NH4H2PO4、檸檬酸鈉、酚紅、豬膽鹽、胃蛋白酶、胰蛋白酶、KH2PO4、NaOH、10%鹽酸,均購自上海生工生物工程股份有限公司;DNA凝膠回收純化試劑盒,購自北京鼎國生物有限責任公司;質粒小提試劑盒,購自北京索萊寶科技有限公司。人工胃液和人工腸液配制參考曹鈺等(2006),略有改動。
1.1.3 培養基 LB固體、LB液體培養基和檸檬酸鹽培養基按常規方法配制(周德慶,1986)。
1.1.4 試驗動物 體重17~20 g的昆明系小鼠20只,購自長春生物制品研究所有限責任公司,20日齡長白杜洛克健康仔豬,購自長春市某豬場。
1.2 試驗方法
1.2.1 菌株的分離 采集健康仔豬的空腸,置于裝有5 mL無菌生理鹽水的試管中,80℃水浴作用10 min,靜置后吸上清100 μL涂于LB平板上,37℃培養至長出菌落。
1.2.2 拮抗試驗 將分離到的菌株點接法接種于涂有大腸桿菌 (CVCC200)和金黃色葡萄球菌(K88)的LB平板上,37℃培養12~14 h,觀察抑菌效果;取有抑菌作用的芽孢桿菌分別進行37℃厭氧和有氧培養,觀察抑菌效果,若菌株無抑菌效果則舍去。
1.2.3 毒力試驗 將抑菌效果較好的14株菌接種于液體LB培養基中,37℃培養24 h后,制備成濃度為1×109cfu/mL的菌液,腹腔注射試驗鼠,1 mL/只,觀察小鼠生存狀況,若接種菌株的小鼠出現異常表現甚至死亡,則舍去該菌株。
1.2.4 抑菌譜試驗 將毒力試驗篩選出的菌株用點接法接種于涂有14種指示菌的平板上,觀察抑菌效果,若菌株抑菌譜相對較廣且抑菌效果較好,則保留該菌株。
1.2.5 耐膽鹽試驗 將篩選到的有廣譜抑菌活性的菌株接種于含0%、0.2%、0.3%、0.4%、0.5%豬膽鹽的LB液體培養基中,37℃培養40、80、120 min,進行活菌計數。
1.2.6 耐人工胃液、腸液試驗 取已形成芽孢的分離菌培養物離心,用0.9%的生理鹽水洗滌兩次后重懸,接種于人工胃液中,振蕩混勻,37℃水浴孵育,每隔40 min取樣進行活菌計數。
將經pH為2.0的人工胃液處理后的菌體離心,用0.9%生理鹽水洗滌兩次后重懸接種于人工腸液中,振蕩混勻,37℃水浴孵育,每隔40 min取樣1次進行活菌計數。
1.2.7 菌株JN-16的菌落及形態觀察 將耐受性和抑菌效果較好的菌株JN-16劃線接于LB固體培養基表面,37℃培養12~14 h,觀察菌落特征,經革蘭染色,在光學顯微鏡下觀察菌體的形態大小。
1.2.8 菌株JN-16的分子生物學鑒定 采用試劑盒法提取菌株JN-16基因組總DNA,應用PCR法擴增16S rDNA,反應體系見表1。得到的PCR產物用DNA凝膠回收純化試劑盒純化并回收1400~1500 bp片段,擴增產物經純化后送上海生物工程有限責任公司測序。將測序得到的16S rDNA全序列遞交 GenBank數據庫中進行Blast比對及同源性比較,將與之同源性最高的15株細菌的16S rDNA序列采用DNAstar軟件進行比對分析,并構建系統發育樹。
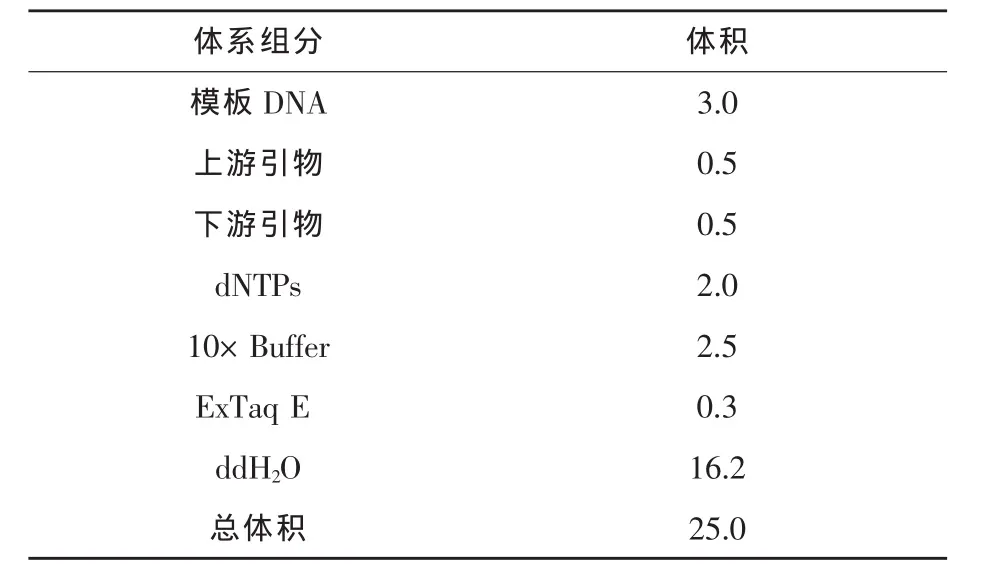
表1 PCR反應體系 μL
1.2.9 耐鹽試驗 挑取菌株JN-16和解淀粉芽孢桿菌(TR)的單個菌落分別接種于含5%NaCl的LB液體培養基中,37℃過夜培養,觀察結果。
1.2.10 檸檬酸鹽利用試驗 分別釣取菌株JN-16和解淀粉芽孢桿菌(TR),將其單個菌落分別接種于檸檬酸鹽斜面培養基上,37℃培養3 d,觀察結果。
1.3 抑菌培養條件優化
1.3.1 最適培養時間及溫度 將菌株JN-16種子液按照5%(V/V)接于LB液體培養基中置于28、32、33、34、37 ℃培養 12、24、48、72 h 后,10000 r/min離心15 min,收集上清,采用牛津杯法分別檢測上清液對大腸桿菌(CVCC200)和金黃色葡萄球菌(K88)的抑菌效果,得到最適培養時間及溫度。
1.3.2 最適pH 將菌株JN-16種子液按照5%(V/V) 接于 pH 分別為 4.5、5.5、6.5、7.5、8.5、9.5、10.5的LB液體培養基中,33℃培養24 h,10000 r/min離心15 min,收集上清,采用牛津杯法分別檢測上清液對大腸桿菌(CVCC200)和金黃色葡萄球菌(K88)的抑菌效果,得到最適 pH。
1.3.3 碳源優化 將菌株JN-16種子液按照5%(V/V)接種于分別以羧甲基纖維素鈉、馬鈴薯淀粉、葡萄糖、麩皮、秸稈、麥芽糖、乳糖、蔗糖作為碳源,pH為6.5的LB液體培養基中,33℃培養24 h,10000 r/min離心15 min,收集上清,采用牛津杯法分別檢測上清液對大腸桿菌(CVCC200)和金黃色葡萄球菌(K88)的抑菌效果。
1.3.4 氮源優化 將菌株JN-16種子液按照5%(V/V)接種于分別以NH4Cl、牛肉膏、胰蛋白胨、大豆蛋白胨、蛋白胨混合酵母粉、NH4Cl混合牛肉膏作為氮源,pH為6.5的LB液體培養基中,33℃培養24 h,采用牛津杯法分別檢測上清液對大腸桿菌(CVCC200)和金黃色葡萄球菌(K88)的抑菌效果。
2 結果與分析
2.1 菌株分離和拮抗試驗結果 從仔豬空腸內共篩選出芽孢桿菌23株,通過抑菌試驗得到14株對大腸桿菌(CVCC200)和金黃色葡萄球菌(K88)抑制效果較好的菌株,并將它們命名為菌株JN-4、JN-8、JN-10、JN-11、JN-12、JN-13、JN-14、JN-15、JN-16、JN-17、JN-18、JN-19、JN-21、JN-22。
2.2 毒力試驗結果 灌服菌株JN-14的小鼠死亡,其他小鼠精神狀況正常,未出現異常反應,剖檢未見病變,這表明除菌株JN-14組外,其他13株菌株對試驗小鼠無毒,所以可舍去菌株JN-14,將其他13株菌進一步篩選。
2.3 抑菌譜試驗結果 對毒力試驗篩選出的13株菌株進行抑菌譜測定,結果如表2所示。但13株菌株對白葡萄球菌(AK2)、鏈球菌(CVCC100)、大腸桿菌(JMS)、多殺性巴氏桿菌(CVCC500),多殺性巴氏桿菌(PmA)的抑菌能力較低,抑菌圈較小,對新金分枝桿菌 (NC18-1)、偶發分枝桿菌(NC19-2)、母牛分枝桿菌(NH55-2)均無抑制作用。 菌株JN-4、菌株JN-8、菌株JN-11、菌株JN-16、菌株JN-19抑菌譜較廣,且抑菌效果較好,所以保留該5株菌株并進一步篩選。
2.4 耐膽鹽試驗結果 豬小腸中膽鹽的高滲透壓環境不利于菌體存活,0.3%的膽鹽濃度被認為是篩選抗性菌的參考標準。由圖1可見,菌株JN-16、菌株JN-8對一定濃度的膽鹽環境具有良好的耐受性,濃度為0.2%和0.3%膽鹽作用120 min后,仍可保持較高的存活率,當膽鹽濃度達0.4%和 0.5%時,JN-8活菌數下降,而菌株JN-16對0.5%膽鹽至少可耐受120 min。
2.5 耐人工胃腸液試驗結果
2.5.1 耐人工胃液試驗結果 健康動物的胃液pH一般為0.9~1.8,進食后胃液的pH為1.8~5,食物在胃中消化的時間一般為1~2 h。因此,菌株要有很好的耐酸能力才能通過高酸的胃環境而到達小腸發揮作用。由表3可知,菌株JN-16和菌株JN-8均對人工胃液有較好的耐受性。
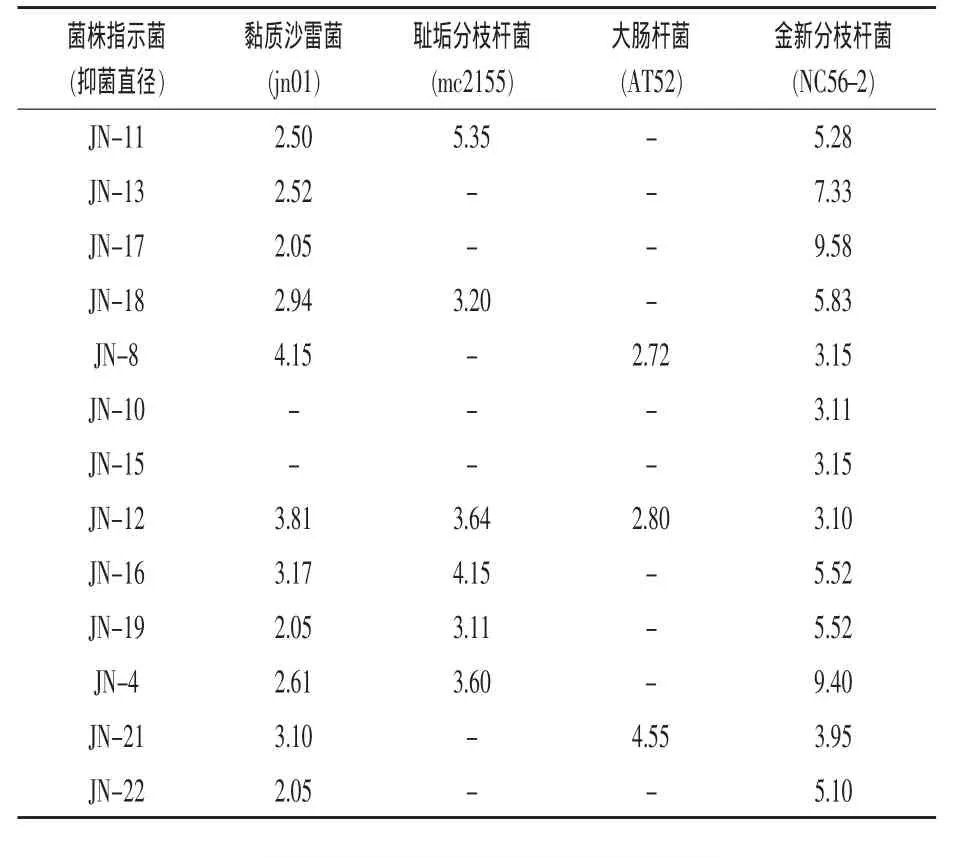
表2 抑菌試驗結果 mm
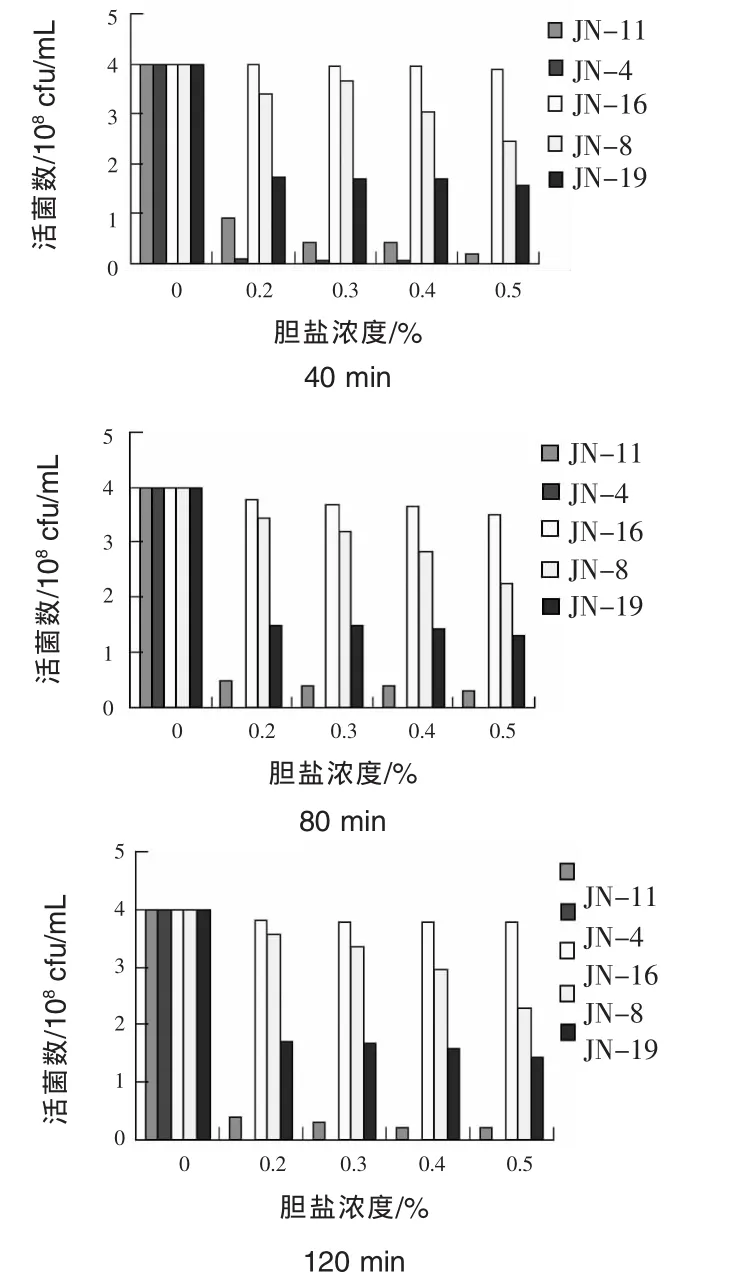
圖1 不同膽鹽濃度和作用時間對菌株活菌數影響(108cfu/mL)
2.5.2 耐人工腸液試驗結果 小腸液的pH一般為7.6,食物通過的時間為1.5 h,因此,菌株只有耐受住小腸液的作用,并保持一定數量才能發揮作用。由表4可知,人工腸液對JN-16號菌株影響小,大部分菌株均能夠在腸液中生長,這說明菌株JN-16對人工腸液的耐受能力最強。
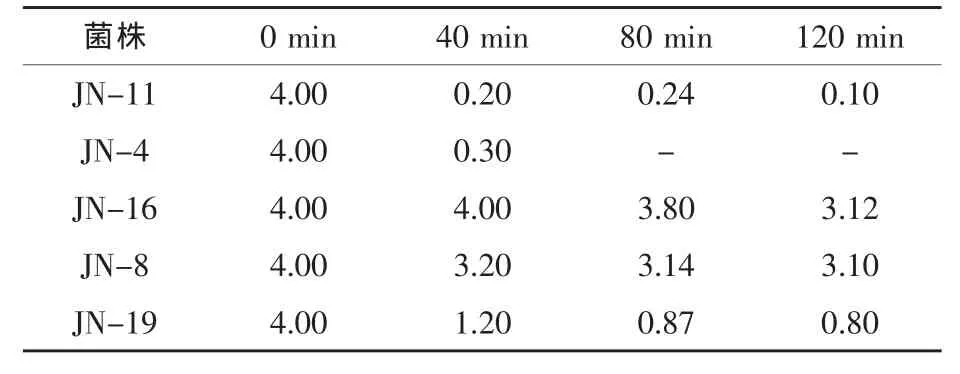
表3 在不同培養時間下菌株在人工胃液中的存活情況 108cfu/mL
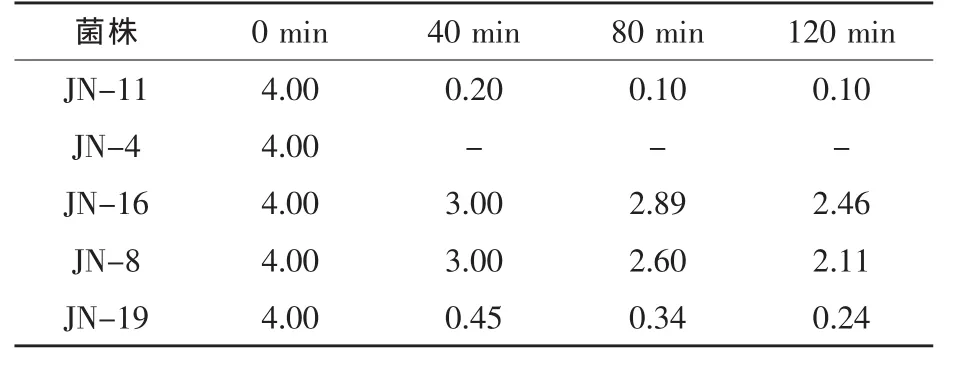
表4 在不同培養時間下菌株在人工腸液中的存活情況 108cfu/mL
2.6 菌株JN-16的菌落及個體形態 菌株JN-16菌落呈白色,扁平,半透明,邊緣不整齊;在液體培養基表面形成皺醭;菌體長1.04~1.74 μm,革蘭陽性,芽孢0.6~1.5 μm,橢圓,較菌體狹窄,位于菌體中央。
2.7 菌株JN-16的16S rDNA序列同源性分析以菌株JN-16基因組DNA為模板,利用細菌16S rDNA通用引物進行PCR擴增,得到特異性較高的唯一產物,大小為1500 bp左右,經測序和序列分析發現,所獲得的DNA基因片段長度為1488 bp,與枯草芽孢桿菌X-01(序列登錄號:EU723210.1)和解淀粉芽孢桿菌HY-7(序列登錄號:JN382250.1)等菌株存在100%的同源性。
2.8 菌株JN-16基因序列系統進化樹的構建結果 應用DNAstar軟件,用測得序列和GenBank中收錄的同源性最高的15株芽孢桿菌的16S rDNA序列構建系統發育樹,見圖2。表明菌株JN-16與解淀粉芽孢桿菌和枯草芽孢桿菌親緣關系最近。
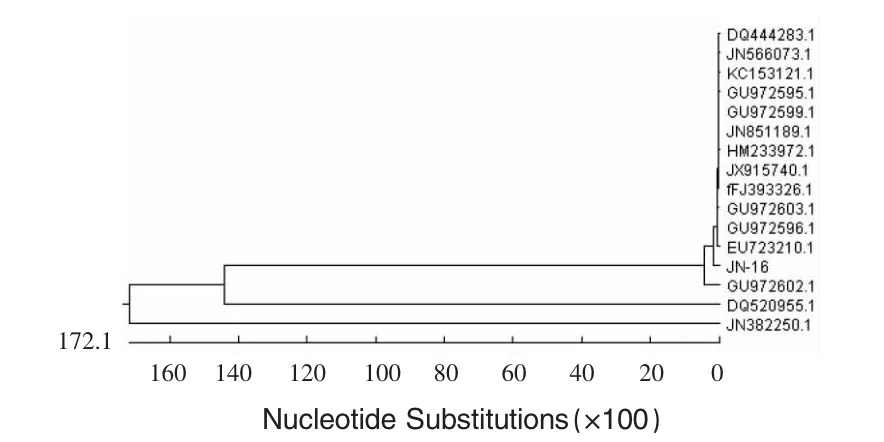
圖2 基于菌株16S rDNA序列的進化樹
2.9 含5%NaCl的LB培養基的培養結果 由培養結果可以看出,菌株JN-16能夠在5%NaCl的LB的培養基中生長。通過《常見細菌系統鑒定手冊》可知,枯草芽孢桿菌可在5%NaCl的LB培養基中生長而解淀粉芽孢桿菌(TR)則不能在其中生長,所以可初步認為菌株JN-16為枯草芽孢桿菌。
2.10 檸檬酸鹽利用試驗結果 將菌株JN-16和解淀粉芽孢桿菌分別接種于檸檬酸鹽斜面培養基上,培養3 d,培養基為堿性(指示劑為藍色或桃紅色)者為陽性,否則為陰性。培養3 d后,觀察結果。菌株JN-16在檸檬酸鹽培養基上表現為陽性,這與枯草芽孢桿菌的性質相同。
2.11 抑菌培養條件優化結果
2.11.1 發酵時間對JN-16抑菌作用的影響 由圖3可知,在發酵24 h時,菌株JN-16對大腸桿菌和金黃色葡萄球菌抑制作用相對其他發酵時間抑制效果好,抑菌圈直徑分別達到11 mm和12 mm。發酵時間在12 h和36 h,抑菌圈差異均不顯著。在發酵時間為72 h時,抑菌圈最小,由此可以看出,菌株JN-16對大腸桿菌和金黃色葡萄球菌的抑制能力均較強,同時當發酵時間達到24 h后,隨著發酵時間的延長,抑菌能力逐漸減弱。所以,獲得菌株JN-16的最適抑菌時間為24 h。
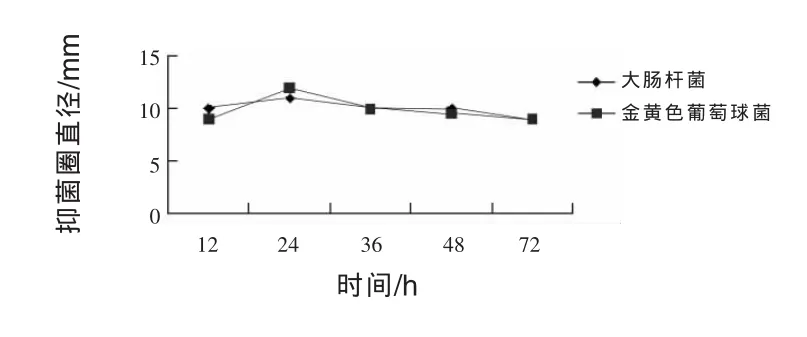
圖3 不同培養溫度對菌株JN-16抑菌作用的影響
2.11.2 溫度對JN-16抑菌作用的影響 由圖4可知,28~33℃,菌株JN-16抑菌能力隨溫度升高而增強,達到最大值后逐漸減弱。而菌株JN-16在發酵時間為33℃和37℃時抑菌圈大小相同,抑菌圈直徑為11 mm,較其他發酵溫度抑制大腸桿菌能力強。菌株JN-16對金黃色葡萄球菌最大抑制作用發生在發酵溫度為33℃時,抑菌圈直徑為12 mm。所以獲得菌株JN-16的最適抑菌溫度為33℃和37℃。
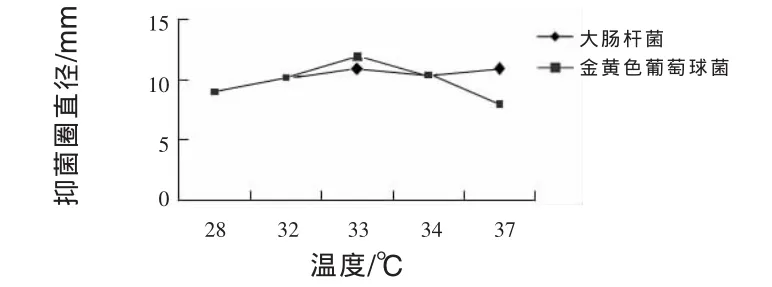
圖4 不同培養時間對菌株JN-16抑菌作用的影響
2.11.3 pH對JN-16抑菌作用的影響 由圖5可知,pH在達到6.5之前,抑制能力不斷增強,pH達到6.5時,抑制金黃色葡萄球菌和大腸桿菌的能力最大,抑菌圈直徑分別為20 mm和12.1 mm,隨后抑制能力逐漸減弱。不同pH值對JN-16抑制大腸桿菌能力影響較大,但對抑制金黃色葡萄球菌能力影響較小。
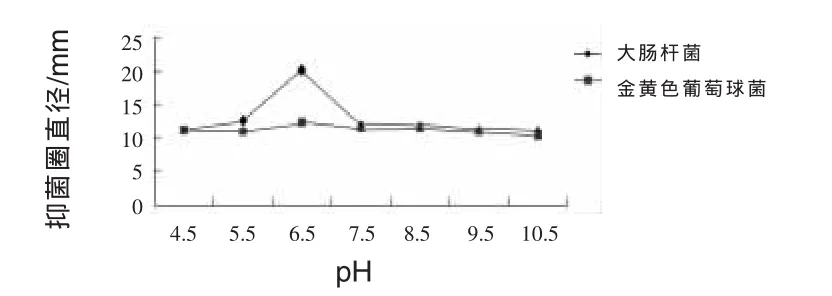
圖5 不同pH對菌株JN-16抑菌作用的影響
2.11.4 改變碳源對JN-16抑菌作用的影響 由圖6可知,以葡萄糖作為碳源時,JN-16抑制大腸桿菌能力最強,抑菌圈直徑為14.42 mm,乳糖、馬鈴薯粉、麥芽糖次之,抑制大腸桿菌能力最低的碳源是羧甲基纖維素鈉和蔗糖,抑菌圈直徑均為12.1 mm。抑制金黃色葡萄球菌能力最強的碳源是馬鈴薯淀粉,抑菌圈直徑為14 mm,羧甲基纖維素鈉、麩皮、葡萄糖、乳糖、秸稈次之,抑制金黃色葡萄球菌能力最低的是麥芽糖,抑菌圈直徑為11.7 mm。由于葡萄糖抑菌效果較好,價格低廉,故選葡萄糖為最佳碳源。
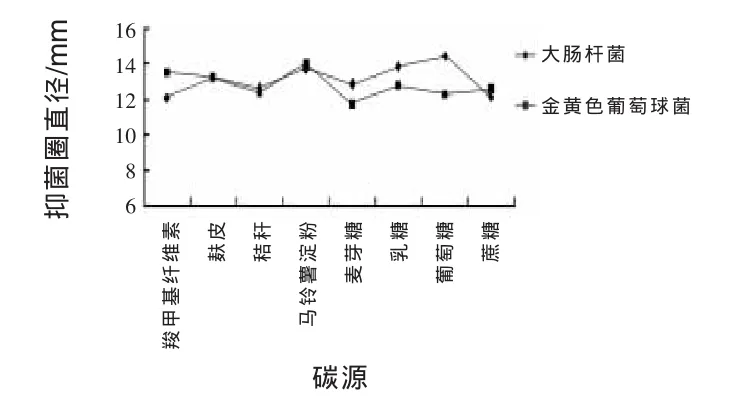
圖6 不同碳源對菌株JN-16抑菌作用的影響
2.11.5 改變氮源對抑菌作用的影響 由圖7所示,作為菌株JN-16抑制大腸桿菌能力最強的氮源是牛肉膏,抑菌圈直徑為11.48 mm,其次為大豆蛋白胨和NH4Cl,抑菌圈直徑分別為11.3 mm和11.1 mm,蛋白胨+酵母粉作為氮源抑菌能力最低,抑菌圈直徑為10.4 mm。NH4Cl+牛肉膏和胰蛋白胨作為氮源,抑菌圈直徑為10.8 mm和10.7 mm,差異不顯著。NH4Cl和大豆蛋白胨作為氮源,JN-16抑制金黃色葡萄球菌能力最強,抑菌圈直徑均為11.6 mm,其次為蛋白胨+酵母粉,抑菌圈直徑為11.18 mm,胰蛋白胨和NH4Cl+牛肉膏作為氮源,抑菌能力差異不大,抑菌圈直徑分別為1 0.8 mm和10.68 mm。作為氮源抑制金黃色葡萄球菌能力最低的是牛肉膏,抑菌圈直徑為10.3 mm。大豆蛋白胨作為氮源時,JN-16對大腸桿菌和金黃色葡萄球菌的抑制能力均相對較強,可作為最佳氮源。
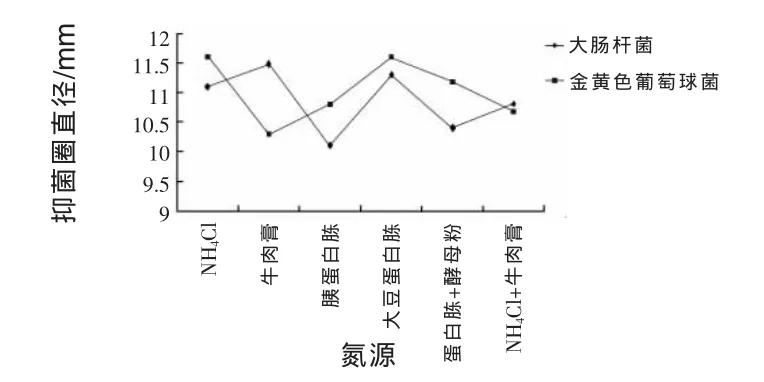
圖7 改變氮源對菌株JN-16抑菌作用的影響
3 討論
芽孢桿菌類是目前研究比較廣泛的一類疫病防治微生物。已報道用于畜禽養殖中的芽孢桿菌種類主要有蠟樣芽孢桿菌、納豆芽孢桿菌、枯草芽孢桿菌、凝結芽孢桿菌、巨大芽孢桿菌、環狀芽孢桿菌、堅強芽孢桿菌、短小芽孢桿菌、東洋芽孢桿菌等,它們具有拮抗病原菌活性,能夠增強機體免疫力,提高養殖經濟效益(Defoirdt等,2011)。
本試驗結果表明,枯草芽孢桿菌JN-16對恥垢分枝桿菌、金新分枝桿菌有抑制作用,但對其他分枝桿菌抑制作用較弱或無抑制作用,這可能是由于不同分枝桿菌產生的抑菌物質及作用機理不同所致(Gil,2011)。對枯草芽孢桿菌JN-16進行了安全性試驗及對胃腸道環境耐受性試驗,結果顯示,枯草芽孢桿菌JN-16能夠耐受胃、腸液的消化,且該菌安全無毒,具備作為優良益生菌株的條件(Cheesman 等,2012;何若天,2011)。
枯草芽孢桿菌JN-16發酵條件優化結果顯示,以葡萄糖為碳源、大豆蛋白胨為氮源、pH為6.5時在33℃或37℃培養24 h抑菌作用最強。王超等(2012)報道的一些枯草芽孢桿菌優化結果同樣是以葡萄糖為氮源、33℃或37℃培養24 h抑菌效果均較好,而氮源大多選用酵母浸粉,且pH值在7.0~7.5。研究發現一些芽孢桿菌在不同溫度、不同環境的培養條件下,抑菌作用發生了變化,可能是由于芽孢桿菌在不同溫度和培養條件下產生的抑菌物質的不同,所以本株菌所產抑菌物質尚待研究。
[1]曹鈺,孫玲玲,陸健.酸與膽汁耐性芽孢益生菌的篩選[J].科技動態,2006,8:31 ~ 34.
[2]何若天.益生芽孢桿菌在畜禽養殖中的應用效果和使用方法[J].科學種養,2011,2:4 ~ 5.
[3]呂艷艷,張首都,單春喬.細菌素的作用機理及在生產中的應用[J].動物微生態學雜志,2011,23(11):1053 ~ 1055.
[4]王超,陳啟和,倪輝,等.1株枯草芽孢桿菌的鑒定及其彈性蛋白酶結構研究[J].微生物學雜志,2012,32(3):13 ~ 20.
[5]周德慶.微生物學實驗手冊[M].上海:上海科學技術出版社,1986.
[6]Chandraleka K,Ramya G C.Antimicrobial mechanism of copper(II)1,10-phenanthroline and 2,2-bipyridyl complex on bacterial and fungal pathogens[J].Saudi Chemical Society,2011,19(6):926 ~ 930.
[7]Cheesman L,Nair J N,Staden J N.Antibacterial activity of crinane alkaloids from Boophone disticha (Amaryllidaceae) [J].Ethnopharmacology,2012,140(2):405 ~ 408.
[8]Defoirdt T,Thanh L D,Delsen B V.N-acylhomoserine lactone-degrading Bacillus strains isolate from aquaculture animals[J].Aquaculture,2011,311(1):258~260.
[9]Gil F,Pimentel M,Moniz-Pereira J,et al.Function Analysis of the Holin-Like Proteins of Mycobacteriophage Ms6[J].Bacteriology,2011,193(11):2793 ~2803.
[10]Hughes M A,Silva J C,Geromanos S J,et al.Ouantitative proteomic analysis of drug-induced changes in mycobateria[J].J Proteome Res,2006,5(1):54 ~ 63.
[11]Huyghebaet G,Ducatelle R,Immerseel F V.An update on alternatives to antimicrobial growth promoters for broilers[J].The Veterinary Journal,2011,187(2):182 ~ 188.
[12]Jacquet T,Grimal C C.Antibacterial activity of class lla bacteriocin Cbn BM1 depends on the physiological state of the target bacteria[J].Research in Microbiology,2012,163(5):323 ~ 331.
[13]Tan Y N,Matthews K R,Di R,et al.Comparative antibacterial mode of action of purified alcalase-and tryptic-hydrolyzed palm kernel cake proteins on the food-borne pathogen Bacillus cereus[J].Food Control,2013,31(1):53~54.

