酶聯免疫吸附法測定紅細胞內多聚谷氨酸化甲氨蝶呤濃度的方法建立及其初步應用
牟方祥 吳紅 王恒 鄒德生 王勇方 勇飛
第三軍醫大學第一附屬醫院中西醫結合科,重慶400038
酶聯免疫吸附法測定紅細胞內多聚谷氨酸化甲氨蝶呤濃度的方法建立及其初步應用
牟方祥 吳紅 王恒 鄒德生 王勇方 勇飛
第三軍醫大學第一附屬醫院中西醫結合科,重慶400038
目的建立檢測紅細胞內多聚谷氨酸化甲氨蝶呤(methotrexate polyglutamates,MTXPG)的酶聯免疫吸附測定法(ELISA)方法。方法將含有MTXPG的紅細胞采用凍融法、化學裂解法、酶法、超聲破碎法等方法裂解,加入血清與裂解液在抗壞血酸、巰基乙醇保護液作用下將MTXPG轉化為甲氨蝶呤(methotrexate,MTX),轉化液采用高氯酸、三氯乙酸及飽和硫酸銨溶液沉淀蛋白,最后將溶液pH值調整為3.0~9.0,采用ELISA檢測MTX濃度。經方法學考核后,檢測臨床標本對方法準確性進行評價。結果發現凍融法與凍融法裂解紅細胞顯著優于酶法和化學裂解法(P<0.05),抗壞血酸配制的保護液明顯優于巰基乙醇(P<0.05),轉化液37℃孵育3 h時MTXPG轉化完全,高氯酸、三氯乙酸、飽和硫酸銨溶液3種蛋白沉淀劑無明顯差異(P>0.05),最適pH為6~8,最佳pH值為6.8。濃度在0.2~10.0 ng/mL范圍內線性關系良好(r=0.9967),回收率為96.6%~103.3%,RSD為8.0%~14.3%,日內差異為1.7%~11.7%,日間差異為7.4%~13.5%,RSD均小于15%。檢測患者紅細胞內MTXPG濃度為(64.75±28.45)ng/mL。結論建立的紅細胞內MTXPG的ELISA法有良好的準確性和特異性,方法操作簡單易行,可用于臨床紅細胞內MTXPG濃度的監測。
多聚谷氨酸化甲氨蝶呤曰甲氨蝶呤曰固相酶聯免疫吸附法曰裂解
多聚谷氨酸化甲氨蝶呤(methotrexate polyglutamates,MTXPG)是甲氨蝶呤(methotrexate,MTX)在體內的代謝產物[1],1973年Baugh等[2]首次報道在人紅細胞內發現MTXPG,后在人肝臟細胞中也存在MTXPG[3]。MTX作為一種葉酸拮抗劑,廣泛用于抗腫瘤、免疫抑制、抗風濕、異位妊娠等治療[4-8]。MTXPG被認為是人體內MTX發揮藥理作用的活性成分[3],低劑量MTX常用于治療類風濕關節炎,大約有30%的患者因對MTX無顯著療效或不良反應而停止治療[9],MTX治療缺乏一個有效的療效及不良反應預測指標,大部分MTX在24 h被代謝,不能反映MTX的效應,MTXPG長期儲存于患者紅細胞內[9-10]。檢測細胞內MTXPG含量可預測MTX的治療效果及藥物不良反應。目前MTXPG的常用的檢測方法為高效液相色譜法(HPLC)、色譜質譜法(LC-MS)、放射免疫分析法(RIA)[6-11]。上述方法準確度高,但是操作繁瑣,檢測成本高,且需要特殊設備儀器,不適用用臨床及基層醫院開展。本課題組前期研究已經研發出生物素-親和素偶聯放大競爭酶聯免疫吸附法(ELISA)MTX檢測試劑盒,本研究結合MTXPG結構特點,選擇將紅細胞內MTXPG體外轉為MTX,探索其轉化體系、細胞裂解液、pH值、轉化液、細胞轉化溫度及時間等條件,建立檢測紅細胞內MTXPG的ELISA方法。
1 儀器與試藥
1.1 主要試劑與儀器
1.1.1 試劑生物素-親和素偶聯放大競爭ELISA MTX檢測試劑盒(自制),紅細胞裂解液(自制),蛋白酶(美國Sigma公司),MTXPG標準品(瑞士Schircks實驗室),MTX標準品(中國藥品生物制品研究所),硫酸銨、巰基乙醇、高氯酸等均為分析純。
1.1.2 儀器超聲細胞破碎儀(上海狄非DH96-IIN)、洗板儀(BIOTEK ELX50)、超純水系統(德國賽多利斯arium)、-80℃超低溫冰箱(日本三洋YL300)、酶標儀(BIOTEK ELX800)、恒溫孵育箱(上海儀器廠lw600)、高速離心機(Eppendorf,ELS)、微量可調移液器、磁力攪拌器、搖床等。
1.2 樣本來源
實驗用口服MTX的類風濕關節炎患者紅細胞為患者檢測完血常規后遺留血樣。
2 方法與結果
2.1 方法原理
本實驗采用ELISA檢測紅細胞內MTXPG濃度,檢測方法的原理是先將紅細胞裂解,利用血清中γ-谷氨酰水解酶(γ-glutamyl hydrolase,GGH)在轉化保護液的作用下將MTXPG轉化為MTX,再用蛋白沉淀劑將反應液中蛋白沉淀,最后調解至適合pH,采用ELISA檢測MTX濃度,最后計算出MTXPG濃度。本實驗通過考察紅細胞裂解方式、時間、溫度、轉化保護液、蛋白沉淀劑、反應pH等因素對檢測體系的影響,進而確定出最適合反應體系及條件,并對方法的靈敏度、精密度、準確度進行驗證。
2.2 紅細胞裂解方法對實驗的影響
反復凍融法裂解紅細胞,取200μL含MTXPG的紅細胞分別在-80℃和-20℃下凍存,在37℃和56℃下復融,觀察不同凍融次數及凍存、復融時間對實驗的影響(見圖1A~C),由圖可見:-80℃下凍存10 min,-20℃下凍存60 min,37℃下復融7 min,56℃下復融2 min,各個溫度下凍融2次可達到實驗要求。凍融法、化學裂解法、酶法、超聲破碎法四種方法裂解紅細胞對實驗影響見圖1D,提示反復凍融法優于酶法和化學裂解法(P<0.05)中。
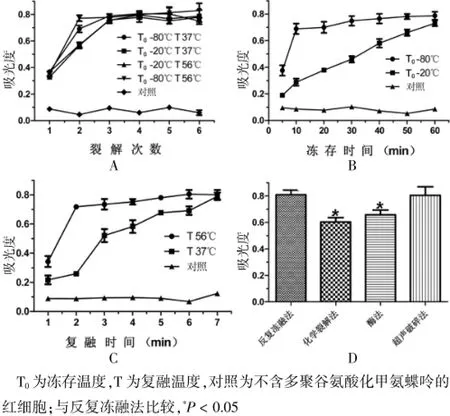
圖1 紅細胞裂解方法對實驗的影響
2.3 MTXPG轉化為MTX條件對實驗影響
取上述紅細胞裂解液50μL與100μL自體血清1∶2混勻,分別在抗壞血酸和巰基乙醇的保護液下37℃避光孵育12 h。兩種保護液對實驗影響見圖2A,由圖可見:壞血酸配制的保護液優于巰基乙醇(P<0.05)。在37℃避光孵育30 min及1、2、3、4、5、6、8、10、12 h,觀察不同孵育時間實驗結果見圖2B,由圖可見,孵育3 h MTXPG可完全轉化為MTX。
2.4 蛋白沉淀實驗及溶液pH值對實驗影響
將100μL上述轉化液在分別加入10μL的0.3%高氯酸、10μL 1%三氯乙酸、100μL飽和硫酸銨溶液,分別觀察三種蛋白沉淀劑對實驗影響見圖3A。由圖可見:3種蛋白沉淀劑差異無統計學意義(P>0.05)。將加完蛋白沉淀劑的轉化液混勻,12 000g高速離心5 min,用1 moL/L的氫氧化鈉將上清液pH值調為3~9,不同pH值下結果見圖3B,最適pH為6~8,最佳pH值為6.8。
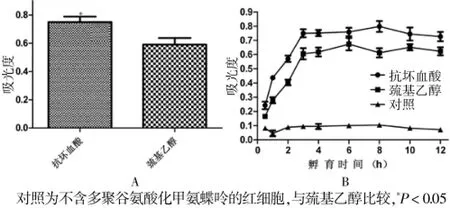
圖2 多聚谷氨酸化甲氨蝶呤轉化為甲氨蝶呤條件對實驗的影響
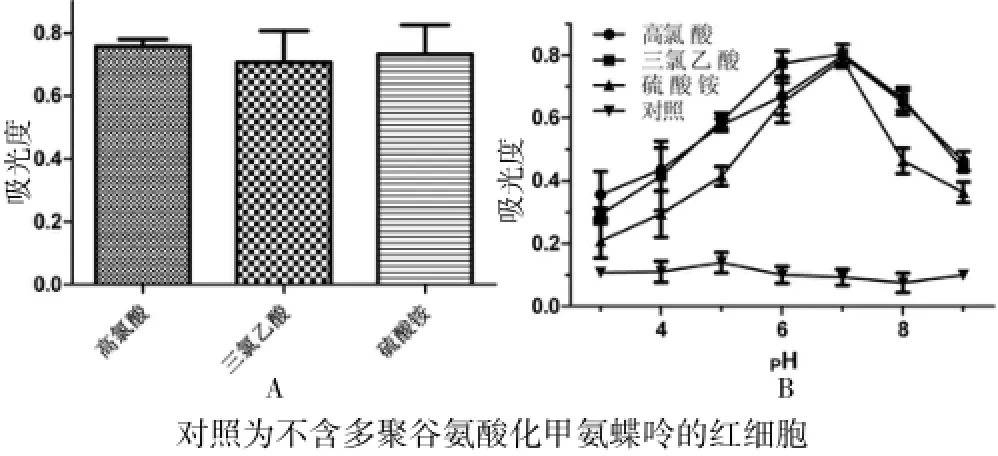
圖3 蛋白沉淀實驗及溶液pH值對實驗影響
2.5 方法學驗證實驗
靈敏度實驗將標準MTXPG稀釋成不同濃度,測得其標準曲線見圖4A,由圖可得靈敏度為0.096 ng/mL,線性方程為Y=-0.7859X+0.9007(r=0.9967),線性范圍為0.2~10.0 ng/mL,其中X為濃度的對數值,Y為吸光度。精密度實驗,將標準MTXPG溶液加入空白紅細胞中,配制為1、2.5、5、7.5 ng/mL 4個不同濃度水平的待測樣本,根據標準曲線計算出MTXPG濃度,再與加入濃度相比得出回收率,同一天平行測量上述樣本5次,連續測5 d,1次/d,分別計算日間及日內差異,結果見表1,回收率為96.6%~103.3%,平均回收率為100.8%,RSD=8.0%~14.3%,平均RSD=10.2%,日內差異為1.7%~11.7%,平均RSD=8.4%,日間差異為7.4%~13.5%,平均RSD=9.6%。監測20例口服MTX類風濕關節炎患者紅細胞內MTXPG濃度,結果見圖4B,平均MTXPG濃度為(64.75±28.45)ng/mL。
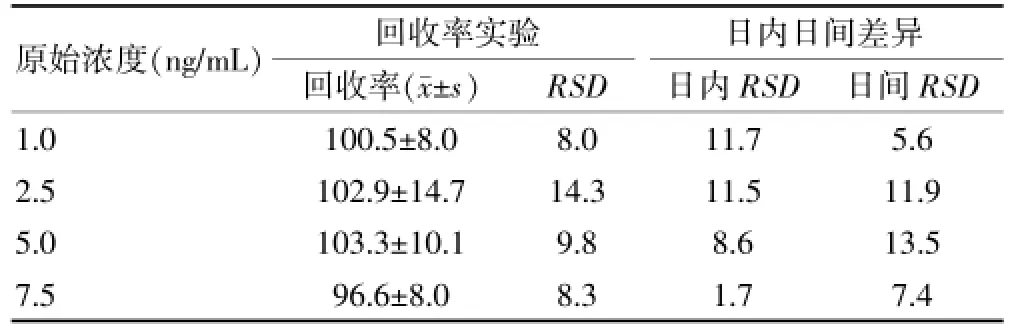
表1 多聚谷氨酸化甲氨蝶呤酶聯免疫吸附測定下回收率堯日內及日間差異(%,n=5)
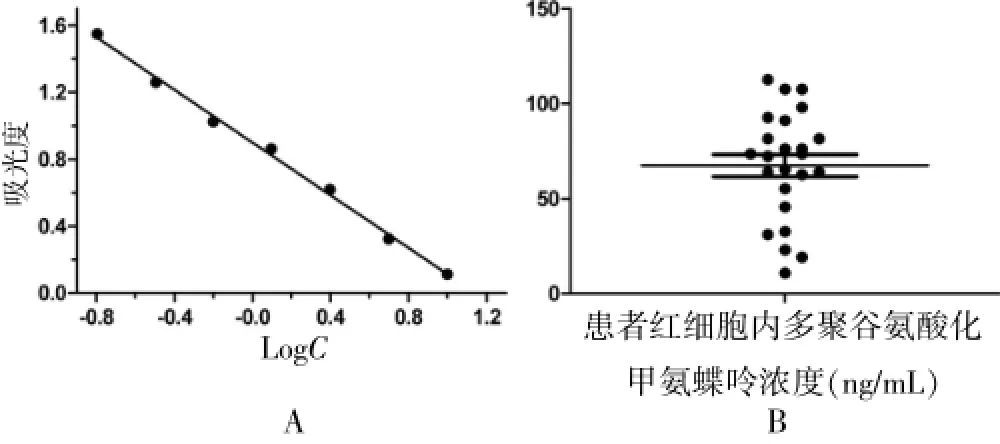
圖4 方法標準曲線及口服甲氨蝶呤類風濕關節炎患者紅細胞內多聚谷氨酸化甲氨蝶呤濃度分布
3 討論
MTXPG是MTX在葉酰聚谷氨酸合成酶作用下與谷氨酸聚合而成,一個MTX分子最多可聚合6個谷氨酸分子,可形成六種不同聚合物,各聚合物分子式相差1~6的谷氨酸[10-13]。MTXPG多存在于細胞內,且含量非常低,同時分離和檢測單個MTXPG聚合物難度非常大[11]。目前常用的檢測方法為同位素內標色譜質譜法[14],同位素內標制備成本高,且其操作繁瑣,需要特殊設備儀器,不適用于臨床檢測。有研究者在體外將MTXPG轉化為MTX,1分子MTXPG轉化為1分子的MTX,采用HPLC測定總的MTX濃度,可推算出MTXPG濃度[15]。ELISA方法高效、特異、敏感、操作簡單且無需特殊儀器,廣泛用于生命科學和醫學領域[15]。本課題組擬采用ELISA法檢測紅細胞內MTXPG濃度。常規ELISA可檢測到mg/mL數量級,但是紅細胞中MTXPG含量為ng/mL數量級[14-17]。本課題組前期研究已經研發出生物素-親和素偶聯放大競爭ELISA MTX檢測試劑盒,檢測靈敏度為0.087 ng/mL,檢測下限為0.2 ng/mL,檢測線性范圍為0.1~10.0 ng/mL,該方法滿足本課題組要求。本研究結合MTXPG結構特點,選擇將紅細胞內MTXPG體外轉為MTX后采用ELISA檢測的最適條件。
本研究采用凍融法、化學裂解法、酶法、超聲破碎法四種方法裂解紅細胞,發現凍融法與反復凍融法顯著優于酶法和化學裂解法(P<0.05),超聲破碎法需要超聲細胞破碎儀,考慮到方法可推廣性,筆者采用反復凍融法裂解紅細胞。筆者研究凍融時間、溫度、次數后發現,在-80℃下凍存10 min,56℃下復融2 min凍融2次可完全裂解紅細胞。考慮到部分基層醫院可能無-80℃冰箱,筆者研究發現-20℃下凍存60 min,37℃下復融7 min凍融2次也可達到實驗要求。轉化保護液壞血酸配制的保護液顯著優于巰基乙醇(P<0.05)。在37℃避光孵育3 h MTXPG可完全轉化為MTX。高氯酸、三氯乙酸、飽和硫酸銨溶液3種蛋白沉淀劑無明顯差異(P>0.05),最適pH為6~8,最佳pH值為6.8。標準曲線采用對數4參擬合相關性高達0.9934,靈敏度為0.096 ng/mL,線性范圍為0.2~10.0 ng/mL。精密度試驗:回收率為96.6%~103.3%,RSD=8.0%~14.3%,日內差異為1.7%~11.7%,日間差異為7.4%~13.5%,RSD均小于15%,滿足臨床檢測要求[18]。檢測患者紅細胞內MTXPG濃度為(64.75±28.45)ng/mL。與國內外研究基本一致[14-15,19]。
本研究采用ELISA方法檢測紅細胞內MTXPG濃度,充分利用了ELISA高效、靈敏、特異、低成本、操作簡便等優點,建立了體外MTXPG轉化MTX、ELISA檢測MTX的標準方法。該方法有良好的準確性和特異性,可用于臨床紅細胞內MTXPG濃度監測。
[1]Huffman DH,Wan SH,Azarnoff DL,et al.Pharmacokinetics ofmethotrexate[J].Clinical Pharmacology and Therapeutics,1973,14(4):572-579.
[2]Baugh CM,Krumdieck CL,Nair MG.Polygammaglutamyl metabolites of methotrexate[J].Biochemical and Biophysical Research Communications,1973,52(1):27-34.
[3]Chabner BA,Allegra CJ,Curt GA,et al.Polyglutamation of methotrexate.Is methotrexate a prodrug?[J].Journal of Clinical Investigation,1985,76(3):907.
[4]胡椿艷.葉酰多聚谷氨酸合成酶與甲氨蝶呤敏感性的關系[J].國際兒科學雜志,2012,39(2):183-186.
[5]Willner N,Storch S,Tadmor T,etal.Almosta tragedy:severe methotrexate toxicity in a hemodialysis patient treated for ectopic pregnancy[J].European JournalofClinicalPharmacology,2014,70(3):261-263.
[6]Frandsen TL,Abrahamsson J,Lausen B,et al.Individualized toxicity-titrated 6-mercaptopurine increments during high-dose methotrexate consolidation treatment of lower risk childhood acute lymphoblastic leukaemia[J].Br J Haematol,2011,155(2):244-247.
[7]Shea B,Swinden MV,Ghogomu ET,et al.Folic acid and folinic acid for reducing side effects in patients receiving methotrexate for rheumatoid arthritis[J].J Rheumatol,2014,41(6):1049-1060.
[8]Stamp LK,O'Donnell JL,Chapman PT,et al.Determinants of red blood cell methotrexate polyglutamate concentrations in rheumatoid arthritis patients receiving longterm methotrexate treatment[J].Arthritis&Rheumatism, 2009,60(8):2248-2256.
[9]den Boer E,de Rotte MC,Pluijm SM,et al.Determinants oferythrocyte methotrexate polyglutamate levels in rheumatoid arthritis[J].The JournalofRheumatology,2014,41(11):2167-2178.
[10]Suyagh MF,Iheagwaram G,Kole PL,et al.Development and validation of a dried blood spot-HPLC assay for the determination of metronidazole in neonatal whole blood samples[J].AnalBioanal Chem,2010,397(2):687-693.
[11]BouquiéR,Deslandes G,Bernáldez BN,et al.A fast LC-MS/MS assay for methotrexate monitoring in plasma:validation,comparison to FPIA and application in the setting of carboxypeptidase therapy[J].Analytical Methods,2014,6(1):178-186.
[12]李明,沈佐君.氨甲蝶呤多聚谷氨酸的檢測及其臨床應用價值[J].生命的化學,2008,28(5):603-605.
[13]Blits M,Jansen G,Assaraf YG,et al.Methotrexate normalizes up-regulated folate pathway genes in rheumatoid arthritis[J].Arthritis&Rheumatism,2013,65(11):2791-2802.
[14]Den Boer E,Meesters RJW,Van Zelst BD,et al.Measuring methotrexate polyglutamates in red blood cells:a new LC-MS/MS-based method[J].Analytical and Bioanalytical Chemistry,2013,405(5):1673-1681.
[15]Dervieux T,Lein DO,Marcelletti J,et al.HPLC determination of erythrocyte methotrexate polyglutamates after low-dose methotrexate therapy in patients with rheumatoid arthritis[J].Clinical Chemistry,2003,49(10):1632-1641.
[16]李文敏.酶聯免疫吸附反應的技術進展及應用[J].湖北職業技術學院學報,2003,6(4):65-69.
[17]張晟,羅弟祥,劉怡,等.生物膜干涉技術、HPLC及ELISA在抗體定量檢測中的比較分析[J].免疫學雜志,2014,30(4):338-341.
[18]臧亮,王東,鄧雪蓮,等.ISO15189在酶聯免疫檢測性能驗證方法的探討[J].中國輸血雜志,2014,27(7):689-691.
[19]羅彥,王志中,王勇,等.多聚谷氨酸化甲氨蝶呤濃度與類風濕關節炎療效相關性研究[J].第三軍醫大學學報,2011,33(5):473-476.
A novel method to establish and its preliminary application for determi鄄nation of concentrations of methotrexate polyglutamates in erythrocytes by enzyme-linked immunosorbent assay
MU Fangxiang WU Hong WANG Heng ZOU Desheng WANG Yong FANG Yongfei
Department of Integrated Traditional and Western Medicine,the First Affiliated Hospital of the Third Military Medical University,Chongqing 400038,China
ObjectiveTo establish a novel method that determines concentrations of methotrexate polyglutamates (MTXPG)in erythrocytes by enzyme-linked immunosorbent assay(ELISA).MethodsMTXPG-containing erythrocytes were lysed with a series of different methods,including freeze-thawing,chemical lysis,enzymatic lysis,ultrasonication. MTXPG was transformed into methotrexate(MTX)in the treatment of ascorbic acid or mercaptoethanol after serum and cell lysis buffer were added.Perchloric acid,trichloroacetic acid and saturated ammonium sulfate solution were adopted to precipitate proteins of the transforming solution.ELISA was adopted to measure concentrations of MTX following adjustment of pH value from 3.0 to 9.0.The accuracy of the method were evaluated by detecting clinical samples after methodology validation.ResultsFreeze-thawing and ultrasonication for lysis of erythrocytes were significantly better than enzymatic lysis and chemical lysis(P<0.05).In the process of MTXPG transforming,scorbic acid was significantly better than mercaptoethanol.MTXPG was completely transformed in the condition of incubation of transforming solutions incubation at 37℃for 3 h.Protein precipitation was showed no statistical difference in the Perchloric acid, trichloroacetic acid and saturated ammonium sulfate solution(P>0.05).The scope of pH was 6-8 and the optimal pH value was 6.8.The results showed a good linear relation of concentration in the range of 0.2 to 10.0 ng/mL(r=0.9967, recovery rate was 96.6%-103.3%,RSD=8.0%-14.3%,within-day and between-day accuracy were 1.7%-11.7%,7.4% -13.5%.Concentrations of MTXPG in erythrocytes of patients was(64.75±28.45)ng/mL.ConclusionBesides simple and easy operation,the established method shows excellent accuracy and specificity,which can provide a novel pathway for clinical detection for concentrations of MTXPG in erythrocytes.
Polyglutamate Methotrexate;Methotrexate; Enzyme-linked immunosorbent assay;Lysis
R593.22
A
1673-7210淵2015冤01淵c冤-0091-04
2014-10-25本文編輯:衛軻)
國家自然科學基金資助項目(編號81373180);衛生公益性行業科研專項(編號201202004)。
牟方祥(1984.10-),男,第三軍醫大學2012級內科學風濕病專業在讀碩士生;研究方向:風濕病治療藥物研究。
方勇飛(1964.3-),男,博士,主任醫師,教授;研究方向:風濕病診斷與治療。

